基于网络药理学和分子对接探讨枇杷叶防治Ⅱ型糖尿病的作用机制
2022-10-30孔红铭叶嘉昕赵雅婷赵楠星夏旭东戚向阳陈秋平
孔红铭 叶嘉昕 赵雅婷 赵楠星 夏旭东 戚向阳 陈秋平
(浙江万里学院生物与环境学院,浙江 宁波 315100)
糖尿病(diabetes mellitus,DM)是一组以高血糖为特征的代谢性疾病,通常分为Ⅰ型糖尿病(type 1 diabetes mellitus,T1DM)和Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM),临床上绝大多数患者属于T2DM。根据国际糖尿病联合会(International Diabetes Federation, IDF)数据显示,截止2021年12月,我国糖尿病患者人数已达到1.4亿,是全球糖尿病患病人数最多的国家,到2030年,成人糖尿病年发病率预计将增加69%[1]。有效控制血糖水平是预防或逆转T1DM和T2DM及其并发症,提高生活质量的关键。天然α-葡萄糖苷酶(α-Glucosidase)抑制剂因副作用小,能够有效控制糖尿病患者餐后血糖上升,是辅助治疗T2DM的首选药物。但目前市面上的α-葡萄糖苷酶抑制剂大多为人工合成,会引起腹胀[2]、腹泻[3]、腹痛[4]等不良反应。已有研究表明,从植物提取物中分析鉴定糖苷酶和脂肪酶抑制剂,能够快速筛选潜在的降糖活性成分。如陈海君等[5]运用亲和超滤技术从毛菊苣种子提取物中筛选并鉴定出4种α-葡萄糖苷酶抑制剂;Chen等[6]通过沉淀交联法将猪胰脂肪酶固定在金属有机骨架上,筛选了夏枯草中的脂肪酶抑制剂,获得13种可抑制脂肪酶的小分子化合物。
枇杷叶为蔷薇科植物枇杷(Eriobotryajaponica)的干燥叶,作为传统中药,其性微寒、味苦,有清肺止咳、和胃利尿之功效[7],主要化学成分为三萜酸类、黄酮类、多酚类等物质。近年来,枇杷叶提取物在抗炎[8]、抗氧化[9-10]、降血糖[11]等方面的作用逐渐受到关注。由于中药发挥疗效时具有多成分多靶点的特点,因此,枇杷叶抗糖尿病的作用机制也十分复杂,现阶段缺乏对枇杷叶抗糖尿病的药效成分及作用机制的整体认识。
网络药理学是一门基于系统生物学理论的新学科,主要内容为生物系统的网络分析,可以从整体水平考察“药物-靶点-疾病”之间的复杂网络关系[12],为表达及解释传统中药多成分、多靶点、多调控通路的协同关系提供技术支撑。已有研究者采用网络药理学方法,对天然产物与疾病之间的作用关系进行多通路分析,如吴丹等[13]运用网络药理学技术对柴胡抗抑郁机制进行了预测,发现柴胡主要通过调节蛋白磷脂酰肌醇激酶-蛋白激酶B (phosphatidylinositol 3 kinase protein kinase B,PI3K-AKT)、丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)、肾素血管紧张素系统(renin angiotensin system,Ras)和骨骼肌叉头框转录因子O (forkhead transcription factor O,FoxO)等信号通路来发挥抗抑郁作用。本研究以枇杷叶为研究对象,采用网络药理学方法探究枇杷叶多途径、多层次、多靶点间复杂的相互作用关系,旨在从天然产物中寻找药效温和、毒副作用小的α-葡萄糖苷酶抑制剂,以解决糖尿病人的实际需求。
1 材料与方法
1.1 试验材料
α-葡萄糖苷酶(50~120 kDa),西格玛奥德里奇(上海)贸易有限公司;阿卡波糖、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG),上海阿拉丁生化科技股份有限公司;槲皮素、鞣花酸、β-谷甾醇、山奈酚、异鼠李素、表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)、科罗索酸对照品,均购自上海源叶生物科技有限公司。
1.2 仪器与设备
TU-1810可控温紫外分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 构建枇杷叶活性成分潜在作用靶标库、相互作用网络图 登录中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology,TCMSP,https://tcmspw.com/tcmsp.php),设置类别为“Herb name”,使用“pipaye”作为检索关键词,以化合物口服药物生物利用度(oral bioavailability,OB)和类药性(drug-like,DL)为依据[14],分别将二者参数设置为OB≥30%和DL≥0.18[15]进行初筛,获得活性成分及靶点。其中活性成分科罗索酸OB值为15.86,未能通过初筛,但宋星等[11]、许舒雯[16]研究表明该物质具有降血糖作用,因此将其列入其中。借助Uniprot数据库(https://www.uniprot.org/)对靶点名称标准化处理。将活性成分及靶点信息导入至Cytoscape 3.7.0,生成“活性成分-作用基因”相互关系网络图。
1.3.2 通过共同靶点构建成分-疾病相互关系网络 登录人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,https://omim.org/)、人类基因数据库(Genecards,https://www.genecards.org/),以“type 2 diabetes mellitus”为关键词进行检索,由此得到Ⅱ型糖尿病基因。将疾病靶点与成分靶点导入Venny 2.1数据库(https://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,交集靶点即为枇杷叶潜在治疗Ⅱ型糖尿病作用靶点。将交集靶点与对应活性成分导入Cytoscape 3.7.0,建立“成分-疾病靶点”相互作用网络图,从而进一步探讨枇杷叶活性成分协同防治T2DM的药理作用。
1.3.3 蛋白-蛋白相互作用网络的构建 将交集靶点上传至STRING数据库平台(Search tool for recurring instances of neighbouring genes,https://string-db.org/cgi/input.pl),设定物种为“Homo sapiens”,获取蛋白-蛋白相互作用网络(protein to protein interaction, PPI),以“TSV”格式导出,使用Cytoscape 3.7.0 “Network Analyzer”分析插件获取自由度、中心度数、介数,三者同时大于平均值的交集靶点即为枇杷叶防治T2DM的关键靶点。
1.3.4 关键靶点的GO分析及KEGG通路分析 将共同靶点上传至Metascape分析平台(https://metascape.org/gp/index.html#/main/step1),构建可视化网络。选择物种为“Homo sapiens”,进行基因本体论(Gene Ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,并规定P<0.01,筛选符合条件的条目进行数据可视化分析。
1.3.5 分子对接 将筛选得到的自由度值较高的关键化合物与α-葡萄糖苷酶(PDB ID:3A4A)进行分子对接,首先借助Chem3D软件将化合物进行能量最小化处理,在PDB数据库(https://www.rcsb.org/)检索3A4A,保存为pdb格式,使用Pymol 2.5.0软件对蛋白结构删除水分子、去除修饰配体,再使用AutoDock Tools 1.5.6将枇杷叶关键活性成分和3A4A转换为pdbqt格式,并通过AutoDock Vina 1.1.2进行分子对接,最后运用Pymol 2.5.0将分子对接能量较小且构象稳定的化合物与3A4A进行可视化处理[17]。棍状结构为配体分子,细线状结构为距离活性分子5Å范围内的氨基酸残基,黄色虚线表明配体分子与氨基酸残基之间具有氢键相互作用。
1.3.6 活性抑制试验验证 用0.1 mmol·L-1磷酸缓冲盐溶液(phosphate buffer saline,PBS,pH值6.8)将α-葡萄糖苷酶配制成1.5 U·mL-1的溶液,用于酶活性分析。
测定样品对α-葡萄糖苷酶的抑制活性:比色皿中加入1.8 mL PBS缓冲液,于37℃预热5 min,待其温度稳定后,加入5 mmol·L-14-硝基苯-α-D-吡喃葡萄糖苷溶液(4-nitrobenzene-α-D-glucopyranoside,PNPG)100 μL,再加入不同体积梯度(10、20、30、40、50、60、70、80、90、100 μL)的样品溶液(0.03 mg·mL-1),然后迅速加入20 μL 1.5 U·mL-1酶液,摇匀,于405 nm处监测其2 min内吸光度值的变化,计算酶活性(enzymatic activity,EA)[18-19];测定阳性对照阿卡波糖的酶活性同理,仅需将样品溶液替换为阿卡波糖溶液(5 mmol·L-1)即可;测定空白酶活时,无需添加任何抑制剂,其余步骤同上。抑制率计算公式如下:

其中,EA为酶活力系数,U·mL-1。
2 结果与分析
2.1 活性化合物筛选结果
通过TCMSP数据库筛选符合OB、DL值的化合物,得到19种结果,汇总见表1。

表1 枇杷叶19种活性成分信息表Table 1 Information table of 19 active ingredients of Loquat leaf
2.2 化合物、疾病靶点筛选结果
收集19种活性成分各自对应的靶点基因,得到294种结果,并构建有效成分靶标库。通过OMIM、Genecards数据库检索T2DM相关基因,收集相关度大于40以上的基因信息,删除重复基因后共获得731条结果,汇总为疾病数据库。
2.3 “活性成分-作用基因”网络图的构建及分析
将2.1中收集到的活性成分及其对应的靶点信息录入Cytoscape 3.7.0生成“活性成分-作用基因”网络图,结果见图1。图中共有309个节点、484条边,节点间的连线表明二者之间存在相互作用关系,连线越密集表示二者之间的关联度越高。其中,MOL00098(槲皮素)匹配到的靶标数最多,为142个,MOL006821(EGCG)、MOL000422(山奈酚)、MOL005508(科罗索酸)、MOL000354(异鼠李素)和MOL000358(β-谷甾醇)对应的靶标数量较多,依次为52、44、40、34和32个,因此,以上活性成分可能在诸如糖尿病、高血脂、高血糖等疾病的治疗或辅助治疗中发挥不同的作用。此外,由于TCMSP数据库未收录MOL001663(3-表齐墩果酸)、MOL012556(23-反式-p-香豆酸)、MOL012593、MOL012617(圆酵母烯素)化合物的相关靶点,因此将其删去。

图1 枇杷叶“活性成分-作用基因”网络图Fig.1 “Component-action gene” network of loquat leaf
2.4 交集基因获得结果
将294个活性成分靶点与731个T2DM靶点通过Venny 2.1绘制维恩图(图2),二者重合区域即为交集基因,得到95个结果。

图2 枇杷叶与Ⅱ型糖尿病靶点基因维恩图Fig.2 Venn diagram of the targets of Loquat leaf and type 2 diabetes mellitus
2.5 “活性成分-疾病靶点”网络图的构建及分析
将韦恩图绘制得到的交集靶点依照2.3同法制作得到“活性成分-疾病靶点”网络图(图3),网络共包含100个节点与164条边。其中,MOL00098(槲皮素)匹配到的靶标数仍然最多,为59个,其次为MOL006821(EGCG),匹配到41个靶标,MOL000422(山奈酚)、MOL000354(异鼠李素)和MOL005508(科罗索酸)对应的靶标数量依次为14、11和7个,说明枇杷叶提取物用于防治Ⅱ型糖尿病时,主要通过以上活性成分作用于相同或不同的靶标,进而调节不同的代谢通路,从而发挥疗效。

图3 枇杷叶“活性成分-疾病靶点”网络图Fig.3 “Component-disease target” network of Loquat leaf
2.6 “活性成分-疾病靶点”网络图的构建及分析
将筛选得到的95个成分-疾病交集靶点上传至STRING在线蛋白互作关系分析平台,得到PPI网络图,如图4所示。

图4 枇杷叶与Ⅱ型糖尿病蛋白-蛋白互作网络图Fig.4 The protein-protein interaction network of Loquat leaf and type 2 diabetes mellitus
PPI网络中各个蛋白节点的平均自由度为 20.347 4, 平均介数为0.002 6,平均中心度数为0.691 5,三者同时大于平均值的靶点有15个,汇总见表2,由此判断这些靶点极有可能是枇杷叶活性成分用于防治T2DM的关键靶点。

表2 枇杷叶防治T2DM关键基因基本信息表Table 2 Basic information table of key genes in prevention of T2DM with loquat leaf
2.7 GO分析结果
GO富集分析结果表明(图5),生物过程(biological process,BP)主要涉及对脂多糖的反应、上皮细胞增殖、氧化应激反应、蛋白丝氨酸/苏氨酸激酶活性的调节、凋亡信号通路的调控等方面;分子功能(molecular function,MF)主要涉及DNA-结合转录因子结合、泛素-类蛋白连接酶结合、生长因子结合等方面;细胞组成(cellular component,CC)主要涉及膜筏、膜微区、质膜外侧、细胞-衬底结、早期内体等。

图5 GO功能富集分析图Fig.5 GO functional enrichment analysis diagram
2.8 KEGG分析结果
如图6所示,富集程度较高的代谢通路主要包括脂质与动脉粥样硬化、晚期糖基化产物-晚期糖基化终末产物受体(advanced glycosylation end products-receptor of AGE, AGE-RAGE)信号通路、肿瘤坏死因子(tumor necrosis factor, TNF)信号通路、低氧诱导因子1(hypoxia inducible factor-1, HIF-1)信号通路等,表明枇杷叶活性成分通过以上多条代谢通路发挥防治T2DM的作用。

注:气泡大小与颜色表示代谢通路富集程度,气泡越大,颜色越深表明富集程度越高。Note: The bubble size and color in the figure indicate the enrichment degree of metabolic pathway. The larger the bubble,the deeper the color, and the higher the enrichment degree.图6 KEGG通路富集分析气泡图Fig.6 Bubble diagram of KEGG pathway enrichment analysis
2.9 分子对接结果
由表3可知,EGCG与3A4A结合能小于-10.0 kcal·mol-1,其次金鸡纳素 1a、原飞燕草素 B6、β-谷甾醇与3A4A的结合能均小于-9.0 kcal·mol-1,具有非常强烈的结合活性[20-21]。运用Pymol 2.5.0进行可视化处理,结果如图7所示。以槲皮素为例,它能够顺利与3A4A蛋白的活性口袋进行结合,通过与活性口袋的ASN317、ASN415、GLY161、LYS156、ASP233、ASN235、GLU429氨基酸形成分子间氢键,从而维持配体与蛋白活性口袋的稳定。

表3 枇杷叶关键成分与3A4A对接结果Table 3 Docking results of key components of loquat leaf with 3A4A

图7 枇杷叶关键活性成分与3A4A对接可视化三维图Fig.7 3D visualization of the docking of key active components of loquat leaf with 3A4A
2.10 体外酶活性抑制验证
根据分子对接结果,选择EGCG、β-谷甾醇、科罗索酸、槲皮素、异鼠李素、鞣花酸、山奈酚进行体外酶活性抑制试验,结果见图8。考虑到临床上常用阿卡波糖作为α-葡萄糖苷酶抑制剂,因此设置阿卡波糖为阳性对照组,测得其半抑制浓度(50% inhibitory concentration,IC50)值为126.98 μmol·L-1。
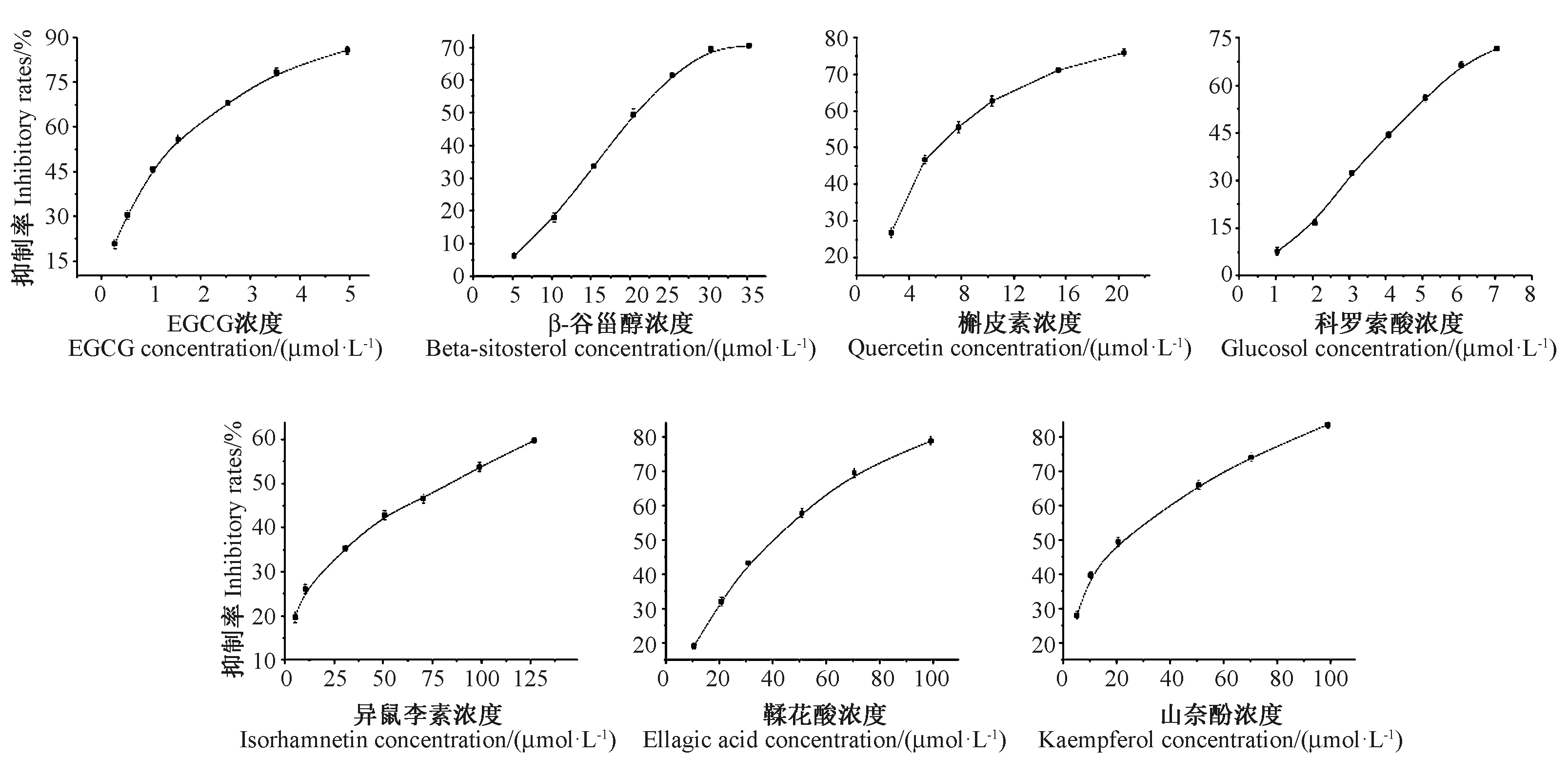
图8 活性成分对α-葡萄糖苷酶抑制作用Fig.8 Inhibition effect of active ingredient on α-glucosidase
体外酶抑制结果表明,枇杷叶中主要活性成分的IC50值依次为EGCG(1.11 μmol·L-1)<科罗索酸(4.43 μmol·L-1)<槲皮素(6.39 μmol·L-1)<山奈酚(17.77 μmol·L-1)<β-谷甾醇(21.05 μmol·L-1)<鞣花酸(36.35 μmol·L-1)<异鼠李素(80.04 μmol·L-1) <阿卡波糖(126.98 μmol·L-1),IC50值越低,表明对α-葡萄糖苷酶的抑制效果越好。EGCG的抑制活性最强(IC50值为1.11 μmol·L-1),这与分子对接结果吻合,其余有效成分与酶的结合力十分强烈,说明核心有效成分能够与酶自发且稳定地结合,因此,以上活性成分可作为高效α-葡萄糖苷酶抑制剂。
3 讨论
我国是中药大国,独特的传统药学理论让中药在糖尿病及其并发症的治疗方面有着良好的效果和广阔的前景。网络药理学作为一门新学科,与枇杷叶这一味传统中药相结合,能够从靶点通路的角度分析枇杷叶用于防治Ⅱ型糖尿病的机理。因此本研究采用网络药理学和分子对接技术对枇杷叶防治Ⅱ型糖尿病的机制进行探讨。
通过构建“活性成分-作用基因”、“活性成分-疾病”网络图发现,槲皮素在二图中均为关键节点,经分子对接验证了其与α-葡萄糖苷酶有较强的结合活性。研究证实,槲皮素具有降血糖[22-23]、降血脂[24-25]、抗炎[26-27]、抗氧化[28]等多种药理作用。翟云鹏等[29]通过诱导高血脂症大鼠模型发现,槲皮素能够降低其血糖、血脂并有效改善高血糖导致的肾功能损伤。
将枇杷叶"活性成分-疾病靶点"网络图进行靶点间相互作用分析,通过自由度值筛选发现IL6、TNF、AKT1、TP53、MAPK3、PTGS2是枇杷叶防治T2DM的关键靶点。IL6、TNF和AKT1能够激活下游蛋白,促进细胞内能量代谢,增加葡萄糖消耗,抑制脂质的合成,从而调控葡萄糖和脂质代谢[30-32]。相关研究表明,TP53可能通过诱导骨骼肌中的氧化应激反应对胰岛素信号通路进行调节,从而调控胰岛素抵抗的发展[33]。MAPK3在糖尿病、肾病的发病过程中,可能参与肾小球系膜细胞表型转化,导致肾小球细胞外基质堆积,造成肾小球硬化[34]。PTGS2可能对Ⅱ型糖尿病发挥调节作用,PTGS2产生前列腺素,前列腺素负向调控葡萄糖刺激的胰岛素分泌[35]。因此,枇杷叶活性成分可能作用于以上靶点,进而发挥防治Ⅱ型糖尿病的作用。
通过GO和KEGG富集分析发现,AGE-RAGE、HIF-1、PI3K-Akt、TNF、叉头转录因子O(forkhead box O, FoxO)、IL-17信号通路是枇杷叶防治Ⅱ型糖尿病的主要通路,槲皮素、山奈酚、异鼠李素等化合物正是通过以上信号通路影响了T2DM的发展进程。Fox O在胰岛素调节肝脏糖异生的信号通路中起重要作用,Fox O的高表达能够引起糖脂代谢异常,通过抑制Fox O的蛋白表达,并促进Fox O磷酸化表达,达到改善肝脏胰岛素抵抗的效果[36]。磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase, PI3K)-蛋白激酶B(protein kinase B, Akt)信号通路是肝脏中胰岛素发挥作用的主要信号通路[37]。PI3K-Akt活化后能够激活下游蛋白,促进细胞内能量代谢,增加体内葡萄糖消耗,从而抑制体内脂质的合成,槲皮素、山奈酚作为常见的膳食类黄酮,具有抗炎、抗氧化、抑制AGE在血管内蓄积等生物学功能,其机制与PI3K-Akt通路、AGE-RAGE通路密不可分。科罗索酸能够激活Akt磷酸化,下调Fox O等糖异生相关基因的表达,改善胰岛素抵抗。AGE-RAGE信号通路可促进炎症因子的表达和释放,诱导细胞凋亡和促进血管新生,降低AGE-RAGE水平可有效延缓肾脏纤维化病理改变[38-39]。异鼠李素是常见的黄酮类化合物之一,具有抗氧化、抗糖尿病、抗肿瘤等生物学活性,可通过AGE-RAGE、HIF通路降低血糖含量。HIF-1信号通路是机体低氧应激反应时的主要靶点[40],研究表明,抑制糖尿病小鼠HIF-1α的表达,能抑制Ras同源基因家族成员A(Ras homolog gene family, member A, Rho A)/Rho蛋白激酶(Rho protein kinase, ROCK)信号转导通路,从而降低糖尿病小鼠的血糖水平[41]。
由于人体内的α-葡萄糖苷酶是临床上用于降血糖的关键靶点,因此将筛选得到的活性成分与α-葡萄糖苷酶进行计算机辅助分子对接模拟。结果表明,α-葡萄糖苷酶与枇杷叶10种主要活性成分的结合能均≤-8.0 kcal·mol-1, 结合活性较强,与EGCG的结合能低至-10.2 kcal·mol-1, 亲和力十分强烈。体外酶活性抑制验证发现,随着作用浓度提高,活性成分抑制率也逐渐提高,呈现出一定的浓度依赖性,且各成分IC50值均小于阿卡波糖,因此,枇杷叶活性成分可作为高效α-葡萄糖苷酶抑制剂。
在对枇杷叶活性成分进行初筛时,已获得4种金鸡纳素同分异构体,经过网络药理学复筛,保留其中2种同分异构体(金鸡纳素1a和金鸡纳素1c),且分子对接结果表明,二者与α-葡萄糖苷酶的亲和力总体而言十分优异,可对二者进行体外酶抑制验证。Patel等[42]研究发现,金鸡纳素lb能够用作胰岛素促进剂,增加大鼠胰岛素分泌。由于金鸡纳素lc目前在国内无供货商,因此暂时无法对其进行体外试验,具体抑制效果有待进一步深入研究。
4 结论
本研究发现,枇杷叶主要通过槲皮素、山奈酚、鞣花酸、科罗索酸等活性成分来调节氧化应激反应、丝氨酸/苏氨酸激酶活性、对脂多糖的反应和上皮细胞增殖等,进而调控AGE-RAGE、HIF-1和PI3K-Akt等信号通路,从而对Ⅱ型糖尿病发挥调节作用。研究结果为枇杷叶用于防治Ⅱ型糖尿病的作用机制提供了理论指导。
