大豆分离蛋白-多糖体系对甜菊糖苷苦味的抑制作用及复合乳液稳定性研究
2022-10-24邢琳琳朱力杰
邢琳琳,朱力杰
(渤海大学食品科学与工程学院 辽宁锦州 121013)
随着低糖理念逐渐深入人心,甜味剂受到了食品生产者和消费者的广泛关注,其中甜菊糖苷(stevia glycosides,STE) 是研究较多的甜味剂之一。甜菊糖苷亦称甜菊糖或甜菊苷,主要来源于甜叶菊(stevia rebaudia)的叶子中,是一种具有清凉甜味,白色或微黄色结晶性粉末状二萜类化合物的混合物[1-4],因高甜度、低热量等特点而被誉为继甜菜和甘蔗后的世界“第三大糖源”。其主要组成成分包括甜菊苷(stevioside)、莱鲍迪甙A、B、C、D、E、F、杜克苷A (dulcoside A)、甜茶苷(rubusoside)、甜菊双糖苷(steviolbioside)等[5]。我国是STE生产大国,生产量约占全球份额的80%[6]。STE 甜度约为蔗糖的250~400 倍,热量仅为蔗糖热量的1/300,且其甜度感知域极低(约为0.002%),是一种替代蔗糖的理想型甜味剂。然而,当使用达到一定剂量时其苦味较重,严重影响其商业化推广。采取有效措施来改善STE 的苦味显得尤为重要。
目前改善STE 苦味的方法主要有酶促修饰法、微生物转化法、分离纯化莱鲍迪甙A 法等[7]。酶促修饰法最早开展于日本,所用的酶种类丰富,例如环糊精葡萄糖基转移酶、β-味喃果糖苷酶、β-半乳糖苷酶及β-淀粉酶等[8]。Mizutani 等[9]和Fukunaga 等[10]利用环糊精葡萄糖基转移酶对甜菊苷进行酶法修饰,改变其C13 和C19 位的糖基数量,使甜菊苷的味感得以改善,且甜菊苷苦味强弱与C19 位葡萄糖基数目呈正相关。微生物转化法主要指利用链霉菌属W19-1 细胞内酶系、放线菌属K-128 菌株、藤仓赤霉的无细胞提取物等微生物系统,对甜菊苷的糖基进行修饰或使其降解为甜菊醇,从而达到改善味质的目的[11-13]。除此之外,乳铁蛋白因具有疏水性区域,也常被用作苦味分子的纳米载体[14-15]。有研究表明采用大豆多糖(soybean soluble polysaccharide,SSP)对芦荟苷、穿心莲内酯、氧化苦参碱3 种苦味成分均有一定的抑苦效果,且SSP 质量分数与抑苦效果呈正比,对其作用机制未作详细说明[16]。
蛋白、多糖等大分子可以形成物理屏障(如纳米胶囊、乳液、悬浮液等),对苦味起到一定的屏蔽作用[17]。大豆分离蛋白(soy protein isolate,SPI)通常以低温脱脂豆粕为原料,经离心分离等工艺获得,是一种天然的表面活性剂,因具有电荷相反的羧基基团与氨基基团而具有两亲性,可以形成致密的界面薄膜包裹于油滴表面,降低油-水界面张力值,常被用于稳定O/W 乳液的乳化剂[18-19]。当SPI 在油-水界面发挥乳化作用时,肽链舒展使得疏水基团暴露,亲水基团重新排列,产生静电作用,起维持乳液稳定的作用[20-22]。如在饮料制品加工中常作稳定剂使用。在O/W 乳液中,大豆多糖(soy soluble polysaccharide,SSP)可以和蛋白等大分子联用,起到增强乳液稳定性的作用[17]。两者复合使用,在食品、化妆品、药品等领域得以广泛应用。
本研究采用SPI-SSP 复合体系,研究水溶液及乳液两种状态下对STE 的苦味抑制效果。以感官评分为依据,对抑苦体系进行综合评判,并表征较优的抑苦效果体系,以获取最佳抑苦体系。
1 材料与方法
1.1 材料与试剂
大豆蛋白,山东禹王生态食品有限公司;大豆多糖,山东聚源生物科技有限公司;甜菊糖苷(纯度≥99%),山东圣香远生物科技有限公司;长寿花玉米油,山东三星玉米产业科技有限公司;Florisil 分子筛(60~100 目),Sigma 公司;二水合磷酸二氢钠、十二水合磷酸氢二钠,国药集团化学试剂有限公司。
1.2 仪器与设备
FJ200-SH 高速分散均质机,上海标本模型厂;HL-2000 高压均质机,上海弗鲁克流体机械制造有限公司;Nano-ZS90 激光粒径分布仪,英国马尔文仪器公司;NanoBrook90 Zeta-电势分析仪,美国布鲁克海文仪器公司;OCA-20 视频光学接触角测量仪,德国Data-physics 公司;Biofuge Stratos高速冷冻离心机,美国Thermo 公司;Turbiscan Lab Expert 稳定性分析仪,法国Formulaction 公司。
1.3 试验方法
1.3.1 待测感官溶液配制
1.3.1.1 SPI-SSP-STE 水溶液的配制 将一定量的SPI、SSP、STE 分别溶解于10 mmol/L 中性磷酸盐缓冲液中,在室温(25 ℃)搅拌2 h,之后置于冰箱(4 ℃)中进行过夜处理,以使SPI 充分水化。按感官试验要求分别配制不同质量分数配比的SPISSP-STE 水溶液,室温(25 ℃)下搅拌30 min 使其均匀混合,制得待测定溶液。
1.3.1.2 SPI-SSP-STE 乳液的配制 将一定量的SPI、SSP、STE 分别溶解于10 mmol/L 中性磷酸盐缓冲液中,在室温(25 ℃)搅拌2 h,之后置于冰箱(4 ℃)中进行过夜处理,以使SPI 充分水化。按试验所需配制不同质量分数配比的SPI-SSP-STE 复合乳液体系,其中油相质量分数始终保持10%,首先经高速分散均质机均质处理 (14 000 r/min,3 min),初步乳化后得到初级乳液,再经过2 次高压均质处理(50 MPa)后调节乳液pH 值至中性,得到最终待测乳液。
1.3.2 感官测评指标 感官测评试验采用感官综合评分法对新鲜制备的两种溶液进行测评,所有感官测评人员在测试试验开始前1 h 尽可能禁止进食,主要是重辣、刺激性严重影响感官测评的食物。挑选10 名经过培训的人员对两种溶液体系的滋味、外观、气味三方面进行感官评定并打分(满分为100 分),取平均值作为最终测评结果。具体测评流程为分别取20 mL 待测评溶液于一次性烧杯中,感官测评员在口中停留30 s 后吐出,随后用矿泉水漱口,必要时可用苏打饼干去除口中余味,两个样品感官测评时间间隔为20 min。

表1 溶液苦味感官测评指标Table 1 Sensory evaluation index of solution bitterness
1.3.3 玉米油的纯化 试验中为防止玉米油中可能含有的表面活性物质对试验结果造成干扰,试验所用均为纯化玉米油。参考Gaonkar[23]报告中所讲述的方法,将4 g Florisil 分子筛加入到100 mL玉米油中,匀速搅拌120 min 使玉米油中可能存在的活性物质充分被分子筛吸附,接着采用冷冻离心机10 000 r/min 离心操作20 min 去除杂质,离心至玉米油与去离子水间界面张力值30 min不发生变化为止。最终得到纯化的玉米油对纯水的界面张力为(25.95±0.5)mN/m,其密度为0.9169 g/cm3。
1.3.4 动态界面张力的测定 将SPI、SSP、STE 样品分别溶解于10 mmol/L 中性磷酸盐缓冲液中,在室温(25 ℃)搅拌2 h,之后置于冰箱(4 ℃)中进行过夜处理,以使SPI 充分水化。将SPI、SSP 和STE 溶液调节pH 值至7.0 后进行不同质量分数配比的混合溶液的制备,其中STE 和SSP 的最终质量分数分别固定为0.5%和0.3%,SPI 质量分数为0.1%~2.0%。混合溶液于室温下继续搅拌30 min,以确保3 种成分之间的相互作用充分发生。
参考Wang 等[24]的报告中,采用视频光学接触角测量仪测定STE 以及STE-SSP-SPI(0.1%~2.0%)复合体系在油-水界面上的界面张力(γ),试验进行中应注意避免外界振动引起的试验误差。测试前将待测样加入注射针中,平衡30 min 达到试验所需恒定温度25 ℃,由电动控制单元注射10 μL样品液滴于装有纯化玉米油的光学玻璃比色杯中,静置测定180 min。高清摄像机对180 min 液滴图像进行全程拍摄后形成视频通过SCA20 软件进行分析,采用Young-Laplace 方程计算测试样品的表面张力(γ)。表面压(π)为样品的表面张力值(γ0)与磷酸盐缓冲液的表面张力值(γ)的差值。
1.3.5 粒径的测定 参考Sun 等[25]的方法并加以改进。采用激光粒度分析仪对乳液的粒径进行测定。测定前用去离子水对样品进行稀释处理,以免多重光散射现象发生。同时为消除气泡对测试过程的干扰,样品测试前需先对分散介质超声4 min。测试前仪器平衡时间设置为120 s,选择水作为分散剂,分散剂折射率设置为1.331,每个样品平行测定3 次。
1.3.6 Zeta-电位的测定 Zeta-电位(mV)可以用来评估乳液所带表面电荷性质。参考Liang 等[26]的方法,略改。取磷酸盐缓冲液稀释30 倍后新鲜乳液,装入10 mL 样品管中,利用Zeta-电位仪对其电势值进行测定,测试温度为25 ℃,每组试验测定3 次。
1.3.7 多重光散射测定乳液整体稳定性 Turbiscan 多重光散射分析仪能够在不破坏、无接触样品的情况下对乳液样品进行扫描,后续可以对随时间变化扫描采集的透射光(transmission,TM)以及背散射光(backscattering,BS)分析得到样品稳定性相关信息,此外还可以对样品上浮、絮凝等不稳定现象进行分析[27]。由于本试验所制备的乳液透光性较差,因此选取背散射光(BS)指标对乳液稳定性进行分析。取30 mL 乳液样品置于多重光专用测试瓶中,对其进行扫描测试,扫描间隔设置为30 min,总工持续扫描24 h。对于储藏期间的样品扫描选取某一特定时间点对其稳定性变化情况进行分析,通过TM 和BS 进一步分析计算其稳定性动力学指数(turbiscan stability index,TSI),曲线斜率越低、TSI 值越低,乳液越稳定。其计算依据为: 不同时间同一高度处扫描测定的对比光强变化值累加到样品总高度的结果。计算公式为:

式中:xi——背射光强的平均值,次;xBS——xi的平均值;n——扫描次数。
1.3.8 数据分析 试验测定中每个样品均平行测定3 次,并采用origin 9.0、SPSS 19.0 软件对试验结果进行分析处理,以P<0.05 为显著性的检验标准。
2 结果与分析
2.1 SPI 质量分数对溶液苦味的影响
由图1可知,当固定STE 质量分数为0.5%,SSP 质量分数为0.3%时,SPI 质量分数在0.1%~1.0%范围内感官综合评分呈增加趋势,继续增加SPI 质量分数感官综合评分反而下降。水溶液状态下,SPI 质量分数低于1.0%时溶液苦味较为明显,难以接受;当SPI 质量分数增大至2.0%时,溶液苦味反而更明显且有颗粒感,可能是因其在溶液中的溶解程度受到一定的限制,使其感官评分降低。乳液状态下,SPI 质量分数较低(0.1%~0.5%)时,新鲜乳液的苦味明显弱于水溶液,但此时乳液稳定性较差,分层现象明显,使得感官评分较低;SPI 质量分数达到1.0%时乳液无明显苦味,且口感细腻,稳定性较好;SPI 质量分数高达2.0%时乳液苦味略有回升,这可能是由于蛋白水解产物中呈现苦味的游离氨基酸或苦味肽含量增加导致的[28-29]。

图1 SPI 质量分数对溶液苦味的影响Fig.1 Effect of SPI massfraction on bitterness of solution
2.2 SSP 质量分数对溶液苦味的影响
由图2可知,当固定STE 质量分数为0.5%,SPI 质量分数为1.0%时,其在0.1%~0.3%质量分数范围内感官综合评分呈增加趋势,在0.3%~1.0%质量分数范围内感官综合评分反而逐渐下滑。水溶液状态下,低质量分数(0.1%~0.3%)SSP对体系的抑苦效果起到促进作用,SSP 质量分数达到0.3%时,溶液的苦味降至最低,此时感官综合评分最高;继续增大其质量分数在0.5%~1.0%范围时,除溶液苦味被感知外,酸味也随SSP 质量分数的增加而不断增强。乳液状态下,SSP 质量分数较低(0.1%~0.3%)时,不仅可以掩盖STE 的苦味同时对乳液稳定性没有较大影响;当SSP 质量分数高于0.3%时,乳液稳定性随SSP 质量分数的增加而降低且酸味逐渐增大。这可能是由于SSP属于酸性多糖,质量分数增大使其酸性主链增多导致的[30-31]。

图2 SSP 质量分数对溶液苦味的影响Fig.2 Effect of SSP massfraction on bitterness of solution
2.3 STE 质量分数对溶液苦味的影响
由图3可知,当固定SPI 质量分数为1.0%,SSP 质量分数为0.3%时,两种溶液中不断增加STE 使得溶液整体感官评分逐渐降低。水溶液状态下,STE 添加微量(0.02%)时,溶液有略微甜味且无苦味;当STE 质量分数较低 (0.1%~0.25%)时,溶液甜味消失但并无苦味;STE 质量分数达到0.5%时,溶液苦味被感知但仍在可接受范围内;继续增加至1.0%时,溶液苦味很重令人难以接受。乳液状态下,STE 质量分数较低(0.02%~0.5%)时,乳液稳定性良好且甜味、苦味皆不被感知;但当STE 质量分数增加至1.0%时,乳液稳定性降低且苦味较明显。

图3 STE 质量分数对溶液苦味的影响Fig.3 Effect of STE massfraction on bitterness of solution
2.4 复合体系在油-水界面的吸附行为
上述感官试验证实,SPI-SSP 复合体系的水溶液及乳液两种溶液对STE 的苦味均有抑制效果,且乳液抑苦效果明显优于水溶液。目前针对乳液体系研究最多的便是稳定性问题,且SPI-SSPSTE 乳液的稳定性与STE 抑苦效果密切相关,因此对复合体系稳定性的探究必不可少。
探究发现,小分子表面活性剂与蛋白质之间通过相互作用共同形成稳定的乳液体系,界面张力(γ)值和乳液稳定性关联密切,可以作为分析乳液稳定性的重要参数。SPI-SSP-STE 复合体系在油-水界面的γ 值随时间变化的情况如下图 (图4)所示。图4a 图可以看出随时间的推移,SPI、SSP及STE 不断吸附到界面层,界面张力值不断减小。因为蛋白分子质量较大,完全吸附到油水界面层达到平衡状态所需消耗时间周期较长[32],所以在该试验中(直到180 min)所有复合体系曲线均未达到吸附平衡状态。由图可以看出随着SPI 质量分数的不断增大,复合乳液体系的界面张力下降速率明显加快(图4a)。180 min 后,纯STE 水溶液界面张力值处于10.82 mN/m,当SPI 添加量达到最大值2.0%时,界面张力值降低为3.55 mN/m(图4b),表明此时3 种表面活性物质间形成较为稳定的界面吸附层。

图4 SPI-SSP-STE 复合体系在油-水界面的界面张力(γ)随吸附时间的变化(a);吸附180 min 后的界面张力值随SPI 质量分数的变化(b)Fig.4 Dynamic interfacial tension (γ) for mixed solutions of SPI-SSP-STE emulsions at the oil-water interface (a);The γ values recorded after 180 min of adsorption (b)
2.5 乳液液滴尺寸分布及Zeta-电位
判定乳液形成能力(乳化性)的一大重要指标便是乳液液滴的尺寸分布情况。乳液的粒径结果如图5a 所示均呈现单峰形式,当乳液体系中SPI质量分数最小为0.1%时,乳液液滴处于最大尺寸682.38 nm。随着SPI 质量分数的不断增加,乳液粒径分布峰逐渐左移,说明乳液液滴尺寸不断减小,表明整个乳液体系的乳化性不断增强。当SPI 质量分数增加到1.0%时,乳液液滴尺寸出现明显降低,此时粒径达到最小值266.09 nm,表明此时乳液的乳化性最好,形成的乳液状态最稳定。推测可能是由于SPI-SSP-STE 复合体系使界面张力值降低的原因。
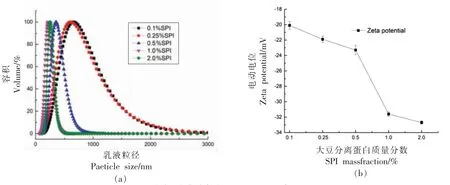
图5 新鲜乳液的粒径(a)及Zeta-电位图(b)Fig.5 Particle size distributions (a) and Zeta potential (b) of SPI-SSP-STE emulsions
Zeta-电位是反映油滴间吸引力与排斥力关系的重要指标,当Zeta-电位绝对值越大时,则表明油滴间吸引力越小,乳液状态越稳定[32]。电位绝对值降低则表明油滴间吸引力增大而不断聚集,这将导致乳液失稳[33]。由图5b 可以观察到乳液体系中添加不同质量分数的SPI 时,乳液液滴测得的Zeta-电位均为负值,且随SPI 质量分数的增加(0.1%~2.0%),Zeta-电位绝对值明显增大。Bhattacharjee[33]报告中曾经提到,乳液维持在稳定状态时,测定其Zeta-电位绝对值在30 mV 以上。当SPI 质量分数大于1.0%时,此时复合乳液的Zeta-电位绝对值大于30 mV(31.6 mV),证明SPI 质量分数大于1.0%时得到的乳液稳定。
2.6 乳液的整体稳定性
为了更清晰的阐述复合乳液稳定性与SPISSP-STE 三者之间相互作用的关系,对不同SPI含量的复合乳液采用多重光散射扫描其在短期(24 h)及长期(30 d)内TSI 值的变化情况。TSI 值越小、TSI 曲线斜率越小,表明乳液越稳定。在颗粒相对分散的稀乳液中,乳液会通过液滴絮凝增加系统中颗粒的大小来促进乳化[34]。由于本研究的乳液相对较稀(10%玉米油),推测TSI 值的增加应与乳液液滴的絮凝有关。
图6a 显示了SPI-SSP-STE 复合体系稳定的乳液样品24 h 内TSI 值的变化情况。当SPI 质量分数升高时,乳液的TSI 值呈现出明显的下降趋势,这表明复合乳液的稳定性在不断的增强。只添加0.1%SPI 复合乳液的TSI 在24 h 迅速增加到23.26,远高于其它SPI 添加量的复合体系稳定的乳液。随着SPI 质量分数的增加(2.0%),TSI 值在24 h 后明显降低至1.21,这表明添加较多的SPI可以使复合乳液的短期稳定性得以较大程度的增强。
图6b 展示的是采用多重光散射仪对SPISSP-STE 复合乳液样品进行长达30 d 的稳定性监测,其结果以TSI 值表示。添加较低质量分数0.1%,0.25%SPI 复合乳液的TSI 值30 d 后分别增加到66.79 和32.45,明显高于1.0%(3.99)和2.0%(2.51)的乳液TSI 值。这些结果表明,低质量分数SPI 的乳液液滴在储藏过程中发生了絮凝现象,或许是液滴的吸附层相对不稳定所致。当SPI 质量分数大于1.0%时,SPI-SSP-STE 整个复合乳液体系之间的疏水作用或其它弱相互作用导致形成更稳定的界面层,从而抑制了液滴的絮凝,保证乳液维持在相对稳定的状态下。

图6 SPI 质量分数对SPI-SSP-STE 复合乳液整体稳定性指数TSI 的影响(24 h/30 d)Fig.6 Influence of SPI concentration on global stability stability of SPI-SSP-STE emulsions in 24 h and 30 d
2.7 乳液的长期粒径
如图7所示,对复合乳液体系进行为期30 d粒径的测定以及第30 天乳液外观以评价复合乳液稳定性,发现随储藏时间的不断延长,添加少量SPI(0.1%)乳液粒径在30 d 时从0.68 μm 增加至2.71 μm(图7a),同时出现肉眼可观的相分离现象(图7b)。这可能是由于蛋白质量分数较低无法与SSP-STE 形成稳定的界面,使长期保存后油滴不断发生聚集所致,此时复合乳液体系的稳定性较差。在添加低质量分数SPI(0.25%~0.5%)时,相较0.1% SPI 添加量的复合乳液来说,此时乳液粒径30 d 后涨幅略有降低,但仍出现了肉眼可观的相分离现象。在添加1.0% SPI 时,复合乳液的粒径增加趋势最为缓慢,由0.26 μm 增加至0.72 μm(图7a),且没有出现肉眼可见的分层状况,表明此时复合乳液体系相对稳定,这主要归因于油滴覆盖着SPI-SSP-STE 形成的稳定吸附层。当SPI 质量分数继续增加至2.0%时,30 d 后复合乳液粒径增加趋势反而大于1.0%,结合多重光散射扫描推断可能是由于蛋白含量过高在乳液内部发生聚集,在储藏过程中缓慢下沉所致。蛋白质稳定的乳液(如SPI 质量分数为0.5%的乳液)可能会由于在乳化过程中蛋白质不足以使液滴表面完全饱和并发生“桥状絮凝”[35]。单纯的表面活性物质(例如SSP、STE 等)难以形成稳定的界面层,只有添加蛋白分子使其相互作用形成结合物才可有效防止“桥状絮凝”现象的发生[36-37]。

图7 SPI-SSP-STE 复合乳液体系在30 d 储藏期间的粒径(a)和图像(b)的变化Fig.7 Changes in mean particle diameter (a) and images (b) of SPI-SSP-STE emulsions during storage for 30 d
综上所述,对乳液粒径、Zeta-电位、稳定性等指标进行表征后,分析得知随SPI 质量分数的增大,乳液粒径减小,Zeta-电位绝对值增大,整体稳定性呈现上升趋势,且当SPI 质量分数增加到1.0%以上时乳液稳定性良好。
3 结论
本文以SPI、SSP、STE 质量分数为因素,感官综合评分为指标,对SPI-SSP 复合体系对STE 抑苦效果进行探究,得知水溶液及乳液两种溶液状态下对STE 苦味均有一定程度的抑制效果,两种溶液的感官综合评分随SPI、SSP 质量分数的增大均呈现出先增大后减小的趋势,当SPI 质量分数为1.0%、SSP 质量分数为0.3%时,对STE 的抑苦质量分数可达0.5%,且乳液的抑苦效果优于水溶液,相较于纯STE 水溶液0.1%时无法接受的苦味程度有很大改善效果。后续对抑苦效果较优的乳液体系的界面张力、粒径大小、Zeta-电位及稳定性等指标进行测定,得知随SPI 质量分数的不断增大,界面张力值呈现较大幅度的下降趋势,说明三者在油水界面相互结合形成较为稳定的界面膜;当复合乳液中STE 质量分数为0.5%、SSP 质量分数为0.3%时,SPI 质量分数大于1.0%时能够形成较为稳定、无不良苦味的乳液。
