裂殖酵母SpHMT1基因对拟南芥镉耐受性的影响
2022-10-21李美霖
黄 婧, 周 浩,2,3, 李美霖,2, 付 强
(1. 广西大学亚热带农业生物资源保护与利用国家重点实验室, 南宁530004; 2. 广西大学生命科学与技术学院, 南宁530004; 3. 广西民族大学海洋与生物技术学院, 南宁530008)
镉(cadmium,Cd)是一种有毒的重金属元素,低剂量(0.1~1.0 mg/kg)Cd2+处理即可抑制动植物的生长繁殖[1]。植物进化出一套调控离子平衡的机制以减小Cd2+的伤害[2-3]。首先,植物通过分泌苹果酸、柠檬酸等物质,与土壤中的Cd2+离子结合从而阻断吸收[4]。其次,植物细胞壁和胼胝质能固定Cd2+,避免其进入细胞质[3]。当Cd2+含量超过上述生理屏障的物理吸附限度,植物通过主动代谢产生螯合肽PCs参与Cd2+的解毒和区室化过程[2]。植物和酵母等真核生物的主要抗镉机制是将镉螯合并区室化到液泡中[5-6]。
SpHMT1基因首先在裂殖酵母中被发现[7-8]。ABC家族(ATP-binding cassette family)转运蛋白SpHMT1能将细胞质中PCs-Cd复合物转运入液泡,并形成更稳定的高分子量复合物(high molecular weight complexes)[9]。已证实在酿酒酵母(Saccharomycescerevisiae)中过表达SpHMT1能增强其对Cd2+的耐性[10]。尽管SpHMT1基因早被发现,但迄今为止在植物中仍未鉴定到其同源蛋白。近年来,很多ABC家族的转运蛋白被证实能转运Cd或者PCs-Cd复合物,如拟南芥MRP/ABCC亚家族蛋白AtABCC1/2和AtABCC3[11-12],水稻AtABCG36[13]和AtABCC9[14]等,但它们与SpHMT1同源性不高。
镉是生物毒性最强的重金属之一,是已知最易在人体内蓄积的IA级致癌物。镉通过植物吸收进入食物链最终危害人类健康。研究通过在拟南芥中过表达SpHMT1基因,探索其在模式植物对镉的耐受性及积累中的作用,对改良植物的镉耐受性,以及通过基因工程手段降低植物地上可食用部分的镉含量均具有重要意义。
1 材料与方法
1.1 材料
拟南芥哥伦比亚生态型Col-0、裂殖酵母野生型菌株Sp223和Δhmt1突变体菌株LK100为本实验室保存;大肠杆菌(Escherichiacoli)克隆载体pGEM®-T Easy Vector购自Promega公司;KOD-plus TaqTM酶和限制性内切酶购自Toyobo公司;反转录试剂盒等购自Takara公司;引物合成和DNA测序均由上海生工完成。
1.2 方法
1.2.1 酵母RNA提取
培养酵母至OD600=0.5,于12 000 r/min离心收集细胞,悬于400 μL AE buffer中,加入1/10体积的10%SDS和等体积酸酚。65 ℃振荡5 min,液氮速冻后,12 000 r/min离心2 min。上清液转至新管中,加入1/2体积酚和1/2体积氯仿,室温放置5 min。12 000 r/min离心10 min,上清液加入1/10体积3 mol/L醋酸钠(pH 4~5)和2.5倍体积无水乙醇,-20 ℃放置1 h。13 000 r/min离心15 min,弃上清液。沉淀用70%乙醇清洗风干,溶于20 μL DEPC处理过的水中。
1.2.2 反转录和cDNA扩增
2~3 μg总RNA,加入Oligo(dT18)0.4 μg,补DEPC水至13 μL,75 ℃水浴5 min,冰上冷却。cDNA扩增体系:5×MMLV Buffer 5 μL;dNTPs(25 mmol/L) 5 μL; RNAse inhibitor(20~40 U)1 μL; MMLV-RT(200 U) 1 μL。扩增参数为42 ℃水浴60 min,95 ℃水浴5 min,冰浴2 min。将反转录得到的cDNA稀释2~5倍后作为待检测模板。PCR引物序列如表1所示。

1.2.3 表达载体构建
使用SpHMT1克隆引物,KOD-plus反应体系扩增得到包括5′-UTR在内的SpHMT1全长cDNA,同时设计引物扩增得到以高等植物保守Kozak序列替代酵母5′-UTR的全长cDNA,产物分别克隆至pGEM T®-easy载体并测序验证。利用BamH I和SpeI酶点,将SpHMT1和Kozak-SpHMT1cDNA片段分别克隆到植物表达载体pBI121中。
1.2.4 拟南芥转化
采用农杆菌浸花法转化拟南芥[15],获得的T1代转基因植物种子在添加50 μg/μL卡那霉素的1/2× MS平板上筛选阳性苗,后续试验使用目标基因单拷贝插入的T3代纯合转基因株系进行。
1.2.5 亚细胞定位
利用BglII和XhoI酶点,将SpHMT1cDNA连入植物瞬时表达载体pMON530,使EYFP在基因5′端融合表达。利用PEG介导法将载体转入拟南芥原生质体[16],并通过共聚焦显微镜(Carl Zeiss,LSM 510 Meta)观察荧光信号。
1.2.6 金属元素含量测定
10~20 mg烘干的植物材料,置于14 mL FalconTM管中,加入1 mL硝酸(MOS级),浸泡过夜。99 ℃煮30 min,样品冷却至室温,补充Milli-Q水至14 mL。采用电感耦合等离子质谱(ICP-MS,ELAN DRC-e,Perkin-Elmer)测定样品金属元素含量。
1.2.7 元素原位分析
拟南芥野生型Col-0和转基因植株在含10 μmol/L CdCl2的1/2× MS平板上垂直培养10 d后,用取样器取叶进行高压冷冻和冷冻替代[17],环氧树脂包埋冷冻组织,使用超薄切片机(Leica Ultracut UCT ultramicrotome)切成100 nm薄切片,并置于铜网上。在电镜(Philips,CM12)上采用EDX分析元素,委托复旦大学电镜室完成。
2 结果与分析
2.1 SpHMT1基因的克隆和载体构建
构建包含酵母本身5′-UTR(标记为HMT1)和以高等植物保守kozak序列替代酵母5′-UTR(标记为KHMT1)的两个载体,并分别转入缺失SpHMT1基因的酵母突变体LK100中。如图1所示,在CdCl2胁迫下,转化空载体的LK100(V/LK100)生长受到明显抑制,而转化SpHMT1的突变体(HMT1/LK100)在200 μmol/L CdCl2平板上仍能正常生长,转化Kozak-SpHMT1的突变体(KHMT1/LK100)生长性能较HMT1/LK100略差[图1(a)]。浓度梯度Cd2+胁迫下的酵母生长曲线试验结果类似[图1(b)],说明SpHMT1和Kozak-SpHMT1均能互补Δhmt1突变体的Cd2+敏感表型。
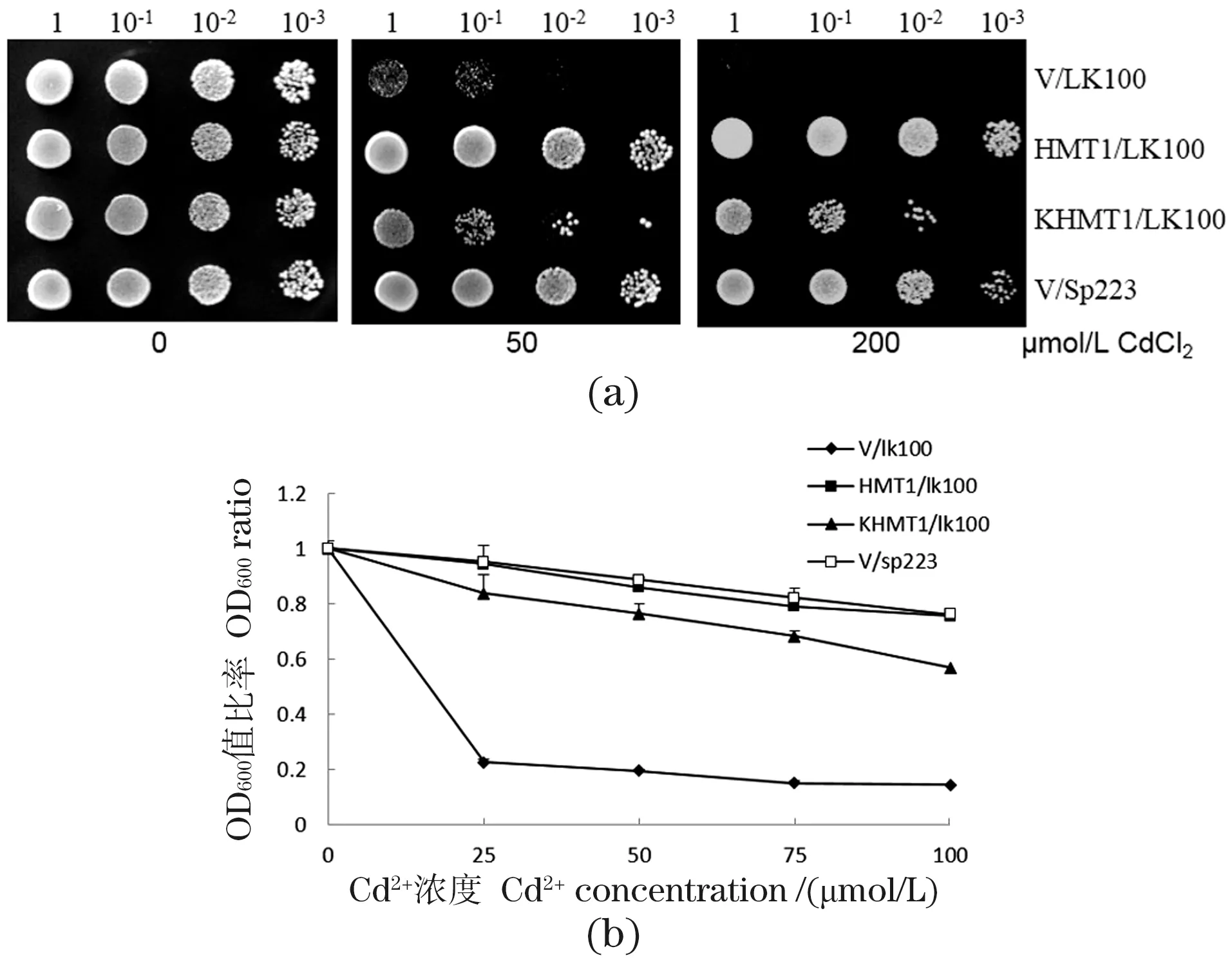
图1 SpHMT1基因互补酵母Δhmt1突变体对Cd2+敏感性Figure 1 SpHMT1 complemented the Cd2+ sensitivity of Δhmt1 mutant in yeast
2.2 SpHMT1基因在拟南芥中的过量表达
将包含Kozak序列的SpHMT1基因构建入植物表达载体pBI121并转化拟南芥野生型Col-0,筛选得到两个独立株系(W2-11和W7-3)。RT-PCR分析表明,SpHMT1基因在拟南芥中成功表达 [图2(a)],并且转基因植物与野生型Col-0的生长无显著差异[图2(b)]。

Col-0代表野生型拟南芥;W2-11和W7-3分别代表SpHMT1转化Col-0后获得的两个独立的T3代纯合株系。图2 SpHMT1转基因拟南芥的鉴定及表型分析Figure 2 Identification and phenotypic analysis of SpHMT1 transgenic Arabidopsis
2.3 SpHMT1在拟南芥中的亚细胞定位
如图3所示,EYFP对照转化拟南芥原生质体后,在整个细胞中都能观察到绿色荧光信号;而转化EYFP-SpHMT1-pMON530载体的原生质体,虽然绿色荧光信号稍弱,但是可以观察到清晰的液泡膜定位。结果表明,SpHMT1在拟南芥中的亚细胞定位与酵母类似,位于液泡膜上。

上:转化EYFP对照载体的拟南芥原生质体;下:转化EYFP-SpHMT1-pMON530载体的拟南芥原生质体。左:明场图像;中:绿色荧光图像;右:绿色与红色荧光融合图像。Bar=20 μm。图3 SpHMT1在拟南芥原生质体中的亚细胞定位Figure 3 Subcellular localization of SpHMT1 in Arabidopsis protoplast
2.4 SpHMT1基因增强拟南芥对Cd2+等重金属的耐性和积累
将转基因拟南芥T3代种子垂直培养于添加不同重金属的1/4×MS平板上,分析其对Cd2+等重金属离子的耐性。结果表明,在50 μmol/L CdCl2[图4(a)]、150 μmol/L KH2AsO4[图4(b)]、40 μmol/L CuSO4[图4(c)]和150 μmol/L ZnSO4[图4(d)]的金属离子环境下,转基因植株的鲜重[图4(e)]和主根长度[图4(f)]均显著高于野生型对照。ICP-MS分析表明,转基因株系中相应的重金属含量也显著高于对照[图4(g)]。结果说明,SpHMT1基因的过表达能增强拟南芥对Cd2+、Cu2+、Zn2+和As等重金属的耐性和积累。
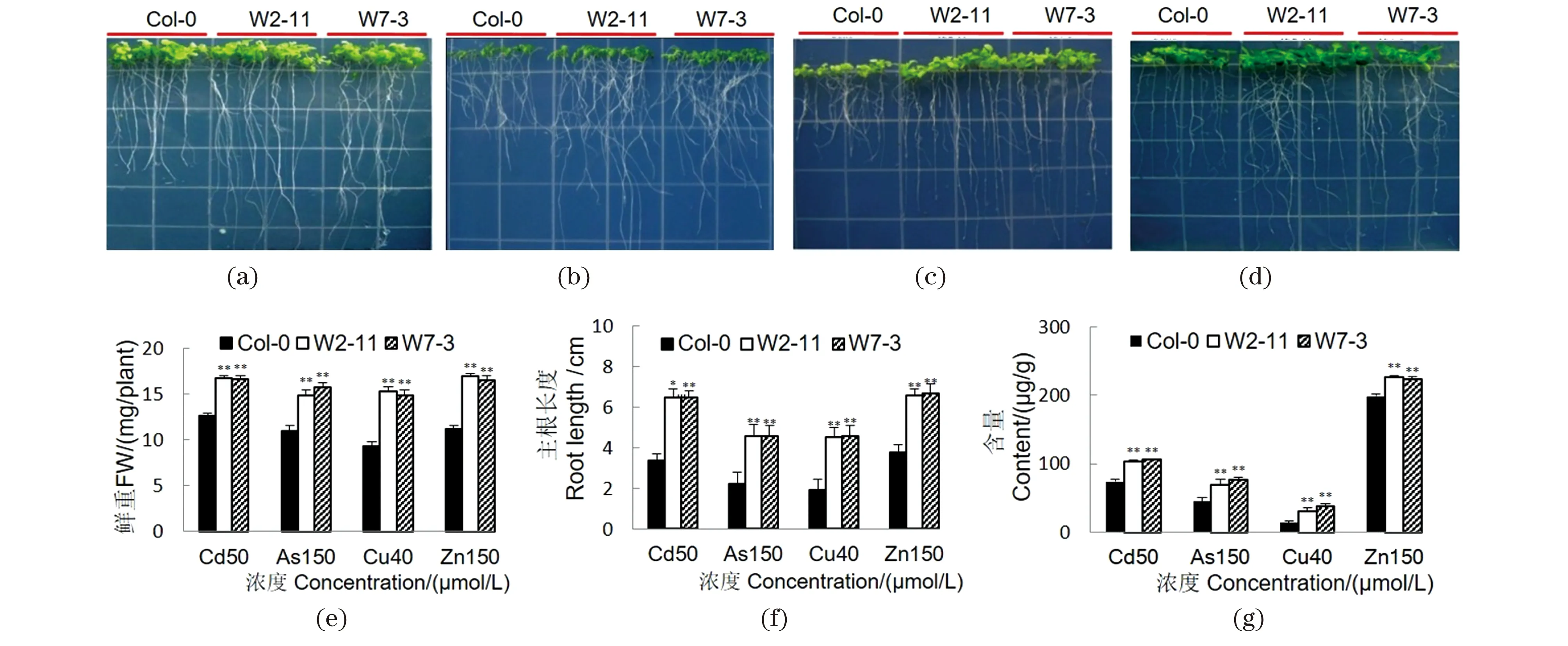
(a)~(d)分别为SpHMT1转基因拟南芥和野生型在添加50 μmol/L CdCl2(a)、150 μmol/L KH2AsO4(b)、40 μmol/L CuSO4(c)和150 μmol/L ZnSO4(d)时的1/4×MS平板上生长4周的表型;(e)拟南芥植株的鲜重测定;(f)拟南芥植株的主根长度测定;(g)拟南芥植株中的重金属含量测定。采用Student's t test进行差异显著性分析。** 表示P<0.01。图4 SpHMT1基因增强拟南芥对Cd2+等重金属的耐性和积累Figure 4 Enhanced metal tolerance and accumulation in SpHMT1 transgenic plants
2.5 BSO抑制SpHMT1转基因拟南芥对Cd2+的耐性和积累
PCs-Cd被认为是HMT1的底物[10]。BSO能抑制GSH的合成,从而也能抑制以GSH为底物的PCs的合成[18]。为进一步研究SpHMT1在拟南芥中的作用是否与转运PCs-Cd有关,用BSO对转基因拟南芥进行处理。如图5所示,在添加0.5 mmol/L BSO平板上垂直培养20 d后,转基因株系的表型、鲜重和根长均与野生型类似[图5(a)和(c)~(d)]。在同时添加10 μmol/L CdCl2和0.5 mmol/L BSO的1/4×MS平板上,转基因株系的表型和鲜重与对照类似,植株叶发黄、萎蔫,根生长也受到明显抑制[图5(b)~(d)]。转基因拟南芥中的Cd2+积累量与野生型无显著差异[图5(e)]。水培4周苗以10 μmol/L CdCl2和0.25 mmol/L BSO 处理3 d后,其根、茎和莲座叶中的Cd2+浓度均与对照无显著差异[图5(f)]。结果表明SpHMT1转基因植物对Cd2+的耐性和积累受到BSO的抑制,说明SpHMT1在拟南芥中的作用与PCs合成有关。

(a)(b)分别为SpHMT1转基因拟南芥及野生型在添加0.5 mmol/L BSO,以及添加10 μmol/L CdCl2和0.5 mmol/L BSO的1/4×MS平板上垂直生长4周的表型;(c)拟南芥植株的鲜重测定;(d)拟南芥植株的主根长度测定;(e)拟南芥植株的Cd2+含量测定;(f)水培4周拟南芥的Cd2+含量测定。采用Student’s t test进行差异显著性分析。图5 BSO抑制SpHMT1转基因植株对Cd2+的耐性和积累 Figure 5 BSO aborted the Cd2+ tolerance and accumulation of SpHMT1 transgenic plant
2.6 EDX检测元素分布
利用EDX对Cd等元素的亚细胞分布进行直接检测。如图6所示,在10 μmol/L CdCl2平板上生长10 d的转基因植株和野生型Col-0中未能观察到Cd的峰,可能是由于单片叶子中积累的Cd2+含量较低或实验技术不成熟导致Cd2+流失。但是在转基因植株中,硫(S)元素大部分在液泡中积累;而野生型拟南芥Col-0中S元素则主要积累于细胞质。这一结果从侧面说明在转基因植物中可能有更多的Cd2+被转运入液泡,并与S形成高分子量复合物储存其中,SpHMT1的液泡膜定位结果(图3)支持该推论。
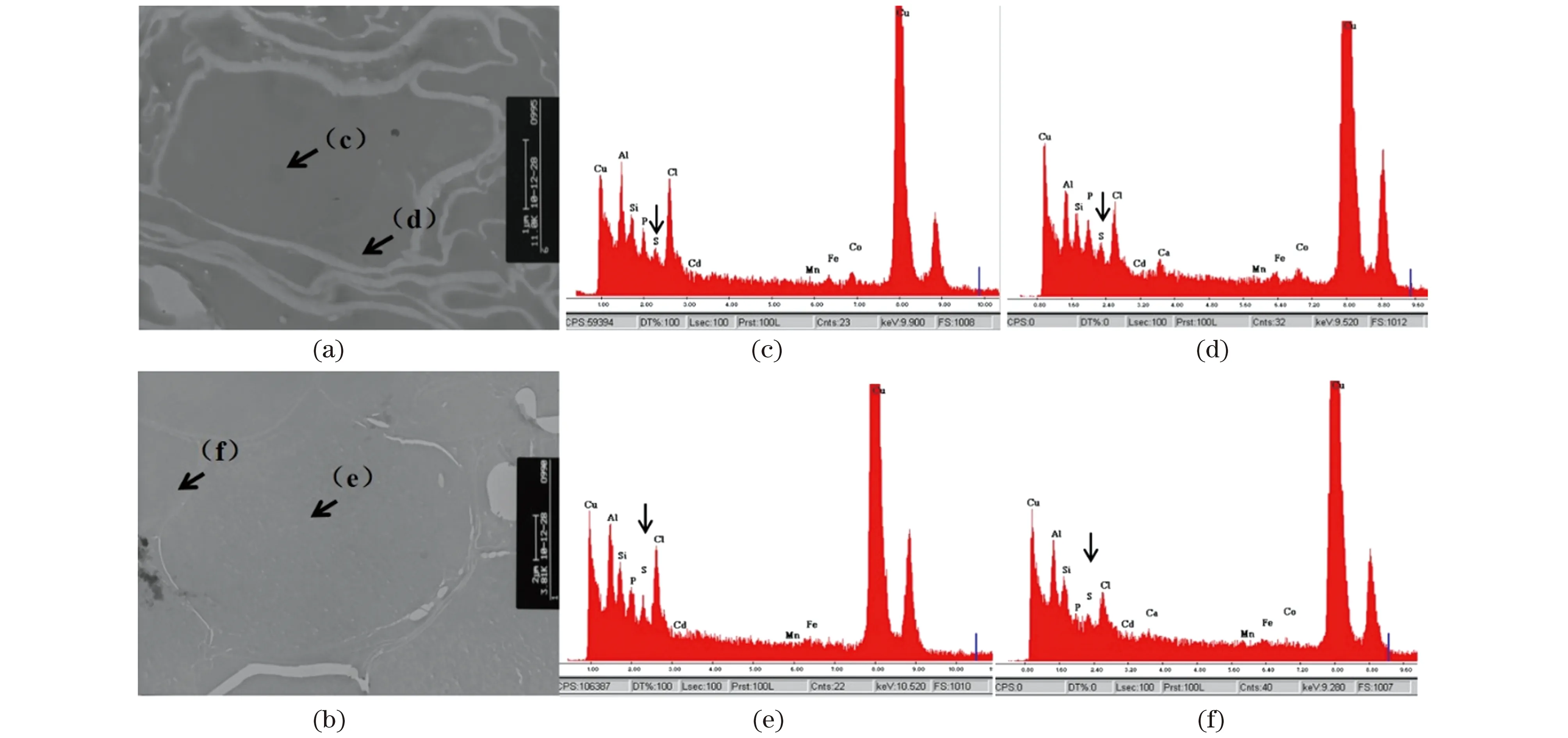
(a)(b)分别为野生型拟南芥Col-0和SpHMT1转基因植株检测细胞的透射电镜图(箭头所示为进行X射线能量色散谱的采样点);(c)(d)分别为野生型Col-0液泡和细胞质中的EDX元素分析光谱;(e)(f)分别为SpHMT1转基因植物液泡和细胞质中的EDX元素分析光谱。X射线能量色散谱中包括:Cu Lα(0.923 KeV)、Al Kα(1.487 KeV)、Si Kα(1.74 KeV)、P Kα(2.014 KeV)、S Kα(2.308 KeV)和Cd Lα(3.134 KeV)等。箭头所示为S的峰。图6 SpHMT1转基因拟南芥与野生型Col-0相比在液泡中积累更多的硫元素Figure 6 SpHMT1 transgenic plant accumulated more S in vacuoles than wild-type Col-0
2.7 SpHMT1基因延迟Cd2+的长途转运
为研究SpHMT1对Cd2+长途转运的影响,分析CdCl2时间梯度处理下Col-0及转基因植物根、茎和叶中的Cd2+含量。10 μmol/L CdCl2处理24 h后,转基因植物根中的Cd2+浓度显著高于对照,而地上部分含量则显著较低[图7(a)]。处理3 d后,除根部外,转基因植物叶中Cd2+的积累也显著高于对照,而茎中仍比野生型低[图7(b)]。处理7 d后,转基因植物茎中的Cd2+浓度也显著高于对照[图7(c)]。这些结果说明SpHMT1增加了整个转基因植物中的Cd2+含量,并且延迟了重金属Cd2+从根到茎的长途转运。
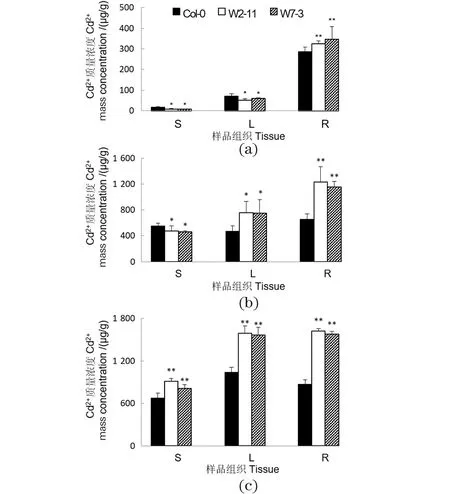
(a)~(c)分别为4周的水培拟南芥野生型Col-0及SpHMT1转基因植物(W2-11和W7-3),以10 μmol/L CdCl2分别处理1、3和7 d。分根(R)、茎(S)和莲座叶(L)取材并检测其中Cd2+含量。采用Student’s t test进行差异显著性分析。* 表示P<0.05,** 表示P<0.01。图7 SpHMT1延迟Cd2+从根到茎的长途转运Figure 7 SpHMT1 delayed the long-distance Cd2+ transport from roots to shoots
3 讨论与结论
现代工业的快速发展,镉等重金属污染日益严重,为限制重金属通过植物吸收进入食物链,研究植物对重金属镉等的解毒和积累机制具有非常重要的意义[3]。SpHMT1是首先在裂殖酵母中发现的能跨液泡膜转运PCs-Cd复合物的重金属耐受因子基因[7-8,19],将SpHMT1在大肠杆菌和酿酒酵母中过表达,能增强Cd2+的耐性[10]。线虫(CaenorhabditisElegans)[20]和果蝇(Drosophila)[21]等物种中也发现了SpHMT1同源基因;然而近30年在植物中仍未找到其类似功能的同源蛋白。从生物技术的角度看,植物中是否具有其同源蛋白并不重要,重要的是SpHMT1能否在植物中起作用。研究在拟南芥中过表达SpHMT1基因,能增强其对Cd2+等重金属的耐性和积累(图4)。SpHMT1在拟南芥中定位于液泡膜(图3),并且能显著增加野生型拟南芥液泡中S的积累(图6)。BSO能同时抑制SpHMT1介导的Cd2+耐性和积累(图5),暗示SpHMT1在拟南芥中介导Cd2+液泡区室化的功能依赖于PCs。
重金属污染对环境造成威胁,植物修复被认为是有望解决这一问题的重要方式,但在遭受大范围复合型重金属污染的地区中收效不大[22]。因此,控制镉等有毒重金属进入植物的可食用部位或许是更为可行的办法。在Cd2+长时间处理后,尽管SpHMT1转基因拟南芥地上和地下部分Cd2+的积累均增加,但是它延迟了Cd2+从根到茎的长途转运(图7),暗示根能作为储存重金属的“库”,将PCs-Cd2+复合物转运入根的液泡或能降低植物地上可食用部分Cd等有毒重金属的含量。因此,SpHMT1特异性的表达于水稻等作物的地下部分,对降低谷粒中有毒重金属的含量,保障食品安全将具有非常重要的应用价值。
研究在模式植物拟南芥中成功过表达裂殖酵母SpHMT1基因,发现其不仅能增强拟南芥对Cd2+等重金属的耐受性和积累,还能延迟Cd2+向地上部分的长途转运。SpHMT1等能跨液泡膜转运PCs-Cd复合物的重金属耐受因子基因的应用可作为潜在的解决粮食作物重金属安全问题的有效方法之一。
