抗MRSA植物药组方MZL-1的药效作用及分子机制
2022-10-20钟佳伶何佳萌茆灿泉
李 栋, 项 坤, 常 苗, 钟佳伶, 何佳萌, 茆灿泉
(1. 西南交通大学生命科学与工程学院, 成都610031; 2. 四川省医学科学院/四川省人民医院, 成都610072)
病原微生物耐药性是临床治疗面临的巨大挑战,多药耐药微生物(Multidrug resistant microbes,MDR)增加感染者的发病率和死亡率,并对包括ICU病房、接受手术、移植或癌症治疗在内各种人群的临床疗效产生不良影响[1]。全世界每年约有70万人死于MDR感染,如果不努力应对或开发新的抗生素,到2050年这一数字将达到1 000万人[2]。其中耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus,MRSA)具有很强的毒性和抗生素耐药性,可传播和感染动物和人类,造成巨大的经济负担[3],对人类健康造成了严重威胁[4]。因此,迫切需要开发替代药物或新抗生素来应对微生物感染的挑战,尤其是由耐药菌引起的感染。药用植物是创新药物研发的重要资源宝库,含有多种活性成分的各种药用植物及组方具有毒副作用相对较小、不易产生耐药性等多种优势[5]。研究以MRSA为主要研究对象,结合本实验室近5年开展的大量植物药抗菌筛选研究成果的积累,对科学设计的组方MZL-1(黄芩、冰片、大黄等多种植物合理配比)进行抗MRSA的药效作用及分子机制研究,旨在为抗MRSA等耐药病原菌以及微生物感染提供一种潜在有效的植物药组方制品。
1 材料与方法
1.1 实验仪器及材料
电导率仪DDSJ-318(上海雷磁);扫描电子显微镜Inspect(美国FEI);流式细胞仪BD Accuri C6 Plus(美国BD公司);96T碱性磷酸酶测定试剂盒(南京建成生物工程研究所);Annexin V-FITC / PI细胞凋亡检测试剂盒(南京诺唯赞生物科技股份有限公司);MZL-1试制品(黄芩、冰片、大黄等植物药材组方的75%醇提物)。金黄色葡萄球菌(Staphylococcusaureus)(ATCC 25923)为西南交通大学生命科学与工程学院微生物实验室保藏;耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus)临床株(No.230071)、绿脓杆菌(Pseudomonasaeruginosa)、白色念珠菌(Candidaalbicans)、大肠杆菌(Escherichiacoli)、藤黄微球菌(Micrococcusluteus)获自四川省人民医院和四川省医学科学院。植物药材购自成都市荷花池药材市场,并经生药学专家鉴定确认。
1.2 方法
1.2.1 MRSA抑菌率测定
取500 μL MZL-1药液加入10.0 μL MRSA菌悬液,处理至4个作用时间点(2、5、10、20 min)时,分别加入500 μL PBS,充分混匀,各取50.0 μL混合液平板涂布,37 ℃倒置培养12 h后进行菌落计数。以无菌生理盐水替代MZL-1作为对照组,实验重复3次。按照x=(a-b)/a×100%计算抑制率,其中,x为抑菌率,a为对照组菌落数,b为实验组菌落数。若抑菌率处于50%~90%,则产品有抑菌作用;若抑菌率≥90%,产品有较强的抑菌作用。
1.2.2 多种微生物的MIC测定
采用试管稀释法测定MZL-1对多种微生物的最小抑菌浓度(Minimal inhibit concentration,MIC),细菌和真菌分别使用LB和SDA培养基。用液体培养基按2.5%、5%、7.5%、10%、12.5%和15%的不同梯度稀释MZL-1至总体积5.0 mL,未加药组作为对照组。每组接入50.0 μL对数生长期的菌悬液,混匀,在37 ℃,200 r/min条件下培养6 h(真菌培养于30 ℃,180 r/min,12 h)。每管取出50.0 μL进行平板涂布,37 ℃培养12 h(真菌30 ℃培养48 h),菌落计数,实验重复3次。以出现单菌落数最少的最大含量为组方的MIC。
1.2.3 相对电导率及碱性磷酸酶活性测定
将对数生长期的MRSA菌悬液(1.0×107CFU/mL)以8 000 r/min离心5 min,然后用5%的葡萄糖洗涤菌体沉淀,直到其电能接近5%葡萄糖,作为等渗菌液。将1×MIC和2×MIC含量的MZL-1添加到5%的葡萄糖中,测量电导率记为L1。将1×MIC和2×MIC含量的MZL-1加入等渗菌液中,完全混合后,37 ℃孵育。在0、1、3、5、7、9 h时测量混合液电导率记为L2。在沸水中处理5%葡萄糖细菌混合液的电导率作为对照,记为L0。MZL-1的相对电导率表示为L=100%×(L2-L1)/L0。
对菌液碱性磷酸酶测定,将对数期生长的MRSA菌悬液(1.0×107CFU/mL)用1×MIC和2×MIC含量的MZL-1处理,无菌水作对照。将混合物分别在37 ℃下孵育,在0、1、2、3、5、7 h时取出,8 000 r/min离心5 min,使用碱性磷酸酶试剂盒测定上清液中的碱性磷酸酶含量。每组做3个平行试验。
1.2.4 SEM扫描电镜观察
将对数期生长的MRSA菌悬液在37 ℃、200 r/min条件下用 MZL-1(1/2×MIC, 1×MIC)处理6 h,未加药的菌液作为对照。离心收集沉淀,用PBS洗涤2次,用40 g/L的蔗糖溶液洗涤一次,时间均为5 min,用系列梯度酒精脱水,30%、50%、70%、80%、90%、95%、100%,每梯度10 min。加入100%酒精重悬后,吸取少量悬液滴加在玻片上,将玻片轻轻粘在导电胶上,临界点干燥,真空喷镀。最后,在扫描电子显微镜下观察细菌显微形态结构。
1.2.5 凋亡周期的流式细胞术测定
将对数期生长的MRSA细胞用PBS洗涤3次,将菌液的OD600调节至1.0。菌液稀释100倍后在37 ℃、200 r/min下用 MZL-1(1/2×MIC, 1×MIC)处理6 h,未加药的菌液作为对照。按照Annexin V-FITC / PI细胞凋亡检测试剂盒操作步骤进行染色。通过流式细胞仪对染色细胞进行分析,每个样本收集10 000个细胞。最后使用FlowJo V10.0.7分析结果。
1.2.6 网络药理学分析
(1)有效化学成分筛选。从中药系统药理数据库及分析平台(TCMSP,https:∥tcmspw.com/tcmsp.php)或文献中筛选黄芩、冰片、大黄等MZL-1主要药材的化学成分,筛选药物相似度(DL)≥0.18的候选化合物。
(2)潜在基因作用靶点的确定。从TCMSP数据库获得MZL-1中所有化合物的基因靶点,然后筛选出144种候选化合物所对应的基因靶点,即为MZL-1的潜在基因作用靶点。
(3)与微生物感染相关的差异基因筛选。从GEO数据库(https:∥www.ncbi.nlm.nih.gov/geo/)中搜索“Microbial infection”关键词,重点关注“Genome-wide”“bacterial”“fungal”和“infection”,寻找微生物感染患者的差异基因样本。筛选样本中P<0.05且|log2(fold change)| >0.5的基因被认为是和微生物感染显著差异表达相关基因。
(4)PPI网络构建与分析。将MZL-1的潜在基因作用靶点与微生物感染相关差异基因取交集得到的23个基因于STRING(https:∥www.string-db.org/, Version: 11.0)网站上进行蛋白互作分析,物种设为智人,蛋白质之间相互作用基于已有数据,互作得分设为最高置信度0.400,下载TSV文件导入Cytoscape软件构建蛋白质相互作用网络(Protein-Protein Interaction network,PPI)并进行拓扑结构分析。
(5)生物信息学分析。用Bioconductor中“DOSE”“clusterProfiler”和“enrichplot”3个安装包,并使用R语言编程,进行Gene Ontology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)富集分析,选择前20个富集的通路以气泡图来呈现。使用Cytoscape构建KEGG通路与基因调控网络。
2 结果与分析
2.1 MZL-1对MRSA及多种微生物的广谱抑菌作用
MRSA抑菌性能结果显示,MZL-1处理组2、5、10、20 min均未有菌落产生,而对照组则有生长正常的菌落,且在2 min时即完全抑制,5~20 min均表现出100%的抑菌效果[图1(a)]。MZL-1对金黄色葡萄球菌标准株的MIC为10.0%,对MRSA的MIC为7.5%,揭示MZL-1的抑菌作用不受细菌耐药性的影响,甚至对耐药株还有更强的抑制作用。另外,对白色念珠菌、铜绿假单胞菌、大肠杆菌和藤黄微球菌的MIC显示,组方MZL-1同样表现出强的抑制作用[图1(b)]。

(a)MZL-1对MRSA的抑菌性能;(b)不同菌株MIC值。图1 MZL-1对MRSA的抑菌性能和多种微生物的MIC测定Figure 1 The antimicrobial activities of MZL-1 against MRSA and the determination of MIC for various microorganisms
2.2 MZL-1处理对MRSA细胞完整性的影响
相较对照组,MZL-1处理组的相对电导率显著升高,并且呈现含量依赖性[图2(a)]。与相对电导率结果相似,加药组的碱性磷酸酶活性显著高于对照组,同样表现出加药初始就高表达的特点[图2(b)]。随着时间变化,碱性磷酸酶的活性也呈小幅变化,同时也表现出含量依赖性。
扫描电镜观察不同浓度MZL-1处理后的MRSA菌体,与空白组相比,加药组MRSA细胞数明显减少,细胞形态发生显著变化,部分细胞凹陷破裂,细胞大小不一,细胞表面不再光滑且彼此黏附,细胞间出现很多可能是细胞碎片的杂质,随着含量增高,黏附现象加剧[图2(c)]。
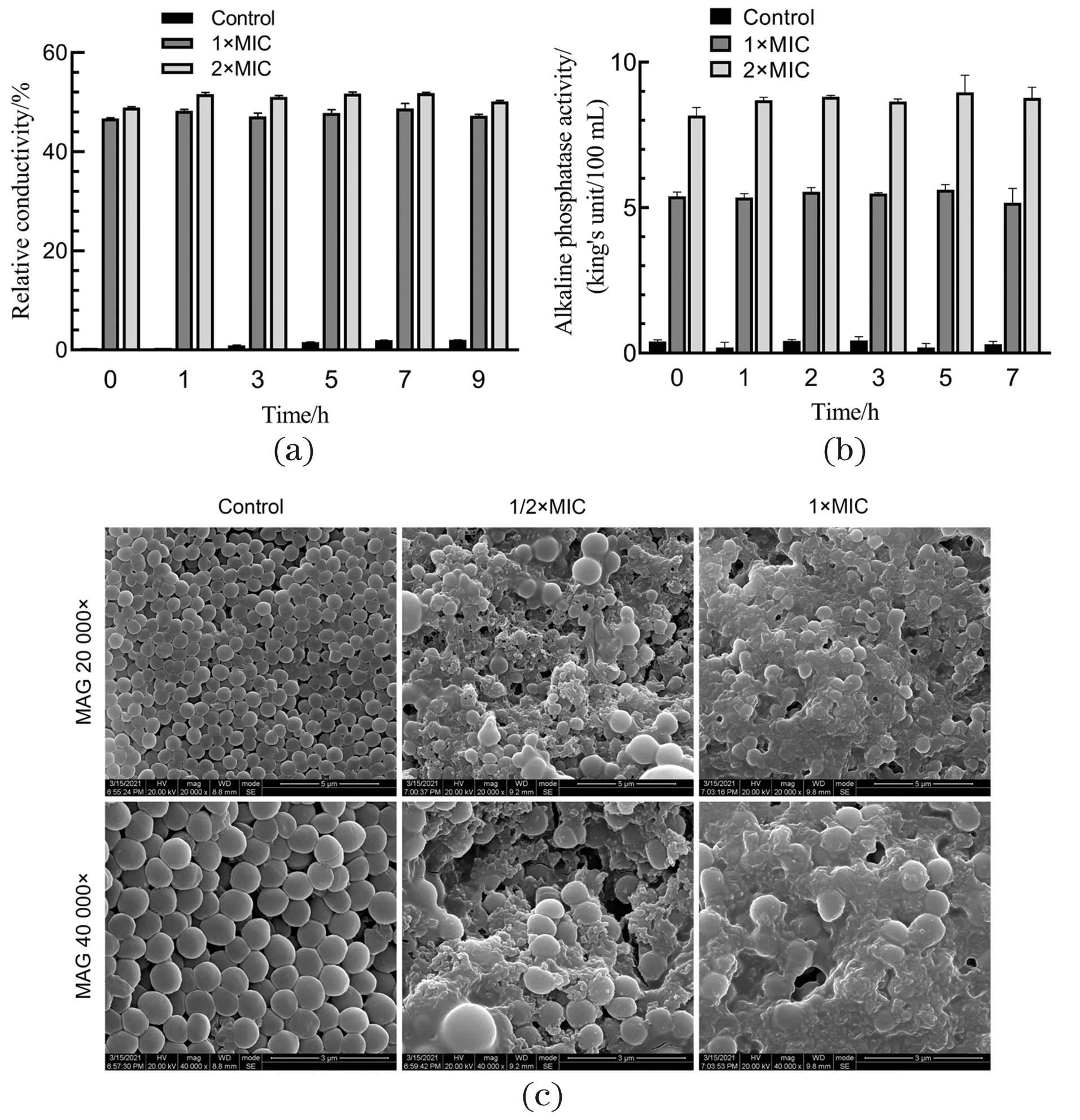
(a)相对电导率;(b)碱性磷酸酶活性;(c)扫描电镜观察细胞形态。图2 MZL-1对MRSA细胞完整性的影响Figure 2 The effects of MZL-1 on the integrity of MRSA cells
2.3 MZL-1对MRSA的促凋亡作用
细胞凋亡是一种生理性的程序性细胞死亡,受到基因的严格控制。图3所示,随着MZL-1处理含量的增加,MRSA活细胞率(Q4)从98%降到4.35%。相反,经MZL-1处理6 h后,凋亡的细胞比率(Q3+Q2)从1.94%增加到95.6%,特别注意的是,早期凋亡的细胞数呈现一个很大的占比,这也印证了相对电导率和碱性磷酸酶的结果,即在体外试验中MZL-1对MRSA的抑制作用是高效的。

Q4为活细胞;Q3为早期凋亡细胞;Q2为晚期凋亡细胞;Q1为坏死细胞。图3 不同含量MZL-1处理对MRSA细胞凋亡的影响Figure 3 The effects of different contents of MZL-1 on MRSA apoptosis
2.4 网络药理学分析
2.4.1 MZL-1中活性成分的筛选与抗微生物感染差异基因表达分析
从TCMSP数据库和文献中共获得146种符合条件的化合物。其中,黄芩72种,大黄63种,冰片5种,其他6种,去除冗余,共计144种。144种化合物对应916个潜在基因作用靶点,黄芩649个,大黄187个,冰片6个,其他74个。从GEO数据库找到GSE65088这一系列的微生物感染差异基因表达样本,分析正常样本和感染后样本共得到1 100个差异基因,选取前20个显著上调和前20个显著下调的基因绘制热图(图4)。其中C为正常样本,计21例;T为不同微生物感染样本,计36例,依次为6例烟曲霉菌、10例白色念珠菌、10例大肠杆菌、10例金黄色葡萄球菌。正常样本和感染样本的差异主要涉及HERC5、ISG15、CXCL10、CCL8、TNF、LOC730249、IRG1、IL6、RSAD2和IFI44L等基因。
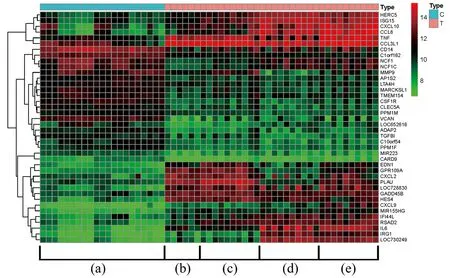
(a)21个正常样本;(b)烟曲霉菌;(c)白色念珠菌;(d)大肠杆菌;(e)金黄色葡萄球菌。红色表示上调,绿色表示下调;颜色越鲜明表示差异越显著。图4 微生物感染差异基因热图Figure 4 Heat map of differential genes in various microbial infections
将916个潜在基因作用靶点与微生物感染的差异基因取交集得到29个化合物和23个靶基因。根据相关性排序,芹菜素(MOL000008)、黄芩素(MOL002714)、汉黄芩素(MOL000173)、大黄素(MOL000472)这些化合物能结合的靶点都在5个及以上,推测上述化合物可能是MZL-1抗微生物感染的关键成分。RXRA、RELA、CDKN1A这3个基因所涉及的化合物超过5个,推测上述基因可能是MZL-1抗微生物感染的关键靶点(图5)。
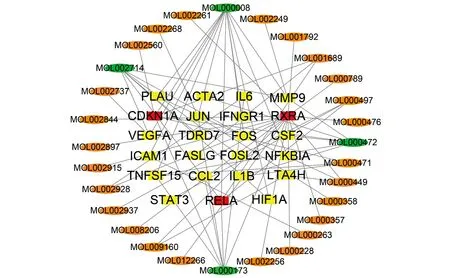
中间矩形代表靶基因;周围椭圆代表化合物。红色矩形代表核心靶基因;绿色椭圆代表核心化合物。图5 化合物与靶基因关系网络Figure 5 Compound and target gene relationship network
2.4.2 PPI网络分析
将PPI数据导入Cytoscape软件分析,共得到22个节点,119条边。以节点大小对应Degree值大小,边的粗细反映节点之间相互作用强度“Combinedscore”(图6)。其中IL6、FOS、JUN、MMP9、VEGFA、STAT3和RELA等靶点排名靠前,推测可能为MZL-1的重要作用靶点。
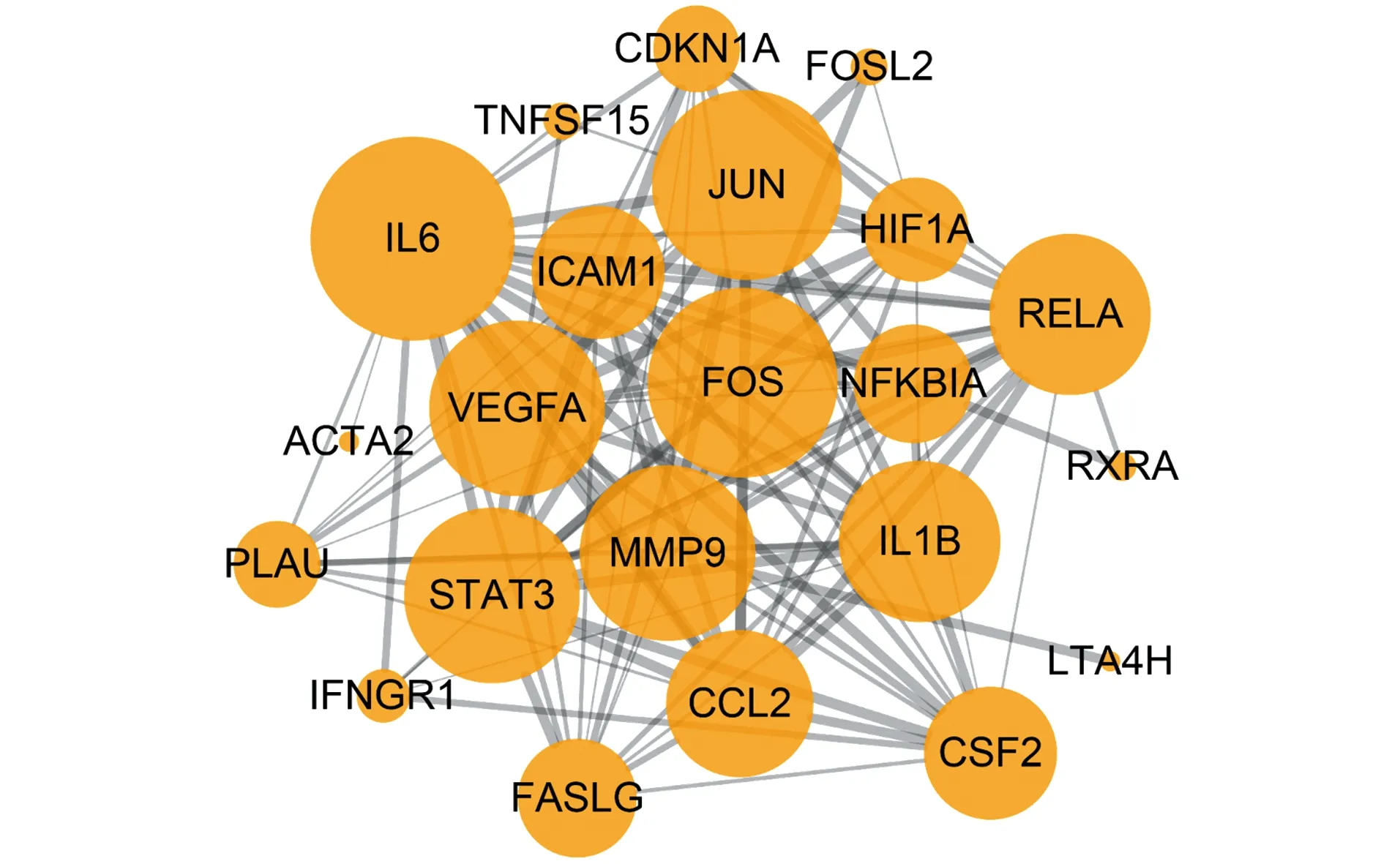
图6 MZL-1与候选靶点的PPI网络Figure 6 PPI network of MZL-1 and candidate targets
2.4.3 GO和KEGG富集分析
对23个靶基因进行包括生物过程(BP,biological process)、细胞成分(CC,cellular component)和分子功能(MF,molecular function)的GO分析。结果显示,共有873个GO功能被显著富集。其中生物过程中833个,分子功能中34个,细胞成分中6个。生物学过程主要与脂多糖反应、细菌起源分子的反应、DNA结合转录因子活性的调节等相关[图7(a)];分子功能主要集中在与细胞因子受体、细胞因子活性以及受体配体活性等有关方面[图7(b)];细胞组分主要涉及转录因子复合体、RNA聚合酶II转录因子复合物以及核转录因子复合体等[图7(c)]。
KEGG富集分析共有94条通路,前20条分别为卡波西氏肉瘤相关疱疹病毒感染、Th17细胞分化、TNF信号通路、IL-17信号通路、美国锥虫病、类风湿关节炎、糖尿病并发症中的AGE-RAGE信号通路、乙型肝炎、流体剪切应力与动脉粥样硬化、麻疹、癌症中PD-L1表达和PD-1检查点途径、人巨细胞病毒感染、甲型流感、HIF-1信号通路、炎性肠病(IBD)、耶尔森氏菌感染、松弛素信号通路、破骨细胞分化、利什曼病、人T细胞白血病病毒1感染[图7(d)]。可见很多通路与微生物感染、炎症有关。

(a)GO生物过程;(b)GO分子功能;(c)GO细胞组分;(d)KEGG富集分析。图7 GO和KEGG富集分析Figure 7 GO and KEGG enrichment analysis
2.4.4 KEGG网络分析
根据显著富集通路和调控这些通路的基因之间的相关性,构建基因通路网络(图8)。方格代表目标基因,V形图代表网络中的通路,图形面积越大代表相关性越强。从图 8可以看出,RELA是核心靶基因,FOS、JUN、NFKBIA、IL6、IL1B等基因也很重要,它们可能是MZL-1抗微生物感染的关键靶基因。

图8 KEGG基因通路网络Figure 8 KEGG gene pathway network
3 讨论与结论
为寻找抗微生物耐药的新方法,以MRSA为研究对象,在课题组前期植物药抗菌筛选研究的基础上,选取黄芩、冰片、大黄等多种植物药合理配比并组方为MZL-1。黄芩含有丰富的黄酮成分,具有广谱抑菌、抗炎能力[6],有研究表明,黄芩中的黄芩苷可以抑制金黄色葡萄球菌生物被膜的形成,协同药物更容易杀伤细菌[7];冰片用于治疗伤口愈合、治疗烧伤、喉咙痛和皮肤感染[8],还可通过抑制氧化损伤、细胞凋亡和炎症反应对全脑缺血再灌注损伤模型具有显著保护作用[9];大黄素是中药大黄的重要单体,能抑菌、抗炎、调节免疫、抗氧化、保护肝肾、利尿、治疗胰腺炎、抑制血小板聚集、改善微循环、降低血液黏度、抗肿瘤等,具有较好的临床应用价值[10-11]。抑菌性能评估结果表明:MZL-1对MRSA具有强的抑制作用,抑制效果甚至强于金黄色葡萄球菌标准株,这个结果非常有意义,揭示MZL-1组方具有不受抗生素耐药性影响的优势。深入研究发现,MZL-1对白念珠菌、大肠杆菌、铜绿假单胞菌、藤黄微球菌等多种微生物均有强抑制作用,这为MZL-1抗MRSA及广谱抗菌产品的研发带来了很大希望。
细菌细胞膜是离子和物质转运的重要渗透屏障[12],它被破坏会导致胞内电解质泄漏[13]。碱性磷酸酶存在于细胞壁和细胞膜内,当细胞壁被破坏时,碱性磷酸酶将从细胞中泄漏出来[14],菌液中电解质含量和碱性磷酸酶活性可以很好地表征细胞膜和细胞壁的完整程度。菌液相对电导率、碱性磷酸酶活性的结果证明MZL-1对MRSA菌体细胞膜与细胞壁的破坏和胞内内容物溢出,扫描电镜的结果又从形态学上证实了大量菌体的死亡和破裂,并且均表现出含量依赖性。流式细胞仪发现,经MZL-1处理后活细胞大量减少,凋亡细胞增加,且大多出现在早期凋亡阶段,这也进一步印证电导率、碱性磷酸酶以及扫描电镜的结果,即MZL-1对MRSA抑制作用快速且有效。
最后,结合网络药理学技术方法,对MZL-1的可能分子抗菌机制进行研究。芹菜素、汉黄芩素、黄芩素和大黄素能结合的微生物感染相关靶点较多,且它们均具有抗菌、抗炎和抗氧化的作用[15-16],可能是MZL-1的代表性化合物。将候选靶点进行PPI网络构建与分析,发现IL6、FOS、JUN、MMP9、VEGFA、STAT3、RELA等靶点排名靠前。芹菜素、黄芩素均可以抑制IL6的转录[17-18],汉黄芩素在骨关节炎治疗中可以抑制IL6、MMP9等多种基因的表达[19],MZL-1含有的多种黄酮类、蒽醌/蒽酮类、有机酸、萜类化合物很可能作用于上述靶点。GO富集分析显示靶基因主要参与细胞对小分子反应,细胞因子及转录因子等过程。KEGG富集分析发现所涉及的通路大多与炎症因子响应、细胞凋亡、细菌和病毒感染及免疫功能有关。KEGG网络分析最终确定RELA、FOS、JUN、NFKBIA、IL6、IL1B等关键基因。RELA基因属于NF-κB家族,NF-κB是一种转录因子,是一系列信号转导事件的终点,由许多生物过程(如炎症、免疫、分化、细胞生长、肿瘤发生和凋亡)相关的大量刺激启动[20-21]。FOS基因家族编码蛋白可与JUN家族编码蛋白形成二聚体AP-1,AP-1作为一种转录因子参与细胞凋亡、炎症响应等生物过程[22-23]。NFKBIA基因编码NF-Kappa-B抑制剂家族的一个成员,其所编码蛋白可以与REL产生二聚体从而调控炎症反应[24]。IL6和IL1B编码的细胞因子都是重要的炎症反应调节因子,并广泛参与到细胞增殖、分化和凋亡等各种细胞活动中[25-26]。MZL-1具有多成分多靶点的优势,可以调节和响应多个靶点和通路,这也可能是MZL-1对包括MRSA在内的多种微生物有较强抑制效果的原因。
MZL-1不受MRSA耐药性影响,可以破坏其细胞完整性而起到抑制作用,同时MZL-1对多种微生物均有很强的抑制效果,研究为目前微生物耐药性的解决提供了一条新的思路。本工作还存在很多不足,植物药材的质量控制以及抑菌和抗耐药机制还需要从基因、蛋白方面的实验进行深入研究。
