灵芝水溶性和碱溶性多糖的抗氧化性能比较研究
2022-10-15陈炼茹郑丹婷卜原玲姚泽远
韩 伟,陈炼茹,郑丹婷,卜原玲,姚泽远
(华东理工大学 药学院 a.制药工程与过程化学教育部工程研究中心;b.上海市新药设计重点实验室,上海 200237)
灵芝是一种具有很高营养和药用价值的食用真菌.大量研究表明,灵芝多糖(Ganodermalucidumpolysaccharide,GLP)作为灵芝的主要有效成分,显示了较强的抗氧化活性[1],可用于预防和治疗糖尿病、心脏病、癌症、视网膜损伤、白内障、帕金森氏病、阿尔兹海默氏病、免疫功能受损等疾病[2-4].其具有抗自由基的作用,可延缓衰老并应用于化妆品中[5].相关研究还发现,提取方法、多糖浓度、相对分子质量等因素均可能影响灵芝多糖的抗氧化活性[6-8].
入药的灵芝品种大多是赤芝,本文选取代表性的赤芝品种沪农灵芝、龙芝2号为研究材料,采用水提、碱提及乙醇分级沉淀的方法得到了不同相对分子质量的多糖组分.同时,利用普鲁士蓝法、羟自由基清除模型、DPPH自由基清除模型对各多糖进行抗氧化活性评价,为灵芝多糖的深入研究提供依据.
1 材料与方法
1.1 材料与设备
沪农灵芝子实体、龙芝2号子实体,上海市农业科学院食用菌所提供.
体积分数95%乙醇、无水乙醇,上海沃化化工有限公司;氢氧化钠、铁氰化钾、三氯化铁(FeCl3·6H2O)、硫酸亚铁(FeSO4·7H2O)、国药集团化学试剂有限公司;磷酸二氢钠(NaH2PO4·2H2O)、磷酸氢二钠(Na2HPO4·12H2O)、三氯乙酸、水杨酸、30%过氧化氢,上海凌峰化学试剂有限公司;DPPH(1,1-二苯基-2-苦基肼)、葡聚糖凝胶G-100,上海源叶生物科技有限公司;DEAE-纤维素52,上海笛柏生物科技有限公司.以上试剂均为分析纯.
SB-2000水浴锅、N-1001旋转蒸发仪,上海爱朗仪器有限公司;ER-692型微波炉,中国电子器件工业总公司;H1650-W离心机,湖南湘仪实验室仪器开发有限公司;SCIENTZ-12N冷冻干燥机,宁波新芝生物科技股份有限公司;UV1900PC紫外可见分光光度计,上海亚研电子科技有限公司;Waters 2695高效液相色谱仪、Waters 2414示差折光检测器,美国Waters公司;Wyatt HELEOS8激光光散射仪,美国Wyatt公司.
1.2 实验方法
1.2.1 灵芝水溶性多糖的制备
取灵芝子实体,加入体积分数95%乙醇脱脂3 h,抽滤,样品干燥至质量不变后加入去离子水进行多糖的微波辅助提取,控制微波功率325 W,料液比1∶35(g/mL),提取时间24 min.提取完成后抽滤,分别收集滤液和滤渣,滤液减压浓缩,随后加入4倍体积的95%乙醇,于4 ℃的冰箱中静置过夜.离心,沉淀用少量水溶解,真空冷冻干燥,得到灵芝水溶性多糖.
取灵芝水溶性多糖,复溶后加体积分数95%的乙醇至体积分数为30%,置于4 ℃的冰箱中沉淀过夜,离心5 min(10 000 r/min),沉淀冷冻干燥,得GLPa.离心后的上清液旋蒸除去乙醇,加体积分数95%的乙醇至体积分数为50%,置于4 ℃的冰箱中沉淀过夜,离心5 min(10 000 r/min),沉淀冷冻干燥,得GLPb.同法,乙醇体积分数为80%时得到GLPc.
1.2.2 灵芝碱溶性多糖的制备
取微波提取后的滤渣,干燥至质量不变后,料液比1∶35(g/mL)加入质量分数为5.4%的NaOH溶液,40 ℃热水浴浸提75 min.抽滤,滤液减压浓缩,调节pH至7左右,随后加入4倍体积95%乙醇,于4 ℃的冰箱中静置过夜.离心,沉淀用少量水溶解,真空冷冻干燥,得到灵芝碱溶性粗多糖,分别上DEAE-纤维素柱、Sephadex G-100层析柱,进一步分离后得到灵芝碱溶性多糖GLPj.
1.2.3 灵芝多糖的相对分子质量测定
采用高效凝胶尺寸排阻色谱-多角度激光散色仪-示差折光检测仪联用分析法[9-10](HPSEC-MALLS-RI System)进行灵芝多糖的相对分子质量测定.
灵芝多糖供试液的制备:称取5.0 mg灵芝多糖,用流动相配制成质量浓度5 mg/mL的灵芝多糖供试液,经0.45 μm滤膜过滤,待用.
色谱条件:Waters 2695高效液相色谱仪及Waters 2414示差折光检测器;OHpak系列SB-806 HQ和SB-804 HQ色谱柱(8.0 mm×300 mm,TOSOH);进样量100 μL;流动相,去离子水;流速0.500 mL/min;柱温35 ℃;激光散射仪波长663.1 nm;折光指数增量(dn/dc)0.146 mL/g.
数据采集分析:使用Astra(version 6.1.1,Wyatt Technology)数据分析软件对光散射数据进行采集和分析.样品的色谱峰数目和形状可以反映其纯度,在HPSEC图谱中的保留时间与多糖样品的相对分子质量具有函数关系[11].
1.2.4 灵芝多糖的抗氧化活性实验
多糖样品溶液配制:称取0.050 g多糖样品,溶于25 mL去离子水,得2 mg/mL多糖溶液.将2 mg/mL多糖溶液按3∶1加去离子水稀释,得到1.5 mg/mL多糖溶液.同理,制得1、0.5、0.25 mg/mL多糖样品溶液.
1)多糖总还原力
磷酸缓冲液(0.2 mol/L,pH 6.6)配制:称取3.12 g磷酸二氢钠,加去离子水定容到100 mL,为A液.称取7.16 g磷酸氢二钠,加去离子水定容到100 mL,为B液.量取A液62.5 mL,B液37.5 mL,混合.
取5个质量浓度的多糖样品液各1.0 mL分别置于试管中,每管加入2.5 mL磷酸缓冲液和1.5 mL质量分数1%铁氰化钾,混匀.将各试管转移至水浴锅中,50 ℃反应20 min.冷却至室温后,往各管中滴加2 mL质量分数10%三氯乙酸溶液.混合液转入离心管,于3 000 r/min离心10 min.分别取2.5 mL上清液置于新试管中,加入2.5 mL去离子水和0.5 mL质量分数0.1%三氯化铁溶液,摇匀,室温下静置10 min,在700 nm处测量吸光度.设3个平行试验,取均值.
2)羟基自由基清除能力
取5个质量浓度的多糖样品液各1.0 mL分别置于试管中,每管中加入4 mmol/L硫酸亚铁溶液、4 mmol/L H2O2溶液、4 mmol/L水杨酸无水乙醇溶液各1.0 mL,混匀,37 ℃避光反应30 min.反应完成后,转入离心管,于8 000 r/min离心5 min.分别吸取上清液,测量并记录510 nm处的吸光度值(Ai).按以上步骤,将水杨酸无水乙醇溶液换成同等体积的无水乙醇进行相同的实验,将测得的吸光值记为Aj.用去离子水替换多糖溶液,测得的吸光值记为A0.设3个平行试验,取均值.
羟自由基清除率=[(A0-Ai+Aj)/A0]×100%.
(1)
3)DPPH自由基清除活性
取5个质量浓度的多糖样品液各2.0 mL分别置于试管中,每管中加入2.0 mL的 0.2 mmol/L DPPH无水乙醇溶液,混匀.将各试管转移至黑暗环境,反应30 min.随后测量517 nm处的吸光值(Ai).按以上步骤,将 DPPH无水乙醇溶液换成同等体积的无水乙醇进行相同的实验,记录吸光值(Aj).用去离子水替换多糖溶液,记录相应的吸光值(A0).设3个平行试验,取均值.
DPPH自由基清除率=[(A0-Ai+Aj)/A0]×100%.
(2)
2 结果与分析
2.1 灵芝多糖的纯度
实验所得灵芝的水溶性多糖为浅黄色粉末,碱溶性多糖为黄棕色粉末,均可溶于水,不溶于乙醇,能产生苯酚-硫酸显色反应.
2.1.1 多糖的高效液相色谱图
各多糖组分经高效液相色谱检测,示差检测器(RI)信号峰为单一强峰,临近结束时出现一个弱峰,证明多糖纯度较高.图1显示,经不同方法提取、不同体积分数乙醇沉淀得到的灵芝多糖的出峰位置和峰面积均存在差异,表明水溶性多糖GLPa和GLPb、GLPc和碱溶性多糖GLPj含有不同种类的组分,且含量各不相同,从GLPa到GLPb、GLPc、GLPj含量逐渐减小.
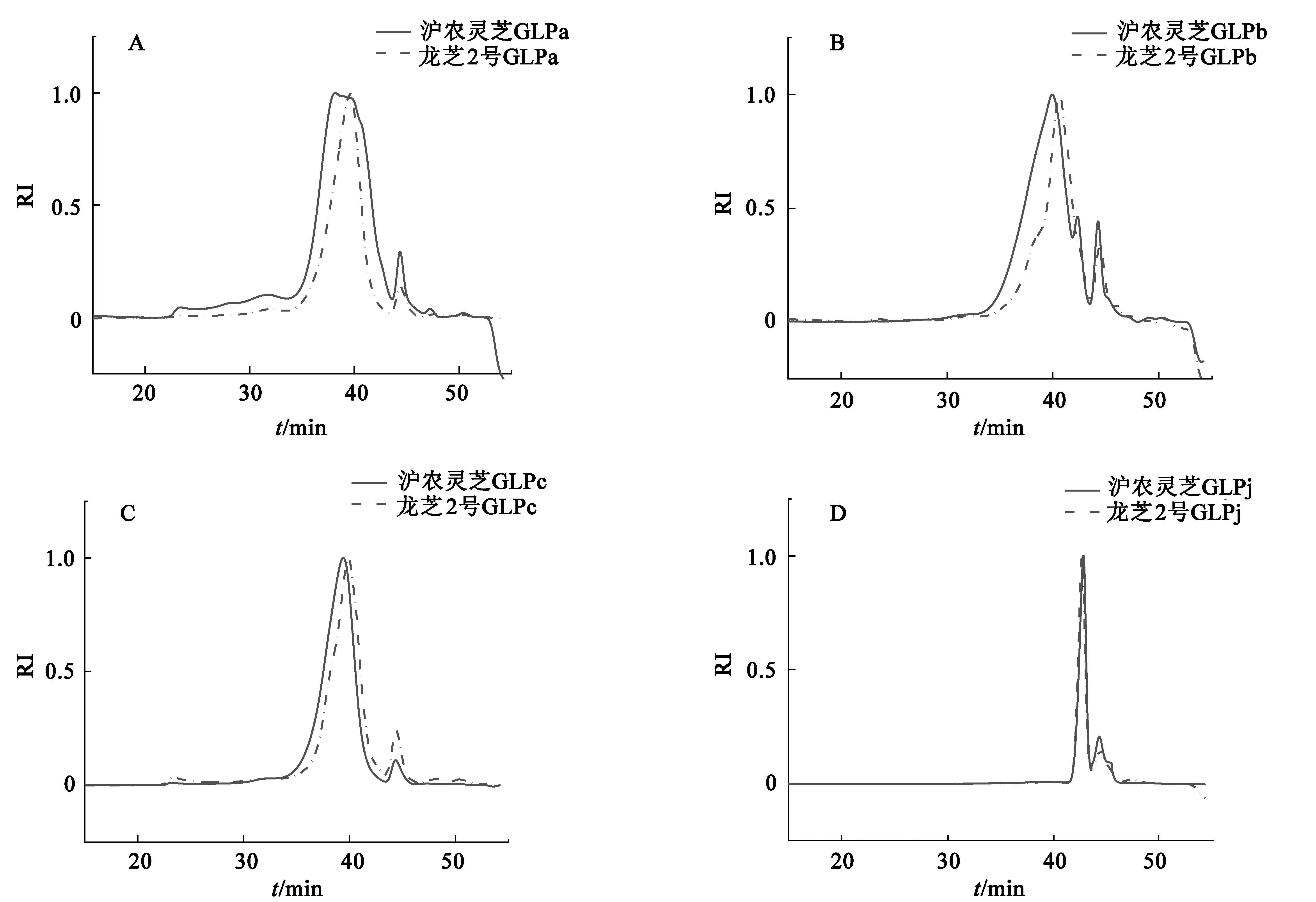
图1 沪农灵芝和龙芝2号多糖的高效液相色谱图
2.1.2 多糖的紫外吸收谱图
各灵芝多糖样品的紫外吸收如图2所示.由图2可以看出,各灵芝多糖样品均显示单一对称吸收峰,证明其中不含核酸和蛋白质,或含量极低不足以形成特征峰.

图2 灵芝多糖的紫外吸收谱图
2.2 灵芝多糖的相对分子质量
利用HPSEC-MALLS-RI技术对灵芝多糖的相对分子质量进行分析.以普鲁兰多糖(P-50,相对分子质量4.88×104)为标准品,对各个角度的激光进行归一化处理,计算多糖相对分子质量[11].各多糖组分的平均分子相对质量见表1.

表1 各组分多糖的相对分子质量
由表1可知,低体积分数乙醇沉淀法可得到大分子多糖,沪农灵芝、龙芝2号的30%醇沉多糖的平均相对分子质量均为百万级.随着乙醇体积分数增加,沉淀得到的多糖相对分子质量减小,沪农灵芝、龙芝2号的50%、80%醇沉多糖的平均相对分子质量均为1×105级.以稀NaOH为溶剂从灵芝水提残渣中提取得到的碱溶性多糖相对分子质量最低,小于1×104级.
2.3 灵芝多糖的抗氧化活性
2.3.1 多糖总还原力
通常情况下,物质的抗氧化活性与还原能力呈正相关关系[12].具有良好的还原能力的物质往往能提供电子,与活性氧基团反应,从而起到清除自由基的效果.其还原产物能与三价铁离子作用,生成普鲁士蓝络合物,在700 nm处有最大吸收峰.利用此性质,可根据反应液在700 nm处的吸收值推断原样品还原能力的强弱.沪农灵芝、龙芝2号各多糖组分的还原力见图3.
图3表明,各多糖样品的还原能力随着多糖质量浓度的增加而增加,但龙芝2号GLPj在大多数实验点下无显著差异,且其还原能力明显较弱.在所有测试浓度,2种灵芝的30%醇沉水溶性多糖GLPa均具有较强的还原力.
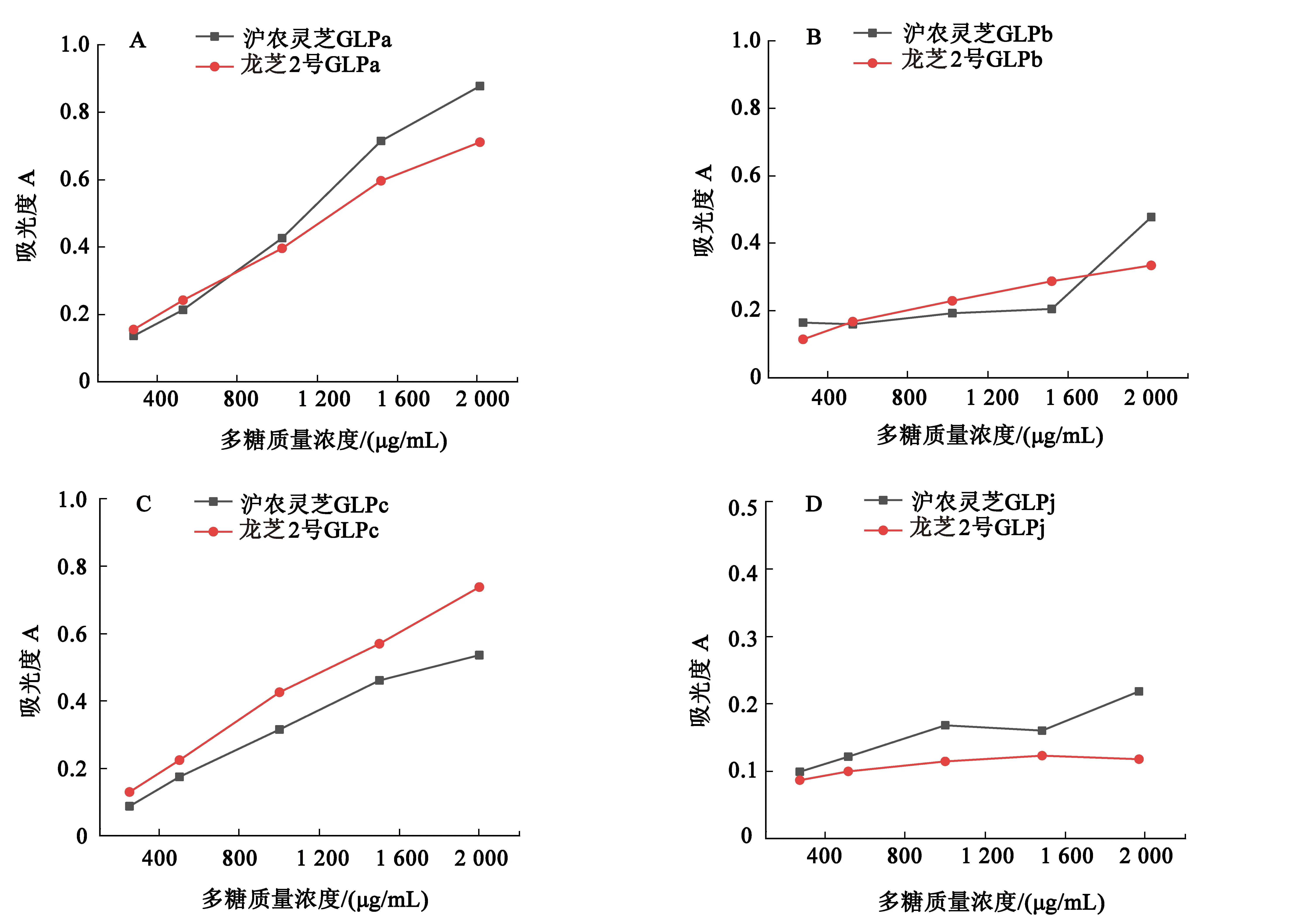
图3 灵芝多糖的还原力
提取方式、相对分子质量等差异都可能对灵芝多糖的还原力强弱带来影响.本实验中,对沪农灵芝来说,多糖的还原力大小顺序为:GLPa>GLPc>GLPb>GLPj,对龙芝2号来说,多糖的还原力大小顺序为:GLPa≈GLPc>GLPb>GLPj.可见,水溶性多糖比碱溶性多糖具有更好的还原力,且低体积分数乙醇沉淀得到的大分子多糖比小分子多糖有更好的还原力.
2.3.2 羟基自由基清除能力
羟基自由基是一种高活性的自由基,具有极大的生物毒性.清除羟基自由基对人体健康有着非常重要的作用[13].沪农灵芝、龙芝2号各多糖组分对羟自由基的清除能力如图4所示.由图4可知,各灵芝多糖对羟基自由基均有一定的清除作用,且随着质量浓度的增大,清除率越来越大.30%、80%醇沉水溶性多糖的清除作用较好,随着多糖质量浓度的增加,30%和80%醇沉水溶性多糖的羟自由基清除率最高到达40%~50%.2种灵芝的50%醇沉水溶性多糖清除作用相当,最大值在30%上下.碱溶性多糖清除羟基自由基的能力相对较弱,最大实验浓度下的清除率小于20%.

图4 灵芝多糖清除羟自由基的能力
2.3.3 DPPH自由基清除活性
DPPH自由基是一种稳定的质子自由基.良好的抗氧化剂能提供电子,与DPPH自由基配对,形成稳定分子,使得溶液在517 nm处的吸光度降低[14-16].吸光值变化的程度与自由基清除程度呈正相关.
沪农灵芝、龙芝2号各多糖组分的DPPH自由基清除能力见图5.由图5可看出,2种灵芝的多糖GLPa、GLPb、GLPc、GLPj均对DPPH自由基具有一定的清除能力,且随着多糖浓度的增加,清除能力亦增加.在实验范围内,灵芝水溶性多糖组分均具有较强的还原力,DPPH自由基清除率最高可达70%~80%左右,能够将溶液还原成黄色,表明清除能力显著.而碱溶性多糖的DPPH自由基最大清除率约为30%,其还原能力明显较弱.

图5 灵芝多糖的DPPH自由基清除能力
3 结语
本研究以沪农灵芝和龙芝2号的子实体为原材料,制得了不同质量浓度的水溶性多糖和碱溶性多糖,并检测了各多糖的体外抗氧化的能力.结果表明,各多糖均具有一定的还原力、羟基自由基清除能力和DPPH自由基清除能力,且随着样品质量浓度的增加,各活性也有所增强,呈浓度依赖性,这说明2个赤芝品种的子实体具有一定的抗氧化活性.结合灵芝多糖的提取方法、相对分子质量分析,微波辅助法得到的水溶性多糖具有较大相对分子质量,GLPa的相对分子质量达百万级,GLPb和GLPc的相对分子质量均在十万级,而碱提法得到的碱溶性多糖GLPj相对分子质量小于1万,实验中各水溶性多糖普遍比碱溶性多糖表现出更好的抗氧化活性,可能与提取方法及顺序有关.其中,GLPa抗氧化活性较其他多糖为最强,推测抗氧化活性可能与相对分子质量呈正相关.
灵芝多糖一直是灵芝研究的重点.除了提取方式、相对分子质量之外,灵芝多糖的组成结构、空间构象等都可能是影响多糖抗氧化活性的因素,因此,有必要进一步研究其化学结构的差异及构效关系,为灵芝中活性物质的精确利用提供研究基础.
