针刺对运动性骨骼肌损伤大鼠细胞自噬及Omi/HtrA2通路的影响
2022-10-14张欣李俊平王瑞元
张欣 李俊平 王瑞元
1 南京体育学院运动健康科学系(南京210014)
2 北京体育大学运动人体科学学院(北京100084)
运动性骨骼肌损伤是运动过程中常见的伤害之一。大负荷运动尤其是离心运动后,骨骼肌纤维结构和代谢功能发生损伤性改变,并伴有肌肉僵硬和肌力下降,最终影响人体的运动能力[1,2]。有研究发现,针刺在骨骼肌损伤的治疗过程中疗效显著[3-5],但机理尚未清晰。自噬在骨骼肌损伤细胞中发挥重要作用,合理的自噬水平对保持肌肉质量和维持肌纤维的完整性具有重要意义[6],Omi/HtrA2 可通过下游HS1 相关蛋白X-1(HS1-associated protein X-1,Hax-1)-Beclin1 途径参与自噬[7],针刺是否可以通过Omi/HtrA2 影响自噬进而促进骨骼肌修复有待探讨。本研究采用大负荷离心运动诱导大鼠骨骼肌损伤模型,给予大鼠大负荷离心运动和针刺两种干预方式,使用透射电子显微镜观察运动后骨骼肌细胞的自噬情况,同时使用Western Blot 观察大鼠骨骼肌Omi/HtrA2、Hax-1 与Beclin1 蛋白表达变化,探究针刺在骨骼肌细胞自噬中的作用,进而从细胞自噬的角度探究针刺改善运动性骨骼肌损伤的机理。
1 材料与方法
1.1 实验动物
健康雄性8周龄Sprague-Dawley(SD)大鼠128只,购于北京维通利华实验动物技术有限公司,体重221.77 ± 7.32 g。饲养条件为12 h 光照/12 h 黑暗昼夜光交替,室内温度20℃~26℃,相对湿度40%~70%,自由饮水饮食(北京维通利华实验动物技术有限公司提供)。于北京体育大学实验动物房训练,大鼠适应性训练前在屏障式动物房正常生长适应环境3天。
1.2 实验动物分组与干预方案
将128 只实验大鼠随机分为四组:对照组(Control,C 组)(n=8)、针刺组(Acupuncture,A 组)(n=40)、运动组(Exercise,E组)(n=40)、运动针刺组(EA组,运动后即刻沿大鼠小腿比目鱼肌纵向针灸针斜刺)(n=40)。每组根据干预后不同时间点又分为即刻、12 h、24 h、48 h和72 h组。具体分组情况见表1。
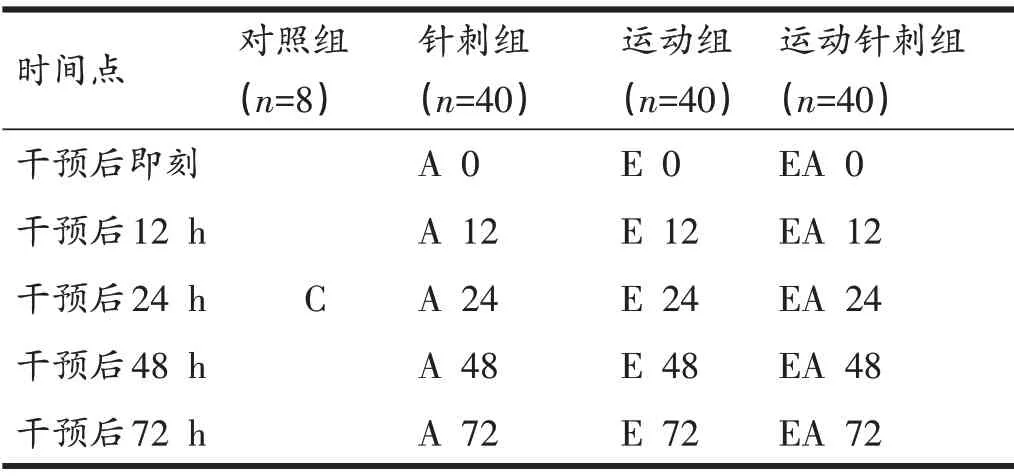
表1 实验动物分组
运动方案:采用运动生理学骨骼肌实验室经典离心运动损伤模型(参照Armstrong 的离心运动模型)[8]。使用动物跑台进行运动干预,所有参与运动的大鼠在适应性喂养3天后进行3天的适应性跑台训练:第1天跑台坡度0°,16 m/min,5 min;第2 天跑台坡度0°,16 m/min,10 min;第3 天休息。第4 天正式实验。实验干预方式为一次持续性下坡跑,跑台坡度为-16°,速度为16 m/min,运动时间为90 min。
针刺方案:用直径0.25 mm 的针灸针沿大鼠小腿比目鱼肌的纵向,从远端,进针角度约30°斜刺,穿过小腿比目鱼肌肌腹,针刺大鼠双腿比目鱼肌,留针2 min。
1.3 实验标本取样
实验大鼠分别在安静和针刺或运动干预后即刻、12 h、24 h、48 h 和72 h 时分批处死并取材。所有大鼠取材前先称体重,按体重注射10%的水合氯醛于大鼠腹腔内;麻醉成功后开腹,腹腔静脉抽血处死。分离并剪取比目鱼肌,将得到的比目鱼肌置于冰浴中的锡纸上,小心去除两侧肌腱和结缔组织。取材过程中,尽量避免肌肉牵拉。把处理后的比目鱼肌肌腹切成2段,其中一段大小为l mm×1 mm×3 mm,立即投入4℃预冷的Pon-812环氧树脂包埋,4℃保存,为透射电子显微镜观察做准备;另一段用锡纸包裹并小心装入冻存管,投入液氮速冻,之后放于-80℃冰箱保存,以备Western Blot蛋白测定。
1.4 测试指标及方法
1.4.1 透射电子显微镜观察骨骼肌自噬体的变化
(1)戊二醛固定:将包埋好的比目鱼肌切成小块,放入2.5%的戊二醛固定液,4℃保存2 h;(2)锇酸固定:0.2 mol/L 的PBS 漂洗3 次,放入1%的锇酸固定液,4℃固定2 h;(3)酒精脱水:继续用0.2 mol/L 的PBS 液漂洗3 次,每次10 min,彻底洗干净组织上的固定液,然后将组织依次放入50%、70%、90%的乙醇10 min,继续放入100%乙醇2 次,每次15 min;(4)置换:在室温条件下,将组织放入环氧丙烷两次,每次15 min,继续依次放入环氧丙烷和树脂1∶1 的混合液中浸透1 h,环氧丙烷与树脂1∶4 的混合液中浸透1 h,纯树脂浸透2 h;(5)纯树脂包埋:注入包埋剂,烤箱聚合固定;(6)修块:确定切配方向,解剖镜下修整包埋样本块;(7)制备切片:将样本切成0.5~1 μm的半薄切片后染色、定位,继续用超薄切片机切成50~70 nm的超薄切片,醋酸双氧铀和柠檬酸铅双重电子染色15~30 min;(8)JEM-1400透射电镜观察。
1.4.2 Western Blot方法测定相关蛋白含量
(1)骨骼肌组织蛋白提取:称取比目鱼肌组织,1 mg∶10 μl比例加入裂解液,低温条件下剪碎、研磨、匀浆,以14000 rpm 离心10 min,取上清液4℃暂存,BCA蛋白定量试剂盒测定并调整样品蛋白浓度,确保统一上样量,4∶1 比例加入5×样品缓冲液,煮沸10 min;(2)SDS- PAGE 凝胶电泳按配方配胶;(3)上样:加样15 μl/孔,浓度4 μg/μl;(4)电泳: 浓缩胶电压80 V,分离胶电压120 V;(5)转膜:恒流300 mA,转膜90 min;(6)封闭:5% BSA室温封闭2 h;(7)一抗孵育:用封闭液稀释一抗(GAPDH:1∶2000,Omi/HtrA2:1∶500,Hax-1:1∶1000,Beclin1:1∶1000),将膜置于其中室温孵育1 h ,然后置于4℃过夜;(8)洗膜:TBST 洗膜3次,每次10 min;(9)二抗孵育:用封闭液稀释二抗(羊抗兔IgG 1∶10000,羊抗小鼠IgG:1∶10000),室温孵育1 h;(10)洗膜:TBST 洗膜3 次,每次10 min;(11)凝胶成像:膜上滴加发光液,于BIO-RAD 的凝胶成像系统Chemi DocTMXRS曝光成像,用Image J软件分析图片,记录各组蛋白条带灰度值,并将其与GAPDH条带灰度值的比值均值进行组间比较。
1.5 统计学方法
采用SPSS17.0 分析数据,所得数据均采用平均值± 标准差的形式表示。对处理方式(运动、针刺)和时相因素(0 h、12 h、24 h、48 h、72 h)采用双因素方差分析(Two-way ANOVA)检验。若处理方式的主效应显著,则进一步执行对照组、针刺组、运动组、运动针刺组等组间的事后多重检验。各因素内的各个亚组比较采用单因素方差分析。Omi/HtrA2、Hax-1和Beclin1两两蛋白之间用Pearson 相关性分析法。显著性水平设为P<0.05。
2 结果
2.1 骨骼肌细胞自噬体电镜观察
如图1 所示,A 组针刺干预后即刻和12 h,骨骼肌细胞形态未见明显改变,视野所见肌原纤维排列整齐,线粒体均匀分布,Z线M线清晰,线粒体基膜下密集排布,未见明显的自噬体出现。针刺干预后24 h,线粒体形态稍有肿胀,电镜下嵴结构突出,视野中均未出现自噬体异常形成和分布,针刺干预后48 h 和72 h,视野范围内均未见明显异常。

图1 高倍电镜图显示针刺后大鼠骨骼肌肌原纤维结构和细胞器
如图2 所示,E 组运动后即刻,大鼠骨骼肌肌原纤维出现明显的牵拉性损伤,牵拉部位肌小节破坏严重,线粒体结构出现异常,肿大并向肌膜下聚集,自噬体不明显。运动后12 h,大鼠骨骼肌肌原纤维损伤程度并未发生明显改善,肌浆网肿胀管腔变大,出现明显空泡化,三联体有移位现象。肌原纤维间和肌膜下方均能找到内含线粒体、核糖体等细胞器的自噬体,且数量相对较多。运动后24 h,大鼠骨骼肌肌原纤维损伤部位肌小节逐渐恢复,线粒体向Z线处聚集,肌膜下或肌原纤维间自噬小泡多以自噬溶酶体的形式出现。运动后48 h 和72 h,肌小节排列规整,Z 线清晰,线粒体规则排列在Z先两侧,视野范围内未见明显自噬现象。
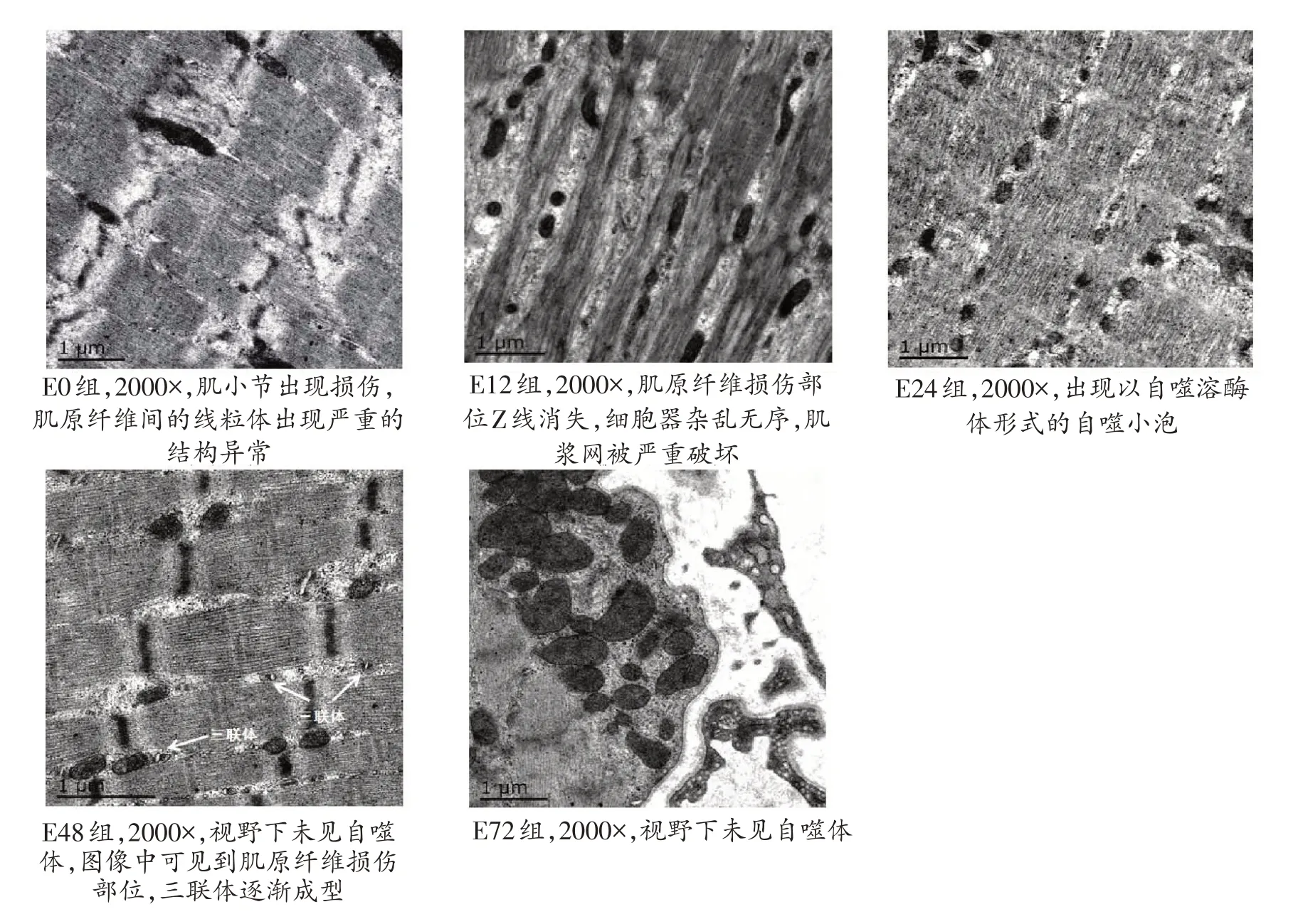
图2 高倍电镜图显示运动后大鼠骨骼肌肌原纤维结构和细胞器
如图3所示,EA组干预后即刻,大鼠骨骼肌肌原纤维出现明显的牵拉性损伤,牵拉部位肌小节破坏严重,线粒体结构出现异常,肿大并向肌膜下聚集,自噬体不明显。干预后12 h,大鼠骨骼肌肌原纤维损伤程度并未发生明显改善,肌原纤维间和肌膜下方均未能找到内含线粒体、核糖体等细胞器的自噬体。干预后24 h,大鼠骨骼肌肌原纤维损伤部位肌小节未见完全恢复,肌膜下或肌原纤维间未有自噬体出现。干预后48 h直至72 h,电镜视野下依然观察不到自噬体存在,肌原纤维及其周边的细胞器均与对照组比较无明显差异。

图3 高倍电镜图显示运动和针刺干预后大鼠骨骼肌肌原纤维结构和细胞器
2.2 不同干预后Omi/HtrA2、Hax-1 和Beclin1 蛋白表达变化
以对照组为基础值,本实验测得大鼠在不同干预后Omi/HtrA2、Hax-1和Beclin1的变化如图4、表2-4所示。

表2 不同干预后Omi/HtrA2蛋白表达量(%C组)

图4 不同干预后Omi/HtrA2、Hax-1和Beclin1的相对蛋白表达量变化
通过双因素方差分析对处理因素(运动、针刺)进行主效应检验,结果显示A 组无显著影响(P>0.01)。以对照组为基础值,A组各时间点Omi/HtrA2、Hax-1和Beclin1 蛋白含量均未发生明显变化,差异均无统计学意义。
以对照组为基础值,E 组一次大负荷离心运动后Omi/HtrA2蛋白表达迅速升高(P<0.01),在12小时达到峰值,随后在运动后24小时、48小时逐渐下降,运动后72 小时下降至与对照组无显著性差异。与Omi/HtrA2蛋白含量变化相反,一次大负荷离心运动后即刻,Hax-1 蛋白含量不升反降,在运动后12 小时降至最低(P<0.01),运动后24 小时、48 小时数值均低于基础值(P<0.05),直至运动后72 小时恢复至基础水平(P>0.05)。运动后即刻,自噬蛋白Beclin1表达显著升高(P<0.05),在运动后12 小时和24 小时达到峰值(P<0.01,两时间点间没有显著性差异),运动后72 小时逐渐恢复至与基础值无显著性差异。E 组Omi/HtrA2 和Hax-1 蛋白变化趋势的相关性分析结果为两者呈负相关性(r=-0.928,P<0.05);Hax-1和Beclin1蛋白变化趋势相关性分析结果为两者呈负相关性(r=-0.975,P<0.01)。
以对照组为基础值,EA 组干预后即刻,Omi/HtrA2迅速升高,12 小时、24 小时和48 小时均与对照组相比有显著性差异,其中12 小时时间点出现最高值(P<0.01);与Omi/HtrA2 蛋白含量变化相反,Hax-1 蛋白含量不升反降(P<0.05),在干预后12小时达到最低值,干预后24小时、48小时和72小时数值均低于基础值(P<0.05);骨骼肌自噬蛋白Beclin1 表达在运动针刺后即刻、12小时、24小时和48小时显著升高(P<0.05),在干预后12小时达到最高值(P<0.01),干预后72小时逐渐恢复至与基础值无显著性差异。
值得注意的是,通过双因素方差分析对处理因素(运动、针刺)进行主效应检验,骨骼肌自噬蛋白Omi/HtrA2 和Beclin1 表达水平的结果显示存在显著影响(P<0.01)。事后多重检验表明,A组与对照组相比无显著性差异(P>0.05);E组高于对照组(P<0.05);EA组明显高于对照组和A 组(P<0.05),但显著低于E 组(P<0.05)。Hax-1 蛋白含量则略有不同,E 组低于对照组(P<0.05);EA组明显低于对照组和A组(P<0.05),但显著高于E组(P<0.05)。
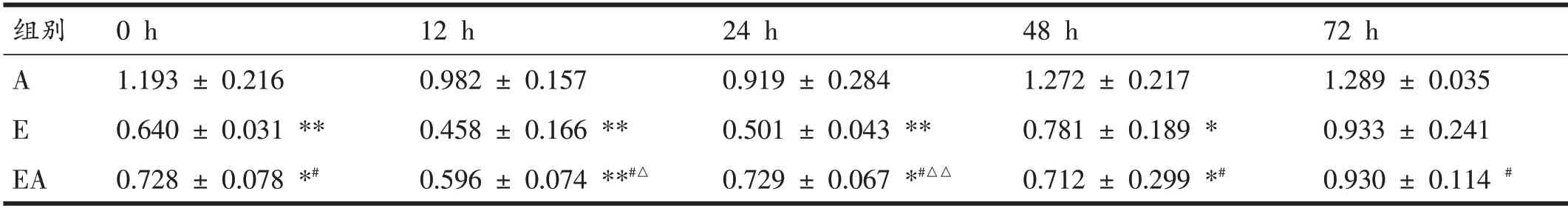
表3 不同干预后Hax-1蛋白表达量(%C组)

表4 不同干预后Beclin1蛋白表达量(%C组)
3 分析与讨论
3.1 运动对大鼠骨骼肌细胞自噬的影响
越来越多的证据表明,适当、科学的运动可以诱导自噬或优化自噬的功能状态,在骨骼肌修复过程中发挥关键作用[9-10]。有研究报道,受试小鼠急性剧烈运动后2~7天,受损肌纤维自噬现象明显[11],溶酶体的生化功能最为活跃[12];亦有研究报道,大鼠在跑台急性运动30 分钟后,自噬蛋白微管相关蛋白轻链3(LC3-Ⅱ)即刻升高,运动后3小时恢复至基础水平[13]。本研究给予大鼠一次大负荷离心运动干预,发现随着时间的变化,自噬蛋白Beclin1 表达量在运动后即刻、12 小时、24 小时和48 小时均显著高于对照组。电镜下观察各组骨骼肌细胞形态结构和细胞器,发现运动后即刻,骨骼肌肌小节出现损伤,大量线粒体向肌膜聚集,肌原纤维间的线粒体出现严重的结构异常,肌原纤维损伤部位Z线消失,细胞器杂乱无序,肌浆网被严重破坏;运动后12小时,完整视野下肌原纤维间自噬体正在形成,观测明显;运动后24 小时,自噬小泡多以自噬溶酶体的形式出现;运动后48 小时,完整视野下自噬体很难捕捉。这说明一次大负荷离心运动成功诱导了大鼠骨骼肌自噬,且自噬水平可能与运动干预的方式和负荷有关。另外,Beclin1蛋白表达峰值出现在运动后12小时和24 小时,且两时间点数值无显著性差异,提示一次大负荷运动后12小时是研究自噬的关键时间点。
关于大鼠骨骼肌细胞的自噬机制的研究较多,其中Omi/HtrA2-Hax1-Beclin1是2010年以来发现的细胞自噬信号通路[7]。离体实验证实Omi/HtrA2位于自噬核心蛋白Beclin1 的上游参与自噬调节,Omi/HtrA2 通过切割Bcl-2家族相关蛋白Hax-1,解除其对Beclin1的抑制,最终诱导自噬[6]。在运动诱导的骨骼肌自噬过程中,Omi/HtrA2-Hax-Beclin1 同样存在并发挥作用[14]。本研究结果验证,运动干预引起Omi/HtrA2蛋白表达变化的过程中,Hax-1 和Omi/HtrA2、Beclin1 均呈现负相关性表达。值得注意的是,自噬在细胞中有双重作用,既可以发挥细胞保护作用又可以发挥细胞损伤作用,主要取决于应激条件的不同[15]。
3.2 针刺影响运动性骨骼肌细胞自噬的可能机制
在细胞营养缺乏或细胞损伤修复的过程中,自噬可以降解细胞内大分子有用物质和细胞器,释放分解产物,为细胞提供能量或用于合成构建物质,援助细胞生存。正常情况下,自噬过程会在机体度过危机后适时停止,否则自噬泡非特异性捕获胞浆成分的特性会导致细胞发生不可逆的损伤,直至引起细胞死亡[16]。已知针刺可以增强损伤骨骼肌细胞的修复能力,降低损伤水平,有效缓解运动训练造成的骨骼肌损伤异常[17],有研究学者对此作了针刺干预的机制研究,发现针刺之所以能促进损伤骨骼肌修复,主要在于其对骨骼肌蛋白分解和合成代谢的双向调节作用[18]。但是针刺对自噬的影响机制目前尚未明晰。
本研究在大鼠一次大强度离心运动诱导骨骼肌损伤后连续监测自噬蛋白Beclin1,运动后72小时自噬消失,同时给予一次大强度离心运动后针刺干预,自噬现象则会明显降低,同时伴有损伤骨骼肌超微结构修复,说明针刺可缓解损伤骨骼肌细胞自噬,促进修复。为明确针刺促进损伤骨骼肌的修复机制,本研究观察单一针刺后大鼠骨骼肌细胞Omi/HtrA2-Hax1-Beclin1通路蛋白表达的变化,结果发现,针刺并未影响健康大鼠的骨骼肌相关蛋白表达,虽然电镜下线粒体形态稍有肿胀,但电镜视野中未出现自噬体异常形成和分布,推测针刺可能对健康大鼠骨骼肌细胞有局部性轻微影响,且可能与细胞内部平衡调节有关。继续追加运动后针刺干预实验,Omi/HtrA2 与自噬蛋白Beclin1 表达量均有改善性下降,Hax-1蛋白表达量改善性提高,该结论与运动诱导骨骼肌自噬的Omi/HtrA2-Hax-Beclin1 通路变化趋势一致[14]。提示针刺可能通过Omi/HtrA2- Hax-1- Beclin1 信号通路缓解一次大负荷离心运动诱导的自噬。
4 结论
一次大强度离心运动可造成骨骼肌超微结构变化,诱导骨骼肌细胞自噬增强;一次大负荷运动后进行针刺干预,细胞的自噬水平明显降低。其作用机制可能为:一次大强度离心运动刺激Omi/HtrA2蛋白表达激活,增强自噬反应;针刺可通过Omi/HtrA2- Hax-1-Beclin1 信号通路缓解一次大负荷离心运动诱导的自噬。
