缺氧/复氧诱导心肌细胞分泌高表达miR-208b的外泌体而调控心肌成纤维细胞活化、迁移和铁死亡
2022-10-14刘圣桂宋风荣别自东巩传芬
刘圣桂 宋风荣 别自东 巩传芬
山东医学高等专科学校附属费县人民医院心血管内科,临沂 253400
逐渐有研究发现,外泌体等一些细胞外囊泡能携带特异的RNA和蛋白而介导细胞和组织间的通讯,进而参与调控多种重要的生物学事件,例如炎性反应、肿瘤进展、凋亡和铁死亡等细胞死亡、血管生成和免疫应答等,从而有可能成为疾病诊断的早期标志物及靶向运载药物的重要载体[1-2]。近年来,有研究表明,心肌细胞和心肌成纤维细胞间也能通过外泌体等进行信息交换,从而影响对方的生物学功能[3-4]。例如,心肌细胞在心肌梗死后能分泌大量的外泌体到血清和细胞间,从而影响疾病的生理病理过程[5]。目前,关于外泌体的研究已成为心脏疾病诊治的研究热点,但目前关于其中的作用机制的研究还不多。已有多项研究表明,各种外泌体中含有丰富的miRNAs,miR-208b就是其中一种[6-7]。miR-208b特异表达于心脏,且参与心肌肥厚、心肌梗死、心肌缺血、心肌纤维化及心力衰竭等多种心血管疾病的调控[7-9]。在多种心血管疾病发生的过程中,心肌组织均会分泌高表达miR-208b的外泌体,进而影响其他细胞的生理过程,从而影响疾病的进展过程[7-8]。但外泌体源性miR-208b是否能影响心肌成纤维细胞的生物学功能,目前研究甚少。另外,铁死亡是新发现的一种细胞死亡模式,是铁离子和活性氧(reactive oxygen species,ROS)不断生成累积而导致的[10]。目前有研究指出,铁死亡在多种心血管疾病中发挥重要作用,且与成纤维细胞的活化关系密切[11-12]。但miR-208b是否也参与了铁死亡的调控,目前还未有研究报道。本研究通过缺氧/复氧诱导心肌细胞分泌外泌体,探讨外泌体源性miR-208b是否影响心肌成纤维细胞的生物学功能,将为心肌疾病的防治提供新思路和新靶点,同时为外泌体和其来源的miRNAs的临床应用提供更好的指导作用。
资料与方法
1、细胞培养和缺氧/复氧模型建立
人心肌细胞和人心肌成纤维细胞分别用含5%胎牛血清和双抗的心肌细胞培养基和成纤维细胞培养基-2进行培养。心肌细胞转染或不转染50 nmol/L miR-208b 抑制剂后培养于缺氧条件(含1%氧气)12 h,然后复氧(正常培养条件)培养12 h。
2、外泌体分离和鉴定
收集细胞培养上清液,在3 000×g下离心15 min,然后通过0.22 µm 膜过滤。用ExoQuick-TC 按照说明书进行分离外泌体,然后通过JEM-2100透射电子显微镜观察外泌体形态。同时,裂解外泌体并进行蛋白质印迹分析,以检测外泌体标志物CD63和TSG101的表达。
3、细胞转染和荧光定量PCR(RT-qPCR)
根据试剂说明书,使用Lipofectamine 2000 分别将50 nmol/L miR-208b 抑制剂、miR-208b mimics 和 miRNA 阴性对照(NC)转染进细胞。然后心肌细胞进行缺氧或缺氧/复氧处理,心肌成纤维细胞加入正常培养心肌细胞源性外泌体(N-Exo)、缺氧/复氧心肌细胞来源的外泌体(H/R-Exo)、铁死亡诱导剂Erastin(10 µmol/L)或Erastin加H/R-Exo 进行共培养。用miRNeasy Mini Kit 试剂盒提取心肌细胞、外泌体和心肌成纤维细胞的总RNA,接着用M-MLV 逆转录酶、oligo(dT)和 random primer(或 miR-208b stem-loop RT primer)将RNA 逆转录成cDNA。使用SYBR Green qPCR SuperMix 通过 qRT-PCR 测定 RNA 表达水平。U6 和 GAPDH 被用作 miRNA 和 mRNA 的内部对照,相对表达水平通过 2-ΔΔCt值计算。
4、外泌体摄取检测
在 37 ℃下用2 µl CellTracker CM-DiI 标记外泌体1 h,用ExoQuick-TC 沉淀DiI 标记的外泌体,然后添加到心肌成纤维细胞中进行共培养12 h。之后,固定并洗涤心肌成纤维细胞,并加入核染色(DAPI)对细胞核进行染色10 min。最后,使用荧光显微镜观察心肌成纤维细胞。
5、Western blot实验
使用含蛋白酶抑制剂的RIPA buffer 从心肌细胞、外泌体和心肌成纤维细胞中提取总蛋白。使用8% SDS-PAGE分离等量的每个蛋白样品,并将分离的蛋白转移到PVDF膜上。使用CD63、TSG101、α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)、谷胱甘肽过氧化物酶 4(glutathione peroxidase 4,GPX4)或β-肌动蛋白(β-actin)一抗和辣根过氧化物酶结合的二抗进行蛋白质印迹分析。最后,使用BeyoECL Plus显示印迹信号。
6、细胞存活力检测
心肌成纤维细胞培养24 h 后,使用细胞计数试剂盒-8(CCK-8)检测细胞活力。每孔中加入10µl CCK-8 溶液,用酶标仪测量450 nm的吸光度。
7、酶联免疫吸附试验(ELISA)
收集心肌成纤维细胞的培养上清液,用human pro-collagen Ⅰ alpha 1 DuoSet ELISA kit 和 human collagenⅢELISA kit 根据试剂盒说明书分别检测Collagen Ⅰ和Collagen Ⅲ的浓度。
8、Transwell检测细胞迁移
将200 µl 无血清培养基(含2×105个心肌成纤维细胞)接种到上室,下室加入含2.5%胎牛血清的培养基。放置培养箱8 h后,迁移细胞用4%多聚甲醛固定,接着用结晶紫染色10 min。最后,选择5 个随机区域进行细胞计数,评估细胞迁移水平。
9、脂质过氧化和Fe2+检测
使用ROS assay kit 分析细胞内活性氧水平,先将心肌成纤维细胞与 10 µmol/L ROS 荧光探针 DCFH-DA 于 37 ℃避光孵育20 min,然后用荧光分光度计在488 nm 激发波长和525 nm 发射波长下检测荧光强度。按照试剂盒说明书所示,使用lipid peroxidation MDA assay kit 检测心肌成纤维细胞裂解物中丙二醛(malonaldehyde,MDA)的含量。用iron assay kit检测心肌成纤维细胞中Fe2+水平。
10、统计学方法
使用GraphPad Prism 软件进行统计分析。符合正态分布的计量资料以均数±标准差()表示,多组间的显著性分析使用单因素方差分析(ANOVA),P<0.05 为差异有统计学意义。
结 果
1、缺氧/复氧诱导心肌细胞分泌高表达miR-208b 的外泌体
对心肌细胞的检测发现,其能分泌外泌体(图1A),且外泌体显著表达相关的标志物(图1B)。缺氧和缺氧/复氧(H/R)均能促进miR-208b 在心肌细胞中的表达,且H/R 的促表达效果更显著(图1C)。检测心肌细胞所分泌外泌体中miR-208b 的表达也发现,缺氧和H/R 显著促进外泌体中miR-208b 的表达,且 H/R-Exo 中 miR-208b 的表达水平更高(图1D)。心肌细胞转染miR-208b 抑制剂后,外泌体中miR-208b的表达显著减少(图1C、D)。这表明,缺氧能促进miR-208b 在心肌细胞和其分泌外泌体中的表达,且H/R 进一步增强上述效果。不过心肌成纤维细胞进行缺氧和H/R处理时,miR-208b 在细胞中的表达变化不明显(图1E),表明缺氧和H/R 不影响miR-208b 在心肌成纤维细胞中的表达。
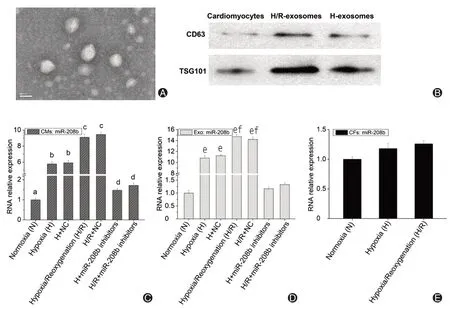
图1 缺氧/复氧促进心肌细胞和其分泌外泌体高表达miR-208b。A:电镜观察心肌细胞所分泌外泌体;B:Western blot检测外泌体标志物CD63和TSG101的表达水平;C~D:心肌细胞培养于缺氧条件(Hypoxia,含1%氧气)12 h后,复氧(Reoxygenation,正常培养条件)培养12 h,或转染miR-208b抑制剂后再进行H 或H/R 处理,接着用荧光定量PCR 检测心肌细胞(C)和其分泌外泌体(D)中miR-208b的表达水平,NC为miRNA 阴性对照;E:心肌成纤维细胞进行缺氧或缺氧/复氧处理,然后用荧光定量PCR检测细胞中miR-208b的表达水平
2、H/R-Exo 通过miR-208b 促进心肌成纤维细胞的存活和迁移
将H/R-Exo 加入到心肌成纤维细胞进行共培养时,可明显观察到心肌成纤维细胞摄入外泌体(图2A)。同时,H/R-Exo 显著增加miR-208b 在心肌成纤维细胞中的表达,而N-Exo无此作用(图2B)。H/R-Exo 明显促进心肌成纤维细胞的存活力,而抑制miR-208b 表达时,H/R-Exo 促细胞存活的作用显著被减少,且N-Exo 无法促进细胞存活力(图2C)。同时对细胞迁移的检测表明,H/R-Exo 显著促进细胞迁移,miR-208b 的抑制物能减弱上述外泌体的促迁移作用;而N-Exo对细胞的迁移无影响(图2D~E)。这表明H/R心肌细胞所分泌外泌体通过高表达的miR-208b 促进心肌成纤维细胞的存活和迁移。

图2 缺氧/复氧心肌细胞源性外泌体(H/R-Exo)通过miR-208b 促进心肌成纤维细胞存活和迁移。A:H/R-Exo 用荧光染料DiI 标记后加入到心肌成纤维细胞(CFs)中进行共培养,然后荧光显微镜观察CFs 摄取外泌体,DAPI 为核染色;B~D:CFs 分别加入正常培养心肌细胞源性外泌体(N-Exo)和H/R-Exo,或转染miR-208b 抑制剂后再加入H/R-Exo 进行共培养;B:荧光定量PCR 检测miR-208b的表达水平;C:细胞计数试剂盒-8(CCK-8)检测细胞存活力,D~E:Transwell检测细胞迁移
3、H/R-Exo 通过miR-208b 增强心肌成纤维细胞的活化
另 外 ,H/R-Exo 显 著 增 强 α -SMA、Collagen Ⅰ 和Collagen Ⅲ的mRNA 表达水平(图3A~C),并促进α-SMA的蛋白表达(图3D),增加Collagen Ⅰ和Collagen Ⅲ的分泌水平(图3E~F),而N-Exo 无此作用。转染miR-208b 抑制剂的心肌成纤维细胞与H/R-Exo 共培养时,H/R-Exo 促进α-SMA、Collagen Ⅰ和Collagen Ⅲ表达的作用显著被减弱(图3)。因此,H/R-Exo 通过携带高水平的miR-208b 而促进心肌成纤维细胞的活化。

图3 缺氧/复氧心肌细胞源性外泌体(H/R-Exo)通过miR-208b 增强心肌成纤维细胞(CFs)的活化。CFs 分别加入正常培养心肌细胞源性外泌体(N-Exo)和H/R-Exo,或转染miR-208b抑制剂后再加入H/R-Exo 进行共培养。荧光定量PCR 检测α-平滑肌肌动蛋白(α-SMA)(A)、Collagen Ⅰ(B)和Collagen Ⅲ(C)的表达,Western blot 检测α-SMA 的蛋白表达水平(D),酶联免疫吸附试验(ELISA)检测Collagen Ⅰ(E)和Collagen Ⅲ(F)的分泌水平
4、H/R-Exo 通过miR-208b 增加心肌成纤维细胞的铁死亡水平
最新的研究发现,铁死亡,一种新的细胞死亡方式,参与了成纤维细胞的活化过程[12]。因此,研究继续探讨H/R-Exo 所含miR-208b 是否与铁死亡相关。用铁死亡诱导剂Erastin 处理心肌成纤维细胞发现,铁死亡的主要指标ROS、MDA 和Fe2+的含量显著增加(图4A~C),而调控铁死亡进程的关键因子GPX4的表达明显下调(图4D~E),表明细胞的铁死亡水平增加。同时加入Erastin 和H/R-Exo 时,ROS、MDA 和 Fe2+的累积进一步增强(图 4A~C),而GPX4 的表达进一步下调(图4D~E)。心肌成纤维细胞转染miR-208b抑制剂后再加入Erastin 和H/R-Exo 时,上述铁死亡相关指标的变化水平显著低于Erastin 和H/R-Exo(Erastin+H/R-Exo)处理组(图4)。另外,miR-208b mimics也能增加ROS、MDA 和Fe2+的含量(图4),表明miR-208b 能促进铁死亡发生。因此,H/R-Exo 可通过携带高水平的miR-208b而增强心肌成纤维细胞的铁死亡进程。

图4 缺氧/复氧心肌细胞源性外泌体(H/R-Exo)通过miR-208b 诱导心肌成纤维细胞(CFs)的铁死亡发生。CFs 分别加入铁死亡诱导剂 Erastin、Erastin 和 H/R-Exo、Erastin 加 H/R-Exo 和miR-208b 抑制剂、miR-208b mimics。用活性氧(ROS)荧光探针 DCFH-DA 检测ROS 生成量(A),用脂质过氧化丙二醛(MDA)检测试剂盒检测MDA 的产生(B),用铁测定试剂盒测量Fe2+的含量(C),荧光定量PCR和Western blot检测谷胱甘肽过氧化物酶4(GPX4)的表达水平(D、E)
讨 论
多种心脏病均会导致心肌纤维化,而纤维化的出现是决定心血管病预后的重要因素,会导致心律失常、心力衰竭甚至猝死等严重并发症[13]。因此,了解清楚心肌纤维化发生发展的机制将有助于心脏疾病的预防治疗,并可能找到合适的治疗靶点。
逐渐有研究发现,在心肌疾病发生的过程中,不同细胞间可以通过外泌体等进行信息交流,从而影响疾病的进展过程[14]。例如,Luo 等[15]研究发现,缺血后处理可上调心肌成纤维细胞所分泌外泌体/微囊泡中miR-423-3p 的表达,进而这些外泌体/微囊泡通过miR-423-3p 靶向下游效应器RAP2C而在缺血再灌注损伤急性期发挥心脏保护作用。血管紧张素Ⅱ(Ang Ⅱ)会诱导心肌成纤维细胞释放外泌体,进而通过激活Akt 和丝裂原活化蛋白激酶(MAPK)通路而增加心肌细胞中Ang Ⅱ的产生及其受体的表达,从而加剧Ang Ⅱ诱导的心肌细胞肥大[16]。本研究则发现,缺氧和缺氧/复氧均可以诱导心肌细胞分泌高表达miR-208b 的外泌体。Wang 等[17]研究表明,缺氧会导致 H9c2 细胞分泌高表达miR-208a/b 的细胞外小泡,而这些细胞外小泡会通过miR-208a/b 而靶向抑制 RNA 结合蛋白抖动(QKI)的表达,从而加剧缺氧/复氧(H/R)诱导的心肌细胞凋亡。本研究则进一步发现,H/R-Exo 明显促进心肌成纤维细胞的存活力和迁移,增强α-SMA、Collagen Ⅰ和Collagen Ⅲ的表达,而miR-208b 的抑制物能显著减弱上述外泌体对心肌成纤维细胞生物学功能的影响作用。因此,心肌细胞外泌体源性miR-208b在心肌疾病中具有重要意义。
本研究同时还发现,用铁死亡诱导剂Erastin 处理心肌成纤维细胞时,H/R-Exo 能进一步增强铁死亡主要指标ROS、MDA 和Fe2+的累积,抑制铁死亡关键调控因子GPX4 的表达;miR-208b 的抑制物能明显减弱Erastin 和H/R-Exo 对铁死亡的影响作用,并且miR-208b mimics 具有诱发铁死亡发生的作用。本研究首次发现,H/R-Exo 能通过miR-208a/b而影响心肌成纤维细胞的铁死亡。而逐渐有研究表明,铁死亡能影响成纤维细胞的活化[18-19]。例如,长链非编码RNA-ZFAS1 在博莱霉素(BLM)诱导的肺纤维化大鼠肺组织和转化生长因子-β1(TGF-β1)处理的HFL1 细胞中表达上调,可通过miR-150-5p/SLC38A1轴而诱导铁死亡发生,从而促进TGF-β1 诱导的成纤维细胞活化、炎症和脂质过氧化,增强BLM 诱导的脂质过氧化和肺纤维化进展[18]。而在缺血再灌注(I/R)大鼠模型和Ang Ⅱ诱导的心肌成纤维细胞模型中,miR-375-3p 通过抑制GPX4 的表达而加速心肌细胞的铁死亡,从而促进纤维化;miR-375-3p拮抗剂(或抑制剂)和Fer-1 促进心脏成纤维细胞的抗氧化能力,减少GPX4介导的铁死亡过程,减轻I/R诱导的心脏成纤维细胞活化[19]。另外,MLK3主要调节铁死亡导致的慢性心力衰竭晚期心肌纤维化和JNK/p53 信号通路介导的氧化应激,从而促进压力超负荷引起的不良心肌纤维化[20]。上述研究均表明,铁死亡能促进成纤维细胞的活化,表明铁死亡是纤维化疾病的一个重要诱因。
综合上述,H/R-Exo 能通过高表达的miR-208b 而调控心肌成纤维细胞的存活力、迁移、活化和铁死亡等生物学功能,表明外泌体源性miR-208b 具有重要的功能,可能是心肌疾病密切相关的关键调控因子。
利益冲突所有作者均声明不存在利益冲突
