基于肠道菌群和系统药理学探讨藏药十五味乳鹏丸抗高尿酸血症肾病的作用机制
2022-10-14谢昊宸张博恒穆卡然艾买江何彭可严亨秀邵晓妮
谢昊宸,张博恒,穆卡然·艾买江,李 娜,何彭可,严亨秀,邵晓妮*
基于肠道菌群和系统药理学探讨藏药十五味乳鹏丸抗高尿酸血症肾病的作用机制
谢昊宸1,张博恒2,穆卡然·艾买江2,李 娜2,何彭可2,严亨秀2,邵晓妮2*
1. 西南民族大学 青藏高原研究院,四川 成都 610041 2. 西南民族大学药学院,四川 成都 610041
基于肠道菌群、网络药理学和分子对接技术多维度挖掘藏药十五味乳鹏丸(Shiwuwei Rupeng Pills,SRP)抗高尿酸血症肾病(hyperuricemic nephropathy,HN)的作用机制。腺嘌呤联合乙胺丁醇构建HN大鼠模型,设置对照组、模型组、别嘌醇(50 mg/kg)组和SRP高、低剂量(1.2、0.4 g/kg)组。连续给药14 d后,检测大鼠血清中尿酸(uric acid,UA)、肌酐(creatinine,CREA)及尿素氮(urea nitrogen,BUN)水平;采用苏木素-伊红(HE)染色法观察肾组织病理变化。获取SRP和HN核心靶点,构建“药物-活性成分-作用靶点”和蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,并对潜在靶点进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析;采用分子对接技术模拟关键成分与核心靶点的结合活性。采用qRT-PCR法验证各组大鼠肾组织中关键靶点的mRNA表达;收集大鼠粪便,采用16S rDNA高通量测序法检测肠道菌群变化。SRP显著降低HN大鼠血清中UA、CREA及BUN水平(<0.05),并改善肾组织病理损伤。SRP可能通过作用于晚期糖基化终末化产物(advanced glycation end products,AGE)-晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)、白细胞介素-17(interleukin-17,IL-17)和肿瘤坏死因子(tumor necrosis factor,TNF)等信号通路发挥抗HN作用。白蛋白(albumin,ALB)、TNF、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARG)、信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)和骨髓细胞瘤病毒癌基因(myelocytomatosis viral oncogene,MYC)与木犀草素、槲皮素、山柰酚、表没食子酸儿茶素没食子酸酯和儿茶素有较好的对接活性。SRP显著下调HN大鼠肾组织中、和mRNA表达水平(<0.05),显著上调mRNA表达水平(<0.05)。与模型组比较,SRP组大鼠肠道菌群丰富度和多样性显著升高,且在门水平上降低拟杆菌门和厚壁菌门的比例;主要降低、、及菌属,增加及的相对丰度。SRP可以通过调节肠道菌群结构,调控AGE-RAGE、IL-17、TNF等信号通路及相关靶点的表达发挥抗HN作用,具有多成分、多靶标及多通路的治疗特点。
十五味乳鹏丸;高尿酸血症肾病;肠道菌群;网络药理学;分子对接;肿瘤坏死因子;过氧化物酶体增殖物激活受体γ;白蛋白;信号传导与转录激活因子3
高尿酸血症肾病(hyperuricemic nephropathy,HN)是由于体内尿酸堆积过多导致的肾脏损伤,是高尿酸血症的常见并发症。目前临床上的疗法主要涉及尿酸的合成与排泄,但这些疗法都有使用限制并会产生一定的不良反应[1]。且高尿酸血症是涉及多个器官的复杂生物过程,越来越多的证据表明肠道菌群紊乱与HN的发展有关,肠道微生物的代谢产物胆汁酸以及三甲胺等都会在肾脏发挥作用,驱动着肾脏的炎症反应[2]。因此寻找新的治疗HN药物是临床亟待解决的问题。
藏药治疗高尿酸血症历史悠久,具有多靶点、不良反应少的优势,因此临床上运用藏药治疗HN独具特色。藏族药十五味乳鹏丸(Shiwuwei Rupeng Pills,SRP)由儿茶、毛诃子、余甘子等15味藏药材组成。现代药理学研究表明,SRP中多种有效成分具有降尿酸、抗炎、镇痛、抗氧化等作用[3],临床上用于治疗急慢性痛风、高尿酸血症等相关疾病[4]。SRP对高尿酸血症相关肾功能损伤具有明显的改善作用[5-7],但目前SRP用于治疗HN的具体作用机制尚未明确。本研究采用腺嘌呤联合乙胺丁醇诱导构建HN大鼠模型,利用肠道菌群、网络药理学和分子对接技术探究SRP抗HN的作用机制,为其临床应用提供实验依据。
1 材料
1.1 动物
SPF级雄性Wistar大鼠30只,7周龄,体质量(200±20)g,购自成都达硕实验动物研究中心,动物许可证号SCXK(川)2020-030。动物饲养于西南民族大学药学院SPF级动物实验室,自由进食饮水,温度(23±1)℃,相对湿度(55±5)%,每12小室昼夜间断性照明,适应性培养1周。动物实验方案均经过西南民族大学动物伦理委员会审核批准(批准号No.2021-16)。
1.2 药品与试剂
十五味乳鹏丸(批号190808)购自甘南佛阁藏药有限公司;别嘌醇片(批号20201004)购自合肥久联制药有限公司;腺嘌呤(批号A108804)购自上海阿拉丁生化科技有限公司;盐酸乙胺丁醇片(批号201202)购自成都锦华药业有限公司;血清尿酸(uric acid,UA)试剂盒(批号Cobas57121601)、血清肌酐(creatinine,CREA)试剂盒(批号Cobas58321702)和血清尿素氮(urea nitrogen,BUN)试剂盒(批号Cobas58266201)购自德国Roche公司;苏木素-伊红(HE)染色试剂(批号G1003)购自武汉赛维尔生物科技有限公司;PrimeScriptTMRT Reagent Kit with gDNA Eraser(批号AI21034A)购自日本Takara公司;iTaq™ Universal SYBR Green Super mix(批号L001752A)购自美国Bio-Rad公司;粪便基因组DNA提取试剂盒(批号116560-200)购自MP Biomedical公司。
1.3 仪器
H1850R型高速冷冻离心机(湖南湘仪离心机仪器有限公司);cobas c311型全自动血生化仪(德国Roche公司);VeritiTM96孔梯度PCR仪、QuantStudioTM3型荧光定量PCR仪(美国Thermo Fisher Scientific公司);RM2016型病理切片机(上海徕卡仪器有限公司);JB-P5型包埋机(武汉俊杰电子有限公司);Illumina Miseq高通量测序仪(美国Illumina公司)。
2 方法
2.1 动物实验
2.1.1 分组、造模和给药 Wistar大鼠随机分为对照组、模型组、别嘌醇(50 mg/kg,相当于临床等效剂量)组和SRP高、低剂量(1.2、0.4 g/kg,分别相当于临床剂量的3、1倍)组,每组6只。腺嘌呤和盐酸乙胺丁醇溶于生理盐水配制成1%腺嘌呤和2.5%盐酸乙胺丁醇混悬液,对照组ig等体积生理盐水,其余各组ig混悬液,1次/d,连续21 d。SRP临用前碾碎成粉末,用生理盐水配制成0.24、0.08 g/mL的溶液。别嘌醇研磨成粉末,溶于生理盐水配制成0.5%混悬液。在造模第8天时开始给药,各给药组ig相应药物,对照组和模型组ig等体积生理盐水,1次/d,连续14 d。
2.1.2 血清中UA、CREA和BUN水平的测定 末次给药后,大鼠禁食12 h,ip 0.3%戊巴比妥钠(40 mg/kg)麻醉,腹主动脉取血,室温静置30 min,3000 r/min离心15 min,取血清,按照试剂盒说明书操作,使用全自动生化仪检测各组大鼠血清中UA、CREA和BUN水平。
2.1.3 HE染色法检测肾脏组织病理变化 取各组大鼠肾脏组织,于4%多聚甲醛中固定,包埋切片后,进行HE染色,于显微镜下观察肾脏组织的病理变化。
2.2 网络药理学与分子对接
2.2.1 SRP活性成分收集及靶点的获取 从TCMSP数据库(http://tcmspw.com/tcmsp.php)中获得SRP中15种中药的活性成分,筛选条件为口服生物利用度(oral bioavailability,OB≥30%)且药物相似性(drug likeness,DL≥0.18)。对于TCMSP数据库中检索不到的中药,选择搜索CNKI及PubMed数据库其所含化学成分,最终确定SRP的活性成分集合。将得到的活性成分集合在TCMSP数据库中获得其靶点名,再通过蛋白质数据库UniPort(https://www.uniprot.org/)检索各靶点的靶基因ID,物种选择为homo sapiens。对于TCMSP数据库中检索不到的化学成分,可以在PubChem数据库中获得化学成分的SMILES,再利用SWISS数据库进行靶点预测,最终获得所有成分的预测靶点集合。
2.2.2 HN靶点的获取 在GeneCards数据库(https://www.genecards.org/)获取HN相关靶点,导出Excel的形式后标准化建立疾病靶点集合;然后利用微生信平台将SRP的活性成分靶点与疾病靶点进行Venn图的绘制,并得到潜在作用靶点。
2.2.3 SRP活性成分-HN疾病靶点网络的构建 根据各中药的活性成分与HN潜在作用靶点的相互作用关系构建属性文件和网络文件,导入Cytoscape 3.7.2软件构建SRP活性成分-HN的调控网络。
2.2.4 关键靶点的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建与分析 将获得的潜在作用靶点输入STRING数据库(https://cn. string-db.org/)中,物种选择为homo sapiens,获得蛋白互作分析,最低互作阈值设置为高可信,导出TSV格式后再利用Cytoscape 3.7.2软件构建SRP治疗HN作用靶点的PPI网络。
2.2.5 关键靶点京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路和基因本体(gene ontology,GO)功能富集分析 利用Metascape数据库(http://metascape.org/gp/index. html#/main/step1)对潜在作用靶点进行GO功能和KEGG通路富集分析,以<0.05为筛选标准,代表具有统计学意义。利用微生信平台绘制气泡图和柱状图。
2.2.6 关键靶点分子对接验证 根据筛选的活性成分和核心靶点,从PubChem数据库(https:// pubchem.ncbi.nlm.nih.gov/)中下载活性成分的2D结构并保存为SDF格式,利用Open Babel软件将SDF格式转换为MOL2格式,作为小分子配体。利用PDB数据库(https://www.rcsb.org/)将核心靶点的3D结构保存为PDB格式,再运用PyMol软件对靶蛋白进行预处理,产生活性口袋,采用AutoDockTools 1.2.6将活性成分与靶蛋白的活性口袋进行对接,验证其相互作用活性。
2.3 qRT-PCR法检测关键靶点mRNA表达
取“2.1.1”项下各组大鼠肾脏组织至预冷的研钵中,加液氮研磨成粉末,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。通过Primer Premier 5设计PCR扩增引物序列,白蛋白(albumin,)、肿瘤坏死因子-α(tumor necrosis factor-α,)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,)、信号传导与转录激活因子3(signal transducer and activator of transcription 3,)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,)引物序列见表1。
表1 引物序列
Table 1 Primer sequences
基因引物序列 (5’-3’) ALBF: CCAAGTGCTGTAGTGGGTCC R: GCCTTGGGCTTGTGTTTCAC TNF-αF: GGCGTGTTCATCCGTTCTCT R: CCCAGAGCCACAATTCCCTT PPARGF: GTGCCTTCGCTGATGCACT R: GCAGGCTCTACTTTGATCGC STAT3F: GACCGCGTCGGCTAGGA R: ATCCTGCCGCAATCAGGGG GAPDHF: GAAGGTCGGTGTGAACGGAT R: CCCATTTGATGTTAGCGGGAT
2.4 16S rDNA测序法检测肠道菌群的变化
末次给药后,收集“2.1.1”项下各组大鼠粪便,采用Zymo Research BIOMICS DNA微量制备试剂盒提取DNA,并使用0.8%琼脂糖电泳检测gDNA完整性,随后测定DNA浓度。用515F(5’-GTGYCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对样本的16S rDNA V3~4区域进行扩增,采用Zymoclean凝胶DNA回收试剂盒对PCR回收产物进行纯化,并使用Qubit@2.0 Fluorometer定量,用NEBNext Ultra Ⅱ DNA文库制备试剂盒构建DNA文库,最后采用Illumina HiSeq快速SBS试剂盒v2进行测序。下机后对数据进行处理,使用FLASH拼接双端序列,基于Barcode从raw reads中拆分出各样品序列,截去Barcode序列,并使用QIIME2进行质控。基于Deblur算法对序列进行序列降噪和嵌合体去除,生成ASV特征表和特征序列。使用基于朴素贝叶斯算法的分类器对SILVA数据库进行物种分类数据集的构建,并使用该数据集对ASV特征序列进行物种注释。使用QIIME2对特征序列进行多重比对,并使用其内置的FastTree插件构建进化树。最后进行群落组成分析、α多样性分析、β多样性分析、差异物种分析以及群落功能预测分析。
2.5 统计学分析
数据采用GraphPad Prism 8和SPSS 20.0软件进行统计分析,数据结果采用表示。组间差异采取单因素方差分析(One-way ANOVE)进行比较。肠道菌群测序数据的群落组成、α多样性、β多样性以及差异物种分析使用R语言4.0.5数据分析软件进行分析;使用QIIME2 2020.2进行数据质控、操作分类单元(operational taxonomic unit,OUT)聚类、物种注释和进化树构建。
3 结果
3.1 SRP对HN大鼠肾组织病理变化以及血清中UA、CREA和BUN水平的影响
如图1-A所示,与对照组比较,模型组大鼠肾小球细胞核数增多,肾小管间质损伤,肾小管扩张以及肾小管上皮细胞变形坏死。与模型组比较,各给药组均可改善肾间质损伤、肾小管扩张以及减少肾小管上皮细胞变性坏死的情况。如图1-B所示,与对照组比较,模型组大鼠血清中UA、CREA和BUN水平均显著升高(<0.05),表明HN模型构建成功;与模型组比较,各给药组大鼠血清中UA、CREA、BUN水平均显著降低(<0.05);SRP对HN大鼠血清中CREA和BUN水平的下调作用优于别嘌醇,表明SRP对由UA升高导致的肾功能损伤具有明显的改善作用,且疗效优于单一靶点的别嘌醇。
3.2 网络药理学研究
3.2.1 SRP活性成分的筛选 通过TCMSP数据库以及文献检索,搜索SRP中各药材成分,经过筛选最终得到121个有效成分,其中余甘子12个、安息香3个、决明子11个、诃子7个、乳香2个、木香4个、儿茶11个、黄葵子3个、巴夏嘎8个、藏菖蒲7个、宽筋藤16个、毛诃子22个、麝香4个、铁棒锤8个、渣驯膏3个。其中主要活性成分为山柰酚、儿茶素、槲皮素、木犀草素以及表没食子儿茶素没食子酸酯。

与对照组比较:#P<0.05;与模型组比较:*P<0.05
3.2.2 HN及SRP活性成分对应靶点收集 将得到的活性成分Canonical SMILES导入Swiss Target Prediction数据库以及PharmMapper数据库,最终得到SRP的作用靶点780个,在GeneCards数据库检索到HN的626个靶点。将疾病靶点与药物靶点取交集共得到147个交集靶点,见图2。
3.2.3 潜在靶点的网络构建 将SRP与HN的靶点交集后的文件导入Cytoscape 3.7.2,得到活性成分-靶点网络(图3),网络共有279个节点;度值较高成分为表没食子儿茶素没食子酸酯(MOL006821)、槲皮素(MOL000098)、木犀草素(MOL000006)、儿茶素(MOL000492)、山柰酚(MOL000422),这些活性成分可能是治疗HN的关键成分。
3.2.4 HN与SRP潜在靶点PPI网络的构建 将共同靶点导入STRING数据库,获得PPI网络图(图4-A)。其中节点表示靶点,节点间的连线表示靶点之间的关系。筛选度值靠前的靶点(图4-B),网络图含有77个靶点以及1582条相互关系,节点颜色越深,节点越大,代表度值越大,表明在整个图中生物学重要性越高;节点间连线的粗细代表节点间的联系,连线越粗代表结合分数越高,联系越密切。度值排名靠前的靶点分别为ALB、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,CASP3)、转录因子AP-1(transcription factor AP-1,JUN)、白细胞介素-6(interleukin-6,IL-6)、TNF、血管内表皮生长因子A(vascular endothelial growth factor A,VEGFA)、STAT3、IL-1β、肿瘤蛋白p53(tumor protein p53,TP53)和PPARG,这10个节点均高于平均自由度且度值较高,表明靶点在SRP治疗HN过程中起重要作用。

图2 SRP活性成分与HN靶点交集的韦恩图
3.2.5 SRP治疗HN靶点的GO功能富集分析 将SRP治疗HN的潜在靶点进行GO功能和KEGG通路富集分析,GO功能富集分析包括生物过程(biological processes,BP)、细胞成分(cellular components,CC)和分子功能(molecular functions,MF)3个方面。如图5所示,BP主要包括细胞对外来刺激的反应及对细菌来源分子的反应等;CC主要包括胞质囊泡、膜筏及树突等;MF主要包括转录因子结合、蛋白质结构域特异性结合及细胞因子受体结合。KEGG通路富集选取程度最高的前20条信号通路,主要作用于晚期糖基化终末化产物(advanced glycation end products,AGE)-晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)信号通路、细胞凋亡及核因子-κB(nuclear factor-κB,NF-κB)信号通路等。
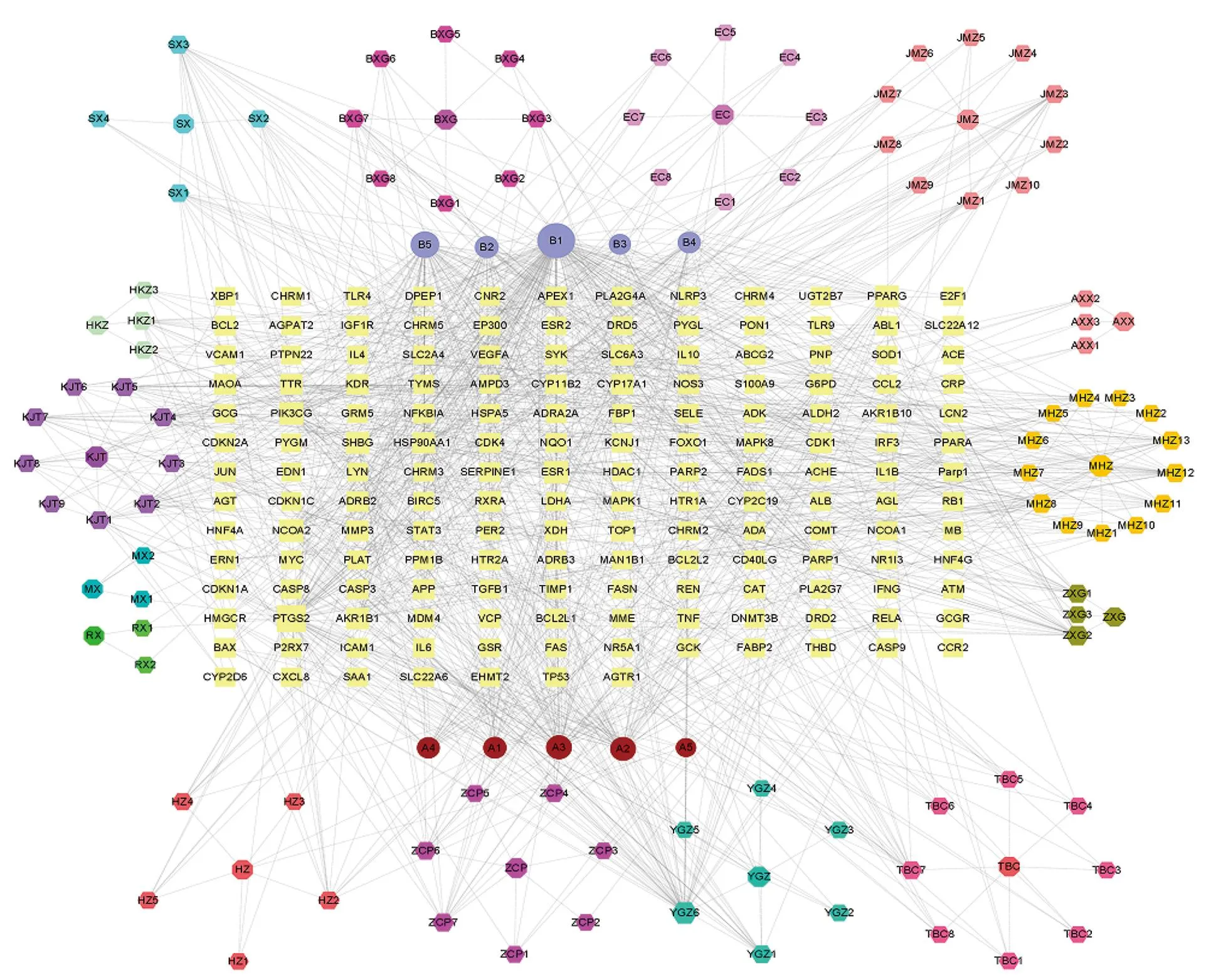
图3 SRP活性成分-靶点网络
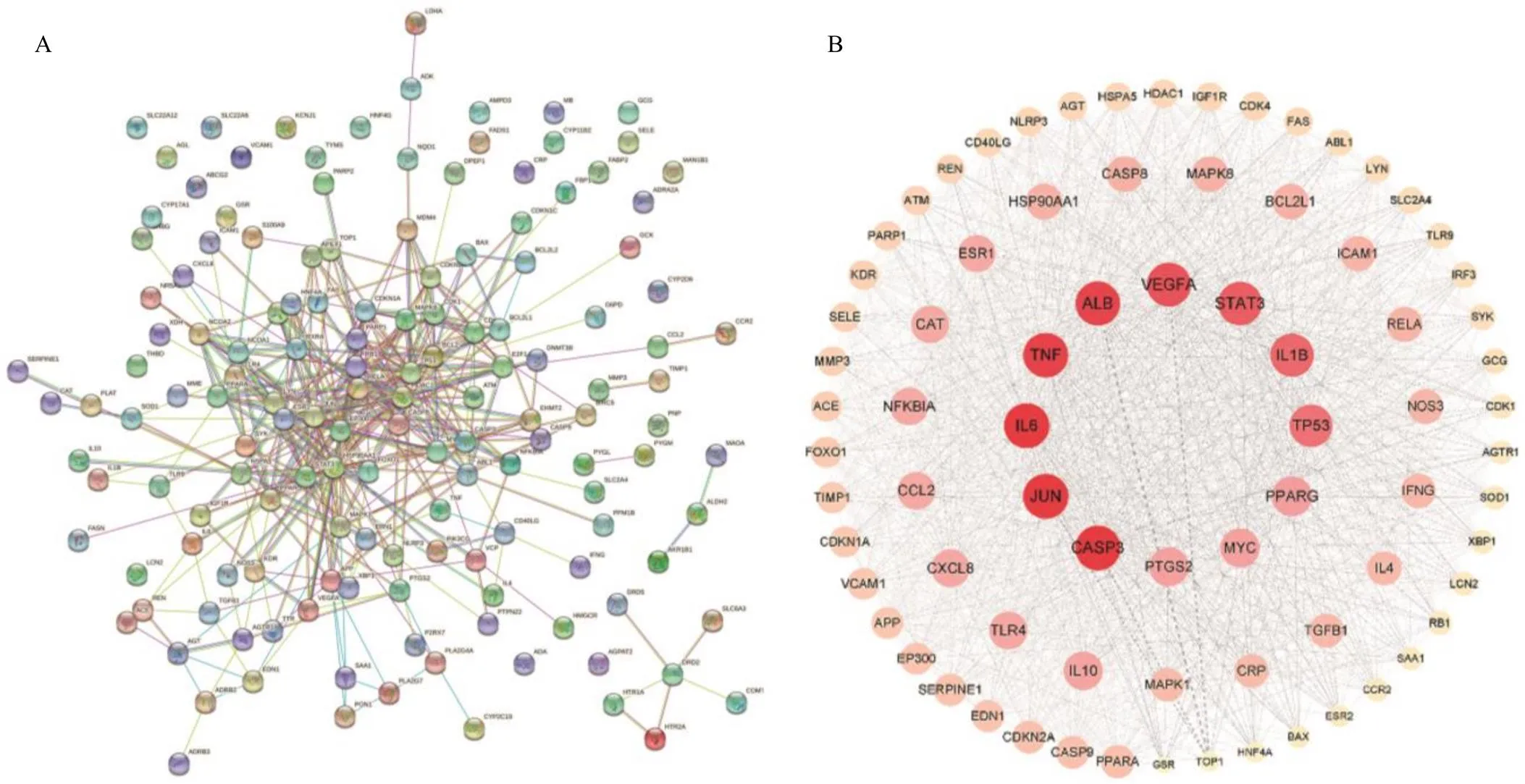
A-SRP治疗HN靶点的PPI网络 B-度值靠前的靶点PPI网络
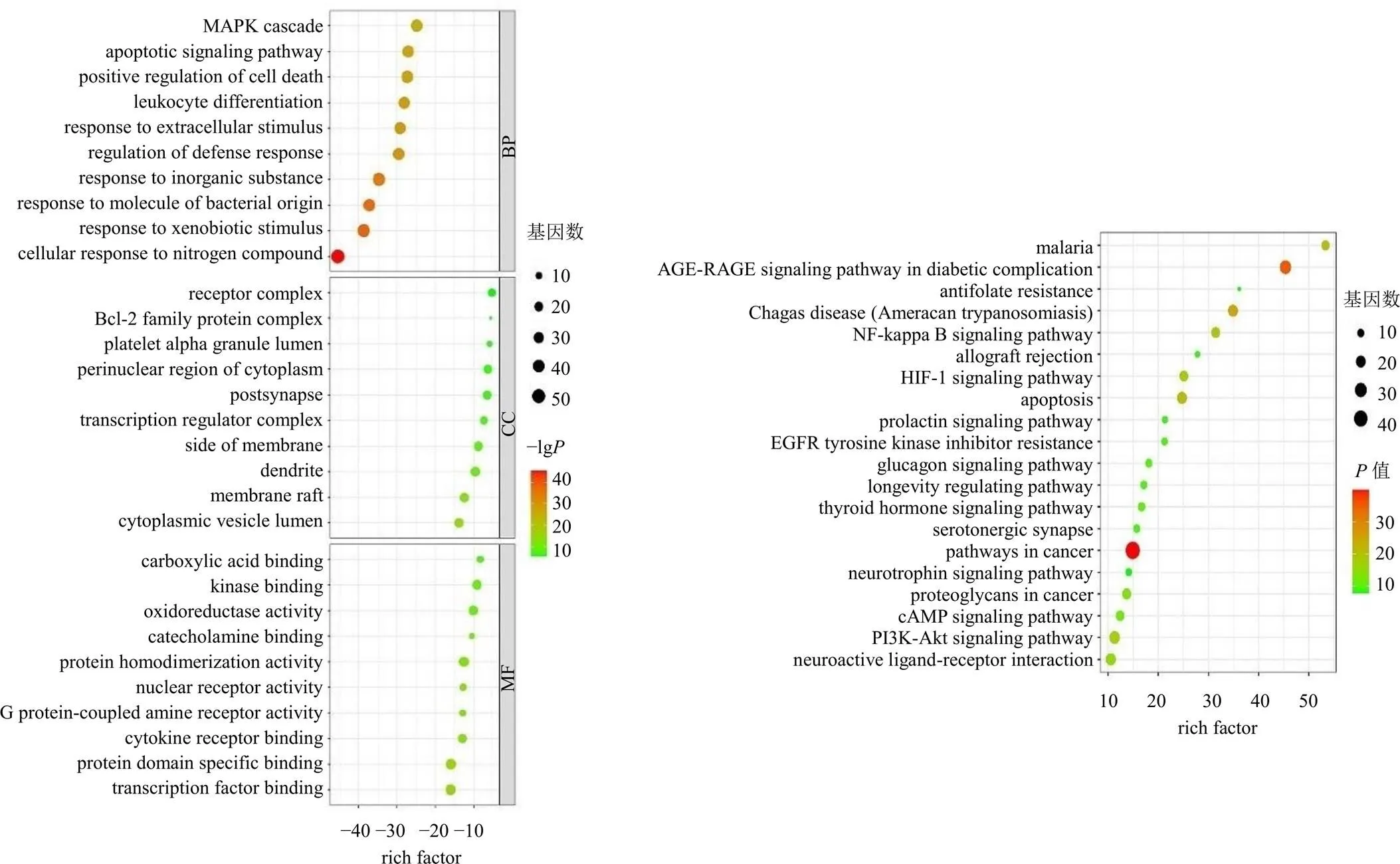
图5 GO功能及KEGG通路富集分析
3.3 分子对接研究
筛选网络中度值较高的成分与靶点,导入AutoDockTools 1.5.6得到分子对接结果。其中成分选取度值较高的表没食子儿茶素没食子酸酯、槲皮素、儿茶素、山柰酚以及木犀草素,靶点选取PPI网络中排名前10的靶点。其中ALB、TNF、PPARG、STAT3以及MYC与成分对接情况较好,对接结果以热图形式展示(图6)。部分对接结果可视化模式见图7。
3.4 SRP对HN大鼠肾组织中关键靶点mRNA表达的影响
HN常伴有炎症发生,其中、、以及均与肾损伤密切相关。如图8所示,与对照组比较,模型组大鼠肾组织中、及mRNA表达水平均显著升高(<0.05),mRNA表达水平显著降低(<0.05);与模型组比较,各给药组大鼠肾组织中、及mRNA表达水平均显著降低(<0.05),mRNA表达水平显著升高(<0.05)。表明SRP能够通过抑制炎症因子表达,从而改善HN大鼠的肾损伤。

图6 分子对接聚类分析
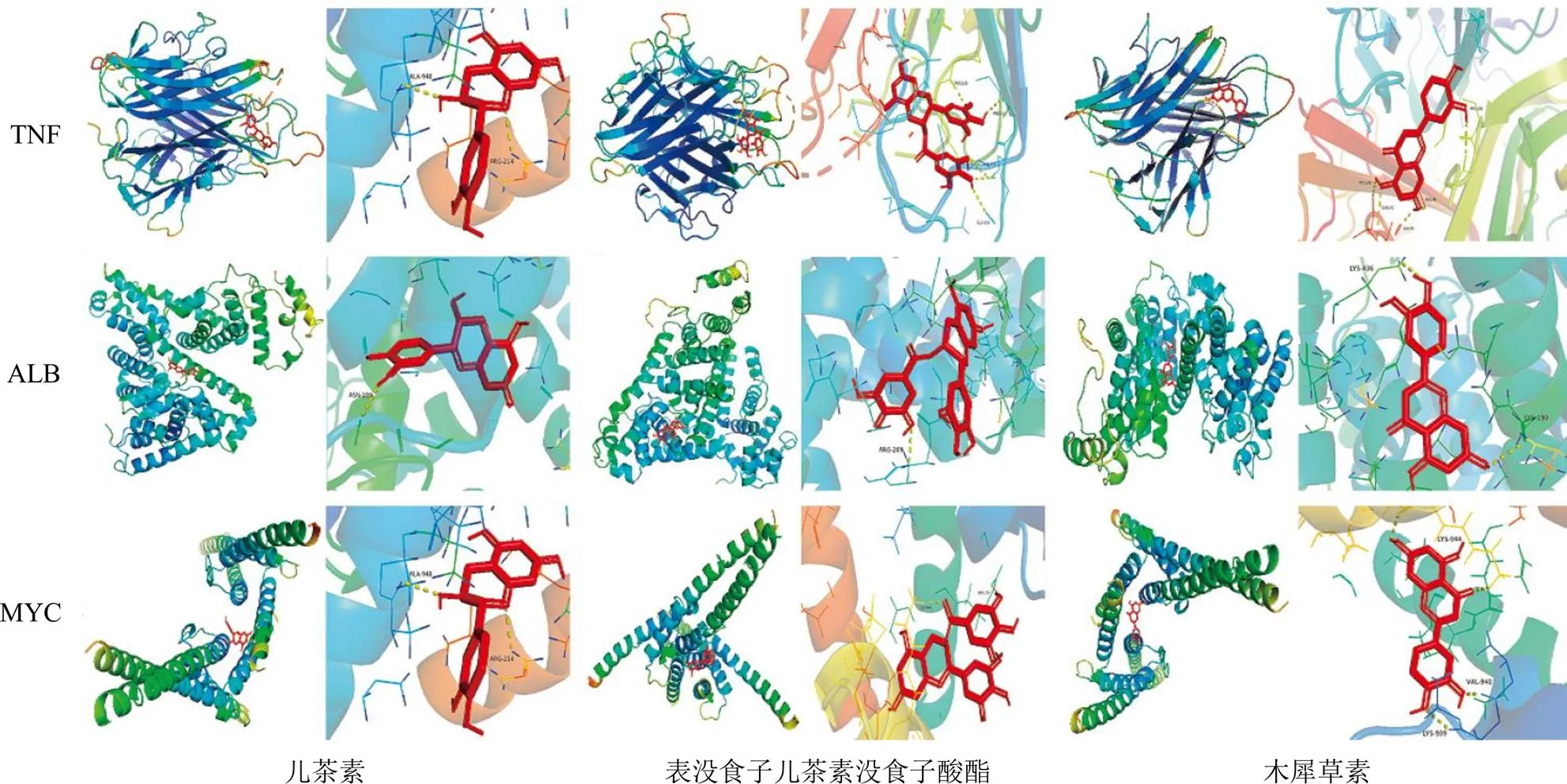
图7 SRP主要活性成分与关键靶点的分子对接

与对照组比较:#P<0.05;与模型组比较:*P<0.05
3.5 SRP对HN大鼠肠道菌群的影响
3.5.1 SRP对肠道菌群多样性的影响 采用α多样性分析法对各组大鼠肠道菌群物种多样性进行评价,其中包括Chao1、Shannon、PD和Simpson指数。Chao1指数用于估算物种总数,Shannon和Simpson指数说明物种多样性,PD指数是对进化树所有枝长求和,说明物种有无,进化差异度与数值呈正相关,数值越大,多样性越高。如图9所示,与对照组比较,模型组Chao1、PD、Simpson及Shannon指数均下降,说明HN大鼠肠道菌群的丰富度和多样性都有所下降;与模型组比较,给药组Chao1、PD、Shannon及Simpson指数总体上升,说明SRP可提高大鼠肠道菌群的丰富度和多样性。
为了探索样本物种丰富度随着测序深度的变化趋势,做稀释曲线(图10-A),当OTU数目<1300时,各样本稀释曲线趋向平坦,表明测序数据足够大,能够反映样本中绝大多数微生物的多样性信息。为了研究各样本中物种个体丰度与物种个体类型的变化关系,进行Rank-Abundance曲线分析(图10-B),Rank-Abundance曲线可用来解释多样性的2个方面,即物种丰度和物种均匀度。
β多样性分析是指对不同样本的微生物群落结构进行比较分析,本研究通过主成分分析(principal component analysis,PCA)和主坐标分析(principal co-ordinates analysis,PCoA)来研究群落组成的相似性或差异性。如图10-C、D所示,不同的颜色或点代表不同处理的样本,两样本点相距越近代表两样本组成越相似。对照组和模型组的样本明显分离,说明建立的HN大鼠模型的肠道菌群有明显的变化,且在SRP干预后,大鼠的肠道菌群分布情况有向对照组迁移的趋势,说明SRP对大鼠的肠道菌群的群落结构组成有一定的调节作用。

图9 各组大鼠肠道菌群α多样性分析(, n = 6)
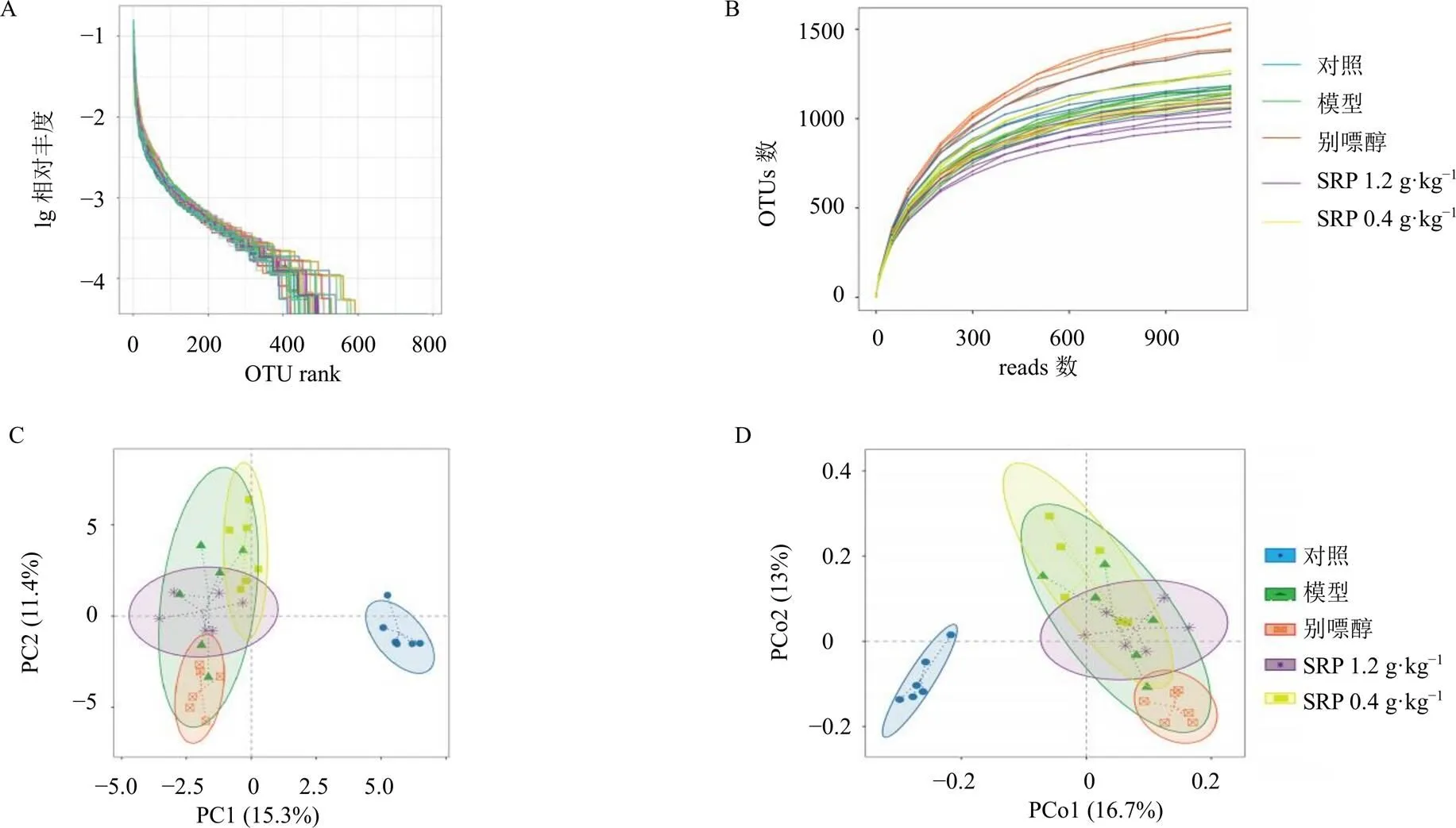
A-稀释曲线 B-Rank-Abundance曲线 C-PCA分析 D-PCoA分析
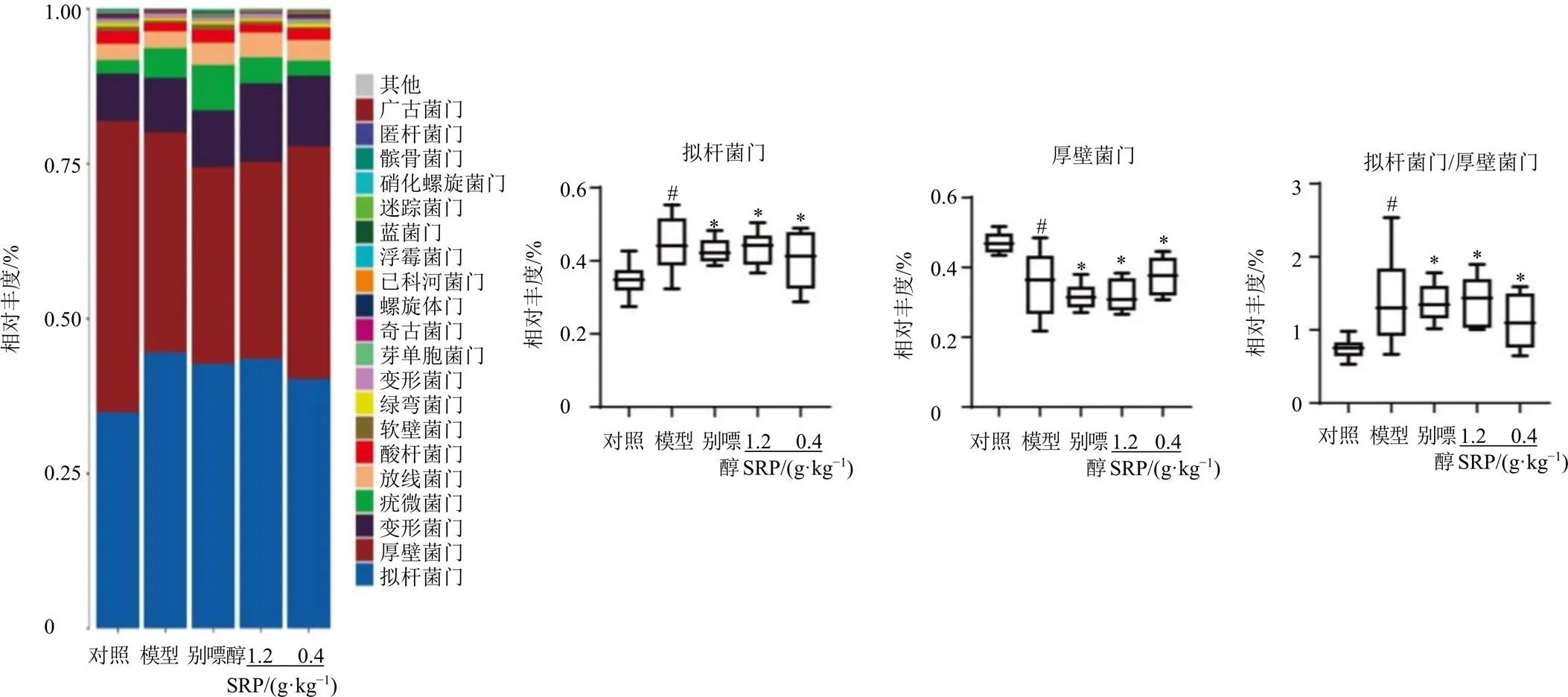
3.5.2 SRP对HN大鼠肠道菌群门水平的影响 如图11所示,大鼠肠道菌群门水平上主要以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)为主,其中还有少量的变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)。与对照组比较,模型组大鼠肠道中拟杆菌门相对丰度显著升高(<0.05),厚壁菌门相对丰度显著降低(<0.05),拟杆菌门与厚壁菌门的比值显著上升(<0.05);经过SRP干预后,拟杆菌门和厚壁菌门的相对丰度均有不同程度的恢复(<0.05)。表明SRP可以通过降低拟杆菌门的相对丰度、提高厚壁菌门的相对丰度以及降低拟杆菌门和厚壁菌门的比值来改善HN大鼠。
3.5.3 SRP对HN大鼠肠道菌群属水平上的影响 在属水平上,与HN相关的具有代表性的前6种肠道微生物分别为乳杆菌属拟杆菌属、阿克曼菌属、劳尔氏菌属、Prevotellaceae Ga6A1 group、Ruminococcaceae UCG-014。如图12所示,与对照组比较,模型组大鼠肠道中乳杆菌属及Ruminococcaceae UCG-014的相对丰度降低(<0.05),阿克曼菌属、劳尔氏菌属及Prevotellaceae Ga6A1 group的相对丰度升高(<0.05);经过SRP治疗后,乳杆菌属及Ruminococcaceae UCG-014的相对丰度总体上调(<0.05),阿克曼菌属、劳尔氏菌属及Prevotellaceae Ga6A1 group的相对丰度整体下降(<0.05)。表明SRP能够抑制阿克曼菌属、劳尔氏菌属及Prevotellaceae Ga6A1 group的生长,促进乳杆菌属及Ruminococcaceae UCG-014的增殖来改善HN大鼠。
与对照组比较:#P<0.05;与模型组比较:*P<0.05,图12同
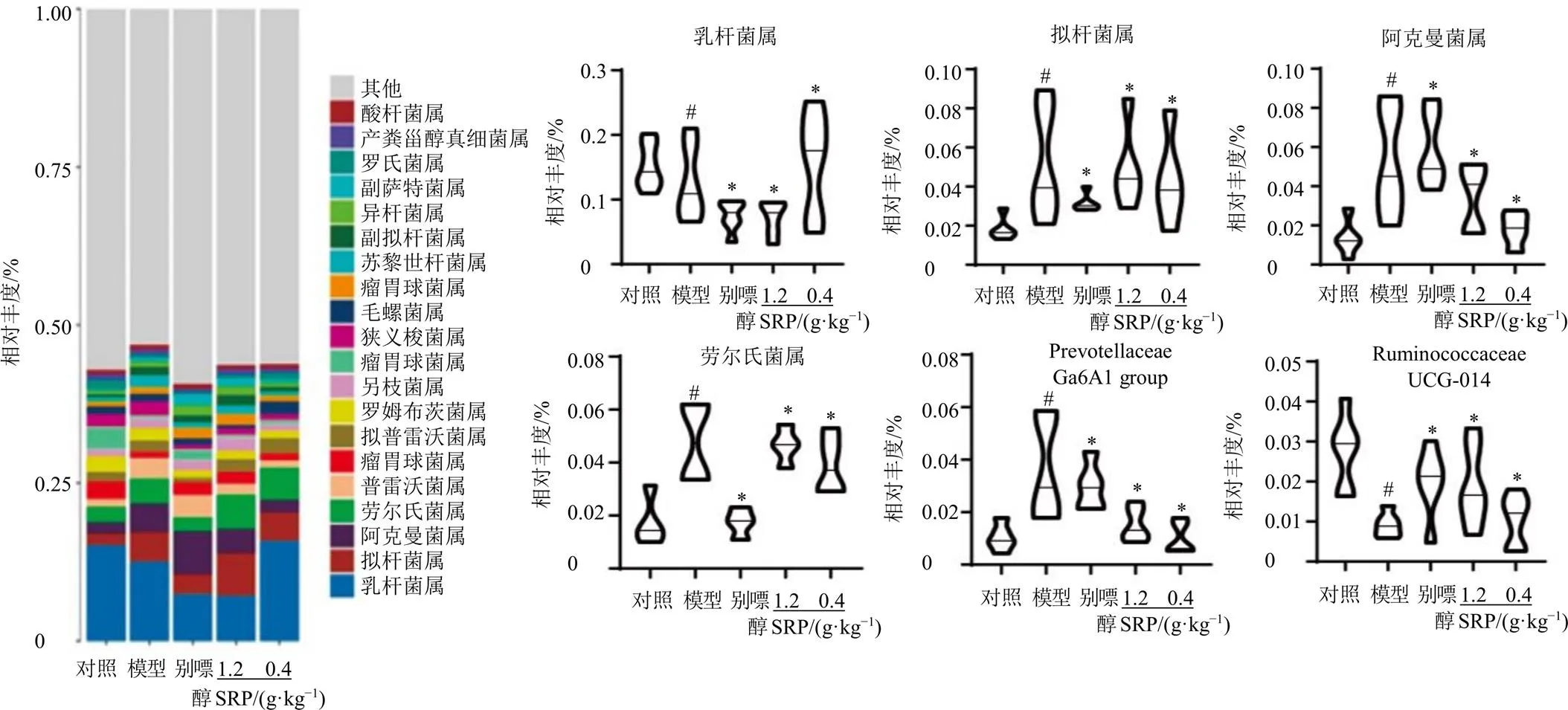
图12 SRP对HN大鼠肠道菌群属水平的影响(, n = 6)
3.5.4 SRP对HN大鼠肠道差异菌群的分析 为确定SRP治疗HN大鼠相关的肠道菌群,采用线性判别分析(linear discriminant analysis effect size,LEfSs)比较5组间肠道菌群。如图13所示,对照组显著差异的菌种有12中,主要为疣微菌目、阿克曼菌科、阿克曼菌属及疣微菌门等;模型组显著差异的菌种有16种,主要为厚壁菌门、乳杆菌科、乳杆菌目及乳杆菌等;别嘌醇组显著差异的菌种有3种,分别为布劳特氏菌属、梭菌科及梭状芽胞杆菌;SRP给药组差异显著的菌群有34种,主要为劳尔氏菌属、拟普雷沃氏菌属、鞘脂单胞菌科、拟杆菌属、拟杆菌科等。在Cladogram分析结果中,对照组与模型组差异显著,组间能明显分开,SRP给药组与对照组略有重叠。
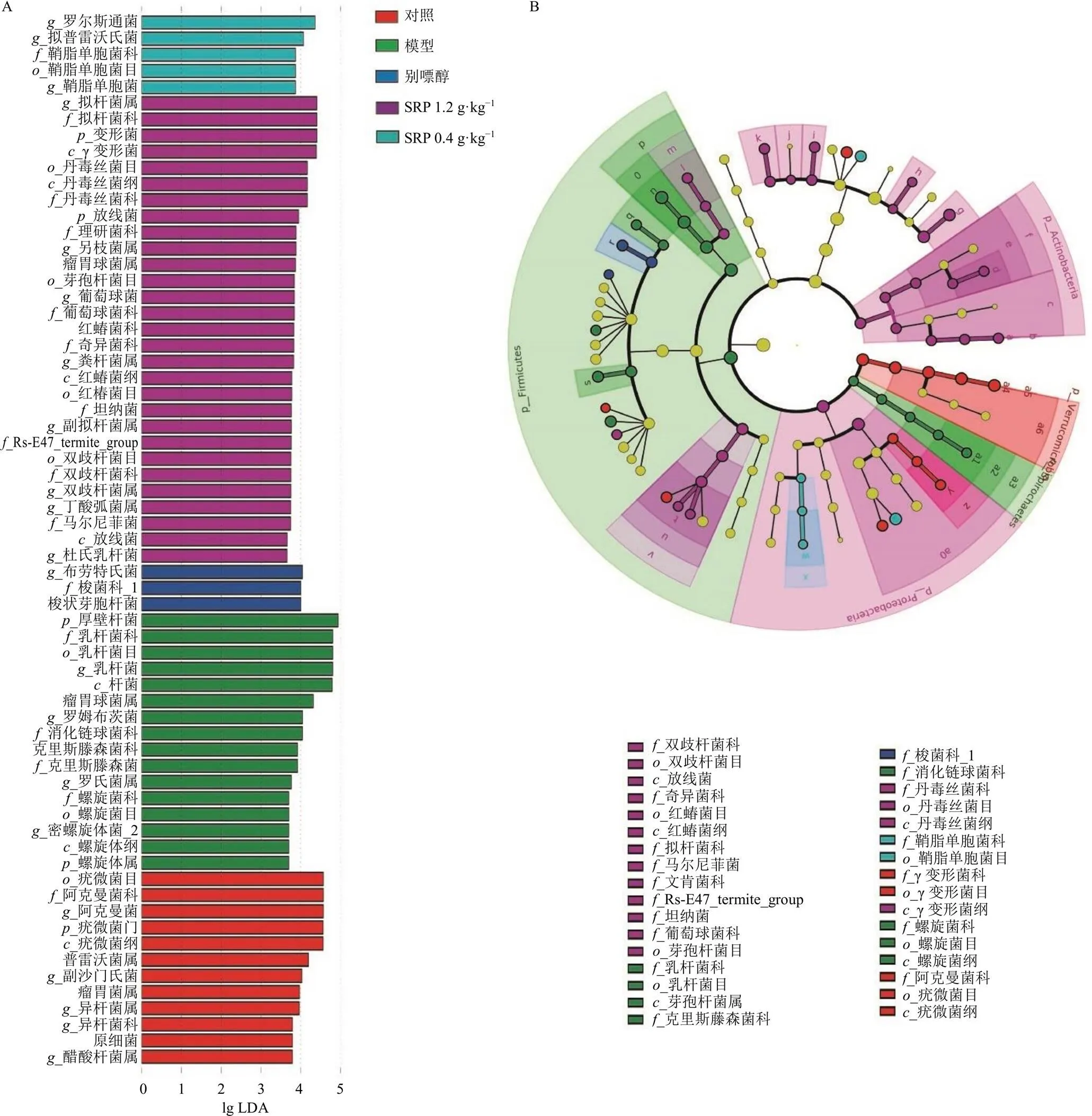
A-LDA值分布柱状图 B-物种分支进化图
4 讨论
藏医药治疗高尿酸血症的历史悠久、经验丰富。近年来,无数藏药进入大众的视野,大量国内外研究者也展开了对藏药的相关研究。已有多个藏药经典配方被证实有效,如二十五味儿茶丸、复方猫乳儿散以及七味罗堆多吉颗粒等。藏医对于高尿酸血症患者的治疗,遵照多数共性和个体差异化的原则,采取单方治疗、三果和三黄水药为核心药材的复方治疗及药浴联合放血治疗等,对于高尿酸血症患者的各个临床指标均有明显改善。近期,也有研究针对于藏药复方制剂抗高尿酸血症的药理作用机制,其主要涉及抑制UA合成、促进UA排泄和抑制炎症反应等。
SRP作为藏医经典名方,是藏医数千年流传下来的宝贵财富,其治疗痛风的作用已经过多年的临床验证。其可通过降低UA水平以及炎症指标,而改善患者痛风症状,但其作用机制尚不明确。因此本研究借助网络药理学、分子对接技术及肠道菌群分析SRP治疗HN的作用机制,再采用qRT-PCR验证,以期为藏药治疗HN提供方向和参考。
动物实验结果显示,SRP能改善HN大鼠肾脏病理变化,降低大鼠血清中UA、CREA及BUN水平,且SRP疗效优于阳性对照组别嘌醇,证明SRP抗HN具有多靶点的高效治疗作用。网络药理学共筛选出SRP中121个活性成分,疾病靶点与药物靶点交集后得到147个共同靶点。活性成分-靶点网络显示槲皮素、山柰酚、表没食子儿茶素没食子酸酯、木犀草素、儿茶素能对接更多的靶点,是SRP主要的活性成分。研究表明,木犀草素[8-9]和槲皮素[10-11]能够通过降低黄嘌呤氧化酶活性而减少UA合成,并能抑制炎性细胞因子而减轻炎症反应的产生。槲皮素能显著改善胸腺和脾脏等免疫器官的功能[12];通过提高Toll交互蛋白的表达从而抑制NF-κB的表达,而发挥保护肾脏功能[13-14]。木犀草素被认为在肾病治疗中具有较大潜力的有效成分,有研究表明,木犀草素能够通过上调核转录因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2),减弱活性氧(reactive oxygen species,ROS),促进抗氧化蛋白及酶的释放,下调Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,Myd88)/NF-κB通路,并减缓氧化应激损伤,发挥抗炎作用[15]。儿茶素是绿茶中的一组多酚,研究发现大鼠的肾脏切除5/6后使用儿茶素,使大鼠的肾脏微血管密度减小的程度得到抑制,且还可以延缓肾小球硬化和肾间质纤维化的进程,从而起到保护肾脏作用[16]。在肾病中,山柰酚在底物与黄嘌呤氧化酶结合之前,到达结合位点与黄嘌呤氧化酶结合,从而发挥抑制黄嘌呤氧化酶活性[17];且山柰酚能有效抑制肾病大鼠细胞凋亡和肾组织炎症反应,改善肾功能[18]。表没食子儿茶素没食子酸酯是茶叶中的主要活性成分之一,是一种强效的抗氧化剂和活性氧清除剂,具有强大的抗炎作用[19]。肾损伤大鼠给予表没食子儿茶素没食子酸酯干预后,血清中BUN、CREA和炎性因子水平均降低,说明表没食子儿茶素没食子酸酯能够抑制炎性因子表达,从而保护肾脏[20]。以上研究表明,SRP的主要活性成分通过增强UA排泄、抑制UA合成和抵抗炎症反应发挥治疗HN的作用,且优势明显。
本研究结果显示,SRP治疗HN的主要潜在靶点为TNF、ALB、MYC、PPARG及STAT3。这5个潜在靶点与主要活性成分的分子对接结果显示出较高的结合能,从而进一步验证了本研究预测结果的可靠性。ALB是一种非急性时相蛋白,在疾病急性期时会减少。有研究表明,痛风患者血清中ALB水平显著降低[21]。TNF-α可由巨噬细胞分泌,参与免疫反应和炎症反应各个阶段,有研究表明肾脏损伤程度与TNF-α水平呈正相关[22]。TNF-α作为前炎症细胞因子,可加重中性粒细胞炎症反应,迅速放大炎症反应,是肾脏炎症的产生和持续的关键因子[23-24]。TNF抑制剂不仅能改善炎症反应,还可以辅助降UA治疗[25]。PPARG是一种过氧化物酶体增殖受体,具有调节炎症的作用[26]。PPARG激动剂可通过增加肾病大鼠外周组织的血管生成素样蛋白4的表达来减少蛋白尿的产生,从而保护肾脏[27]。MYC是一种多功能的转录因子,可以调控细胞生长、增殖和凋亡等生物过程中的许多基因[28]。此外,MYC可参与分泌型糖蛋白/β-链蛋白(Wnt/β-catenin)和磷脂酰肌醇3-激酶/蛋白激酶B(phosphoinositide-3 kinase/protein kinase B,PI3K/ Akt)通路,与肾病的发病有关[29]。STAT3是信号转导和转录激活因子,活化的STAT3在机体免疫反应、修复损伤等多种生理病理过程中发挥着重要的作用[30]。IL-6可以活化STAT3,并诱导多种炎性因子表达,从而促进炎症反应[31-32]。
GO功能和KEGG通路富集分析结果显示,SRP可能通过作用于NK-κB信号通路、AGE-RAGE信号通路、HIF-1信号通路以及癌症信号通路对氮化合物、外来刺激及细菌来源分子产生反应,并且通过靶向转录因子结合、蛋白质结构域特异性结合以及细胞因子受体结合对ALB、PPARG、MYC、STAT3及TNF等靶点进行调控,而发挥抑制炎症反应、调节UA合成代谢及改善肾脏损伤的作用。AGE-RAGE信号通路与炎症的发生密切相关,可通过提高丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)磷酸化水平,而促进TNF-α、IL-1及IL-6等炎性因子的表达[33]。肾脏对于缺氧环境非常敏感,而以小管间质病变为主的肾脏疾病会由于水肿以及炎症等反应导致局部血和氧的运输[34]。大多数慢性肾病都存在进行性纤维化以及肾脏微血管丢失导致的局部缺氧缺血,小鼠肝纤维化模型中检测到缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)表达,且其表达量与肾间质纤维化程度有关[35-36]。qRT-PCR结果显示,SRP能够显著降低HN大鼠肾组织中α、、等炎症因子表达,且优于别嘌醇,说明SRP在治疗高尿酸血症大鼠中主要发挥抗炎、减少渗出等作用,且基本能恢复到正常水平,更进一步说明SRP治疗高尿酸血症肾病的多靶向高效性。
肠道菌群的紊乱通常表现在肠道微生物菌群多样性的改变以及群落结构组成的变化。在门水平上,SRP可以降低拟杆菌门的相对丰度、提高厚壁菌门的相对丰度以及降低拟杆菌门和厚壁菌门比值[37]。研究表明,拟杆菌等细菌与UA水平呈正相关,且拟杆菌能够产生血清及盲肠内毒素,进而引发全身慢性低度炎症反应[38]。厚壁菌门可以产生丁酸,且直肠给予丁酸可以有效改善体内UA代谢[39-40]。乳杆菌是肠道中重要的有益菌,患有高尿酸血症会导致乳杆菌等有益菌群数量减少,因此一些特征菌属可作为高尿酸血症的靶微生物[41]。本研究结果显示,SRP能够上调乳杆菌的相对丰度,因此乳杆菌可能是SRP的靶细菌之一。阿克曼菌与肠上皮细胞的黏蛋白以及倡导屏障有关,并且其代谢物能够通过降低肠道通透性从而调节免疫[42]。由此可见,SRP能够提高粪便中丁酸的含量,并富集产生短链脂肪酸的有益菌群。
高尿酸血症引起肾脏损伤与肠道菌群的变化有关[43-44]。肠道菌群通过参与体内蛋白质、膳食纤维等营养物质的代谢,能够产生氧化三甲胺(trimethylamine-oxide,TMAO)等代谢物影响HN的发展。TMAO能通过上调巨噬细胞清道夫受体,促进血管斑块的形成,释放炎症因子,导致血管炎症反应,而加重肾脏损伤[45-46]。巨噬细胞上的内源性G蛋白偶联受体5(G protein coupled receptor 5,TGR5)参与炎症反应中的许多重要过程,如NF-κB信号通路。胆汁酸(bile acids,BAs)是TGR5的配体且也是肠道菌群的主要产物。TGR5受体被激活后还会抑制NF-κB抑制蛋白(inhibitor of NF-κB,IκB)激酶的磷酸化,降低NF-κB的活性,从而影响巨噬细胞的炎症反应[47]。短链脂肪酸具有增强肠道屏障以及抑制肠道炎症的功能,丁酸作为短链脂肪酸的一种,可以通过减少IL-1β的合成与释放,有效减轻炎症反应[48]。另有研究表明,丁酸可以通过调节NF-κB信号通路、AGE-RAGE信号通路等炎症通路的活性,抑制炎症因子的释放[49-50]。以上结果表明肠道菌群通过作用于NF-κB信号通路以及AGE-RAGE信号通路等产生炎性因子,从而影响HN的发生发展。根据网络药理学结果分析发现,SRP治疗HN的靶点所富集的通路与肠道菌群影响肾病的通路NF-κB和AGE-RAGE一致,所涉及的靶点主要有炎性蛋白如ALB、TNF及PPARG等。表明SRP可能通过调节NF-κB通路以及AGE-RAGE通路来影响体内炎性因子的合成与释放,从而改善由肠道菌群失调所导致的HN。
综上所述,本研究通过网络药理学、分子对接技术及肠道菌群,探讨了SRP治疗HN的作用机制,并找出其可能的潜在靶点,利用动物实验验证了该靶点,体现了SRP具有多组分、多靶点和多途径的特点,为SRP治疗HN提供了依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Strilchuk L, Fogacci F, Cicero A F. Safety and tolerability of available urate-lowering drugs: A critical review [J]., 2019, 18(4): 261-271.
[2] Wang J, Chen Y, Zhong H,. The gut microbiota as a target to control hyperuricemia pathogenesis: Potential mechanisms and therapeutic strategies [J]., 2022, 62(14): 3979-3989.
[3] 寇毅英, 李永芳, 杨梅, 等. 十五味乳鹏散对尿酸钠致大鼠急性痛风性膝关节炎COX-2, PGE2水平的影响 [J]. 中国实验方剂学杂志, 2016, 22(1): 117-120.
[4] Kou Y Y, Li Y F, Ma H S,. Uric acid lowering effect of Tibetan Medicine RuPeng15 powder in animal models of hyperuricemia [J]., 2016, 36(2): 205-210.
[5] Kou Y Y, Li Y F, Xu M,. Effects of RuPeng15 powder (RPP15) on monosodium urate crystal-induced gouty arthritis in rats [J]., 2015, 2015: 527019.
[6] 黄亚敏, 陈旅翼. 三种藏药十五味乳鹏丸、十味乳香散与五味麝香丸抗痛风作用研究 [J]. 绿色科技, 2017(16): 195-197.
[7] 拉青才让. 藏药十五味乳鹏丸等治疗类风湿关节炎100例疗效观察 [J]. 医学文选, 2003(6): 900-901.
[8] Ren J Y, Liao L F, Shang S M,. Purification, characterization, and bioactivities of polyphenols from(L.) Franco [J]., 2019, 84(3): 667-677.
[9] Lin Y, Liu P G, Liang W Q,. Luteolin-4′--glucoside and its aglycone, two major flavones ofD. Don, resist hyperuricemia and acute gouty arthritis activity in animal models [J]., 2018, 41: 54-61.
[10] Wu Z Y, Zhang H, Li F,. Evaluation of xanthine oxidase inhibitory activity of flavonoids by an online capillary electrophoresis-based immobilized enzyme microreactor [J]., 2020, 41(15): 1326-1332.
[11] Rahmi E P, Kumolosasi E, Jalil J,. Anti-hyperuricemic and anti-inflammatory effects ofas potential treatment for gout [J]., 2020, 11: 289.
[12] 叶清. 植物槲皮素对东方田鼠免疫功能的影响 [D]. 吉首: 吉首大学, 2018.
[13] Byun E B, Yang M S, Choi H G,. Quercetin negatively regulates TLR4 signaling induced by lipopolysaccharide through Tollip expression [J]., 2013, 431(4): 698-705.
[14] Lee K W, Kang N J, Heo Y S,. Raf and MEK protein kinases are direct molecular targets for the chemopreventive effect of quercetin, a major flavonol in red wine [J]., 2008, 68(3): 946-955.
[15] 赵家玲. 木犀草素激活Nrf2途径对高糖环境下肾脏系膜细胞的保护作用 [D]. 南京: 南京中医药大学, 2014.
[16] 曹艳, 何小解, 向伟, 等. 儿茶素对5/6肾切除大鼠肾脏微血管的保护作用及其机制 [J]. 中西医结合学报, 2009, 7(6): 557-562.
[17] Wang Y J, Zhang G W, Pan J H,. Novel insights into the inhibitory mechanism of kaempferol on xanthine oxidase [J]., 2015, 63(2): 526-534.
[18] 焦晓翠. Sirt3对糖尿病肾小管氧化损伤的影响及分子机制的研究 [D]. 石家庄: 河北医科大学, 2017.
[19] Guo R, Zhou F M, Su C J,. Epigallocatechin-3-gallate attenuates acute and chronic psoriatic itch in mice: Involvement of antioxidant, anti-inflammatory effects and suppression of ERK and Akt signaling pathways [J]., 2018, 496(4): 1062-1068.
[20] 李木子, 陈克研, 孙倩, 等. TLR4/Myd88/NF-κB通路介导表没食子儿茶素没食子酸酯对脓毒血症大鼠急性肾损伤的保护作用 [J]. 中国医科大学学报, 2019, 48(2): 109-113.
[21] 覃柳群, 石祥, 李文朝, 等. 血清前白蛋白水平与痛风疾病活动的相关性分析 [J]. 广西医科大学学报, 2019, 36(1): 87-90.
[22] 危正南, 李涛, 张庆红, 等. MIF、TLR4、TNF-α水平在糖尿病肾病患者中的变化及其临床意义 [J]. 疑难病杂志, 2016, 15(2): 165-168.
[23] Nakae S, Lunderius C, Ho L H,. TNF can contribute to multiple features of ovalbumin-induced allergic inflammation of the airways in mice [J]., 2007, 119(3): 680-686.
[24] Wilson S J, Wallin A, Della-Cioppa G,. Effects of budesonide and formoterol on NF-kappaB, adhesion molecules, and cytokines in asthma [J]., 2001, 164(6): 1047-1052.
[25] Zhang Y, Pan R Z, Xu Y,. Treatment of refractory gout with TNF-α antagonist etanercept combined with febuxostat [J]., 2020, 9(6): 4332-4338.
[26] Young S G, Davies B S, Fong L G,. GPIHBP1: An endothelial cell molecule important for the lipolytic processing of chylomicrons [J]., 2007, 18(4): 389-396.
[27] 吴艺芳. PPARγ激动剂对肾病大鼠血清和肾组织ANGPTL4以及尿蛋白排泄的影响 [D]. 福州: 福建医科大学, 2018.
[28] Bretones G, Delgado M D, León J. Myc and cell cycle control [J]., 2015, 1849(5): 506-516.
[29] Cox S N, Pesce F, El-Sayed Moustafa J S,. Multiple rare genetic variants co-segregating with familial IgA nephropathy all act within a single immune-related network [J]., 2017, 281(2): 189-205.
[30] Forbes L R, Milner J, Haddad E. Signal transducer and activator of transcription 3: A year in review [J]., 2016, 23(1): 23-27.
[31] 陈海云. 负调节因子SOCS1和SOCS3的表达对Stat3信号分子活化的影响及其在胃癌预后中的意义 [D]. 石河子: 石河子大学, 2014.
[32] Zhong Z, Wen Z, Darnell J E Jr. Stat3: A STAT family member activated by tyrosine phosphorylation in response to epidermal growth factor and interleukin-6 [J]., 1994, 264(5155): 95-98.
[33] Haugen J, Chandyo R K, Brokstad K A,. Cytokine concentrations in plasma from children with severe and non-severe community acquired pneumonia [J]., 2015, 10(9): e0138978.
[34] Fine L G, Bandyopadhay D, Norman J T. Is there a common mechanism for the progression of different types of renal diseases other than proteinuria? Towards the unifying theme of chronic hypoxia [J]., 2000, 75: S22-S26.
[35] Higgins D F, Kimura K, Bernhardt W M,. Hypoxia promotes fibrogenesisvia HIF-1 stimulation of epithelial-to-mesenchymal transition [J]., 2007, 117(12): 3810-3820.
[36] Kimura K, Iwano M, Higgins D F,. Stable expression of HIF-1alpha in tubular epithelial cells promotes interstitial fibrosis [J]., 2008, 295(4): F1023-F1029.
[37] Yu Y R, Liu Q P, Li H C,. Alterations of the gut microbiome associated with the treatment of hyperuricaemia in male rats [J]., 2018, 9: 2233.
[38] 耿琳, 闫朝丽. 肠道菌群与2型糖尿病的相关性研究进展 [J]. 医学综述, 2019, 25(10): 2034-2038.
[39] Parada Venegas D, de la Fuente M K, Landskron G,. Short chain fatty acids (SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases [J]., 2019, 10: 277.
[40] Hamer H M, Jonkers D M, Bast A,. Butyrate modulates oxidative stress in the colonic mucosa of healthy humans [J]., 2009, 28(1): 88-93.
[41] Xing S C, Meng D M, Chen Y,. Study on the diversity ofandin patients with primary gout [J]., 2015, 71(2): 707-715.
[42] Everard A, Belzer C, Geurts L,. Cross-talk betweenand intestinal epithelium controls diet-induced obesity [J]., 2013, 110(22): 9066-9071.
[43] Xiao J, Zhang X L, Fu C S,. Impaired Na+-K+-ATPase signaling in renal proximal tubule contributes to hyperuricemia-induced renal tubular injury [J]., 2018, 50(3): e452.
[44] Guo Y J, Li H L, Liu Z,. Impaired intestinal barrier function in a mouse model of hyperuricemia [J]., 2019, 20(4): 3292-3300.
[45] Zhu W F, Gregory J C, Org E,. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk [J]., 2016, 165(1): 111-124.
[46] Liu J F, Lai L Y, Lin J J,. Ranitidine and finasteride inhibit the synthesis and release of trimethylamine-oxide and mitigates its cardiovascular and renal damage through modulating gut microbiota [J]., 2020, 16(5): 790-802.
[47] Pols T W H. TGR5 in inflammation and cardiovascular disease [J]., 2014, 42(2): 244-249.
[48] Cleophas M C P, Crişan T O, Lemmers H,. Suppression of monosodium urate crystal-induced cytokine production by butyrate is mediated by the inhibition of class I histone deacetylases [J]., 2016, 75(3): 593-600.
[49] 张锦涛, 伊曼, 李志嘉, 等. 丁酸盐在炎症反应中作用机制的研究进展 [J]. 免疫学杂志, 2015, 31(12): 1101-1104.
[50] Kaur H, Das C, Mande S S.analysis of putrefaction pathways in bacteria and its implication in colorectal cancer [J]., 2017, 8: 2166.
Mechanism of Tibetan medicine Shiwuwei Rupeng Pills on hyperuricemia nephropathy based on intestinal flora and systematic pharmacology
XIE Hao-chen1, ZHANG Bo-heng2, Mukaram Amatjan2, LI Na2, HE Peng-ke2, YAN Heng-xiu2, SHAO Xiao-ni2
1. Institute of Qinghai-Tibetan Plateau, Southwest Minzu University, Chengdu 610041, China 2. College of Pharmacy, Southwest Minzu University, Chengdu 610041, China
To explore the mechanism of Tibetan medicine Shiwuwei Rupeng Pills (十五味乳鹏丸, SRP) on hyperuricemic nephropathy (HN) from multiple dimensions based on intestinal flora, network pharmacology and molecular docking technology.HN rats model was established by adenine combined with ethambutol, and rats were divided into control group, model group, allopurinol (50 mg/kg) group, SRP high-and low-dose (1.2, 0.4 g/kg) groups. After continuous administration for 14 d, levels of uric acid (UA), creatinine (CREA) and urea nitrogen (BUN) in serum of rats were detected; Pathological changes of kidney tissue was observed by hematoxylin-eosin (HE) staining. SRP and HN core targets were obtained, “drug-active ingredient-targets” and protein-protein interaction (PPI) networks were constructed, gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis on potential targets were performed; Molecular docking technology was used to simulate the binding activity of key components and core targets. qRT-PCR was used to verify the mRNA expression of key targets in kidney tissue of rats in each group; Rat feces were collected, and 16S rDNA high-throughput sequencing was used to detect changes in intestinal flora.SRP significantly decreased the levels of UA, CREA and BUN in serum of HN rats (< 0.05), ameliorated the pathological damage of renal tissue. SRP played an anti-HN role by acting on advanced glycation end products (AGE)-receptor for advanced glycation end products (RAGE), interleukin-17 (IL-17), tumor necrosis factor (TNF) and other signaling pathways. Albumin (ALB), TNF, peroxisome proliferator-activated receptor gamma (PPARG), signal transducer and activator of transcription 3 (STAT3) and bone marrow Myelocytomatosis viral oncogene (MYC) had good docking activity with luteolin, quercetin, kaempferol, epigallocatechin gallate and catechin. SRP significantly down-regulated the mRNA expression levels of,andin kidney tissue of HN rats (< 0.05), and significantly up-regulated the expression level ofmRNA (< 0.05). Compared with model group, SRP significantly increased the richness and diversity of intestinal flora, and decreased the proportions of bacteroidetes and firmicutes at phylum level; mainly decreased,,andGa6A1 group, increased the relative abundance ofand Ruminococcaceae UCG-014.SRP can exert anti-HN effect by regulating the structure of intestinal flora, regulating expression of AGE-RAGE, IL-17, TNF and other signaling pathways related targets, and has the characteristics of multi-component, multi-target and multi-pathway treatment.
Shiwuwei Rupeng Pills; hyperuricemia nephropathy; intestinal flora; network pharmacology; molecular docking; tumor necrosis factor; peroxisome proliferator-activated receptor gamma; albumin; signal transducer and activator of transcription 3
R285.5
A
0253 - 2670(2022)19 - 6068 - 15
10.7501/j.issn.0253-2670.2022.19.013
2022-06-15
国家自然科学基金青年基金项目(81801086);四川省自然科学基金资助项目(2022NSFSC1574);四川省科技厅应用基础项目(2021YJ0256)
谢昊宸,男,硕士研究生,研究方向为中药药理学。E-mail: 1024400780@qq.com
邵晓妮,女,博士,研究方向为中药药理学。E-mail: xnshao@swun.edu.cn
[责任编辑 李亚楠]
