毛红椿AFLP体系优化及引物筛选
2022-10-13潘蓉蓉钟秋蔚马际凯程强强袁生贵孙荣喜
潘蓉蓉,钟秋蔚,张 露,马际凯,程强强,袁生贵,孙荣喜
(江西省森林培育重点实验室;江西特色林木资源培育与利用2011协同创新中心;江西农业大学·林学院,江西 南昌 330045)
毛红椿(Toona ciliata var.pubescens)是楝科(Meliaceae)香椿属(Toona)落叶高大乔木,主干通直圆满,材性优良,是我国珍贵速生用材树种,为国家二级保护植物。由于毛红椿天然更新缓慢,人为干扰严重,导致毛红椿分布区不断缩小,呈间断分布,目前极难见到成片分布的林分[1]。前人对毛红椿苗期性状[2]、人工造林[3]、家系选择[4]、药用价值[5]等开展过大量研究,在遗传机理方面研究相对较少。毛红椿现有种群多以无性繁殖为主,遗传多样性较低,现已开发的SSR引物难以揭示小种群内可能存在的遗传学风险[6-7],且已知毛红椿基因组序列信息有限,开发SSR引物存在一定困难。
目前一些多态性低或特定品种的遗传研究,比如连锁图谱的构建[8],近缘物种的划分[9],山白树(Sinowilsonia fienryi)[10]、羽叶丁香(Syringa pinnatifolia)[11]、青檀(Pteroceltis tatarinowii)[12]、凤凰单丛古茶树(Camellia sinensis)[13]和珙桐(Davidia involucrata)[14]等珍稀濒危植物均以AFLP(amplified fragment length polymorphism)开展亲缘关系和遗传多样性研究,并且利用AFLP对非模式生物基因组捕获,创建一种通用的系统发育分析方法[15]。该研究拟对毛红椿AFLP所需模板的制备、产物稀释倍数及引物的筛选进行探索,优化毛红椿AFLP体系,筛选出多态性引物,为该物种保护和遗传多样性研究提供支撑。
1 材料与方法
1.1 试验材料
试验材料选自江西九连山国家级自然保护区(24°36′N,114°30′E)天然林内的毛红椿植株,共采集41株健康树的幼嫩叶片,硅胶干燥带回实验室提取DNA。其中37株毛红椿的叶片来自润洞毛红椿居群(R1-R37),其他4株分别采自二级站毛红椿居群(R110)、横坑水毛红椿居群(H14)、虾公塘毛红椿居群(R319)和大丘田毛红椿居群(D62)。
引物由生工生物工程(上海)股份有限公司合成(表1)。EcoR I、Mse I内切酶购于NEB公司,T4连接酶购于生工生物工程(上海)股份有限公司,Taq酶购于南京诺唯赞生物股份有限公司,DNA提取试剂盒DP305购于天根生化科技(北京)公司。

表1 AFLP所用接头和引物Tab.1 Adapters and primers of AFLP
1.2 试验方法
1.2.1 毛红椿基因组DNA提取和检测
采用改良的CTAB[16]法和试剂盒法提取DNA,探索不同提取方法对DNA质量的影响。用紫外分光光度计和1%的琼脂糖凝胶电泳检测DNA浓度和纯度,将检测质量合格的DNA统一稀释成50 ng·μL-1,-20℃保存。
1.2.2 AFLP反应体系
(1)酶切与连接
酶切与连接采用一步法和两步法。一步法参照李雪萍[17]方法,将酶切与连接液混合,加入样品DNA后,放到37℃恒温培养箱中培养5 h,充分酶切与连接。反应总体积20 μL,含样品DNA 3 μl(50 ng·μL-1),10×T4 Buffer 2 μL,EcoR I(5 pmol·μL-1)/Mse I(50 pmol·μL-1)接头各1 μL,EcoR I(20 U·μL-1)0.15 μL,Mse I(10 U·μL-1)0.3 μL,T4 DNA Ligase(4 U·μL-1)0.3 μL,加dd H2O补足总体积至20 μL。
两步法参照刘晓莹[18]方法,将DNA在37℃培养箱中酶切3 h,酶切结束后65℃灭活20 min,随后进行连接(酶切与连接间隔时间不宜太久),取10 μL的酶切原液与接头和T4连接酶在16℃金属浴中连接12 h,结束后65℃灭活20 min,-20℃保存备用。反应总体积及各类试剂量参照一步法。
(2)预扩增
探索酶切与连接产物稀释倍数对预扩增的影响。设置不同稀释倍数分别为2、3、5、8和10倍。反应总体积20 μL,其中稀释后酶切与连接产物取3 μL,10×PCR Buffer(含Mg2+)2 μL,dNTPs(10 mmol·μL-1)0.8 μL,E-0(10 μmol·L-1)/M-0(10 μmol·L-1)引物各0.6 μL,Taq DNA聚合酶(5 U·μL-1)0.2 μL,用ddH2O补足总体积至20 μL;PCR反应程序:94℃3 min;94℃30 s,56℃30 s,72℃1 min,30个循环;72℃10 min,4℃保存。
(3)选择性扩增
将预扩增产物分别稀释10倍、20倍、30倍、40倍和50倍作为选择性扩增模板。反应总体积20 μL,其中稀释后预扩增产物5 μL,10×PCR Buffer(含Mg2+)2 μL,dNTPs(10 mmol·μL-1)0.8 μL,Mse I(10 μmol·L-1)/EcoR I(10 μmol·L-1)选择性引物各0.6 μL,Taq DNA聚合酶(5 U·μL-1)0.2 μL,用ddH2O补足总体积至20 μL。PCR扩增采用“touch-down”程序:94℃3 min,94℃30 s,65℃(每个循环下降0.7℃)30 s,72℃1 min,13个循环;94℃30 s,56℃30 s,72℃1 min,25个循环;72℃5 min,4℃保存。
1.3 AFLP反应体系测定
选用大丘田毛红椿单株(D62)DNA作为模板,引物为E2/M2(E-ACC/M-CAG)组合,2%琼脂糖凝胶检测酶切与连接产物、预扩增产物和选择性扩增产物,用量为2 μL产物+2 μL 6倍DNA上样缓冲液。
1.4 引物筛选
选用R110、H14、R319、D62等4个毛红椿DNA样本,对8个EcoR I引物和8个Mse I引物组成的64对引物组合进行初筛,在2%琼脂糖凝胶中筛选出能够扩增出条带的引物;再进行复筛,复筛产物在6%变性聚丙烯酰胺凝胶中进行电泳检测。电泳前将选择扩增产物在PCR仪中95℃变性5 min,迅速放置在96孔低温配液模块中防止复性,取4 μL选择扩增产物在1 mm 40孔内点样,300 V,电泳3 h。参照张峰[19]方法进行银染,拍照记录实验结果。
1.5 引物多样性检测
将筛选出的多样性引物对润洞毛红椿居群37个单株(R1-R37)DNA进行扩增,采用6%变性聚丙烯酰胺凝胶电泳对扩增产物进行分离检测,计算100~500 bp之间的电泳谱带,根据条带的有无进行1、0记数,在相同迁移位置上有条带记为1、无条带记为0,形成0/1矩阵图输入计算机,进行引物多态性分析。
2 结果与分析
2.1 提取方法对DNA质量的影响
对不同植物或同一植物不同组织器官,DNA提取方法不同,DNA质量也有很大差别。该研究采用的CTAB法和试剂盒法提取的DNA质量不同,CTAB提取的DNA含有多糖、酚、色素等杂质,对AFLP预扩增和选择性扩增PCR过程有抑制作用,PCR扩增后检测不到DNA条带,而试剂盒(天根DP305)提取的DNA质量较高(图1),能够满足实验要求。
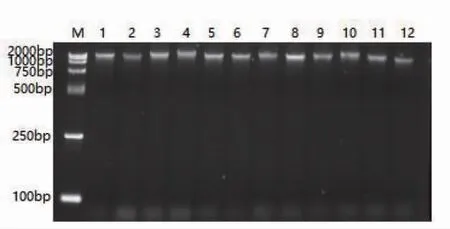
图1 试剂盒提取毛红椿DNA琼脂糖凝胶电泳检测Fig.1 The agarose gel electrophoresis results of T.ciliata var.pubescens DNA extracted by kit
2.2 毛红椿AFLP体系的建立
通过酶切与连接两种方法比较,结果表明两种方法无明显差异。因两步法操作复杂,耗时较长,因此本实验选择一步法开展。AFLP预扩增选取不含选择碱基的引物,经实验发现随着酶切与连接产物稀释倍数的增加,预扩增产物量呈逐渐减少的状态,当酶切与连接产物稀释倍数为3倍时,扩增产物最清楚。可为后续选择性扩增提供较理想的反应模板。当进行选择性扩增时,经琼脂糖凝胶电泳检测,预扩增产物不同稀释倍数对选择性扩增结果有明显影响,当预扩增产物稀释10倍时,能够扩增出清晰条带,影子带较少。
2.3 引物筛选
用64对引物组合进行初筛,在2%的琼脂糖凝胶中进行检测,获得能够清晰稳定扩增出条带的引物24对,图2为部分初筛选择性扩增引物;随后将24对引物组合在6%聚丙烯酰胺凝胶中电泳进行复筛,筛选出4对多态性引物,扩增出的条带数和多态性较高(图3)。在4个毛红椿单株DNA中扩增出147个位点,其中多态性位点122个,不同引物组合扩增效果不同,E-AAC/M-CAA引物扩增位点最多(51个),但多态性位点较少,多态位点百分率为78.43%;多态性较高的引物为E-ACG/M-CTT,多态位点百分率为96.15%,4对引物平均多态位点百分率为84.36%,可用于毛红椿AFLP分子标记分析(表2)。
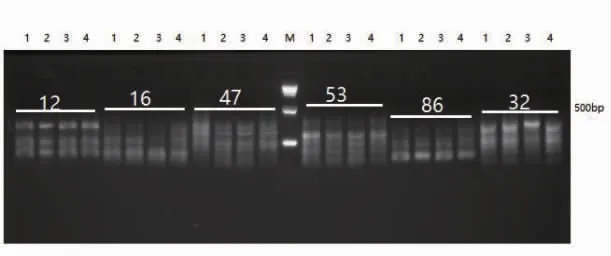
图2 部分引物选择性扩增初筛图Fig.2 Part of preliminary screen diagram of selective amplication primers
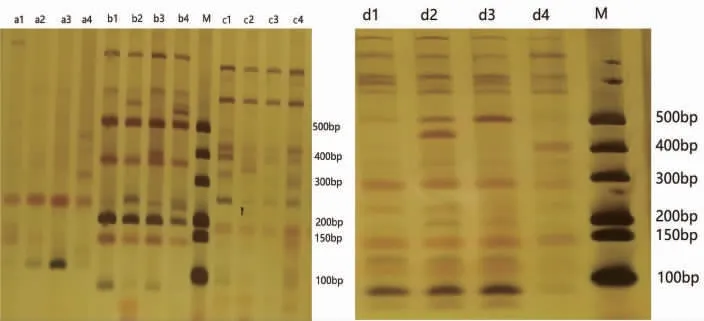
图3 多态性引物聚丙烯酰胺凝胶电泳Fig.3 Polyacrylamide gel electrophoresis results of polymorphic primers
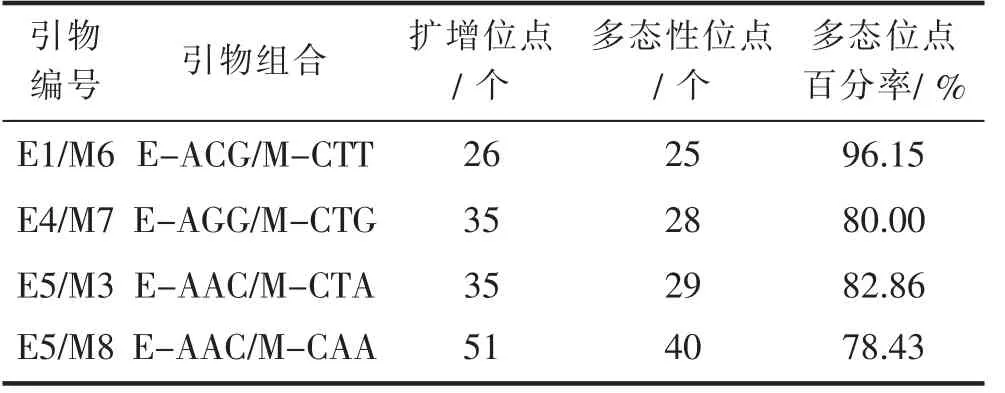
表2 AFLP多态性引物Tab.2 Polymorphic primers of AFLP
2.4 AFLP体系的稳定性检测
引物E4/M7对润洞毛红椿居群内37个单株DNA样品(R1-R37)进行扩增(图4),能够扩增出清晰条带,扩增结果稳定,背景清晰,无弥散现象,扩增条带大多分布在100~500 bp,说明基因组酶切完全,AFLP反应体系适用于毛红椿遗传多样性研究。
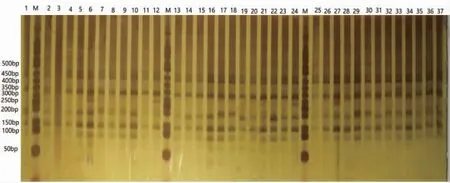
图4 引物组合E4/M7对37个样品选择性扩增结果Fig.4 Selective amplification results of E4/M7 primer on 37 samples
3 结论与讨论
该研究通过对模板DNA质量、连接产物稀释倍数、预扩增稀释倍数以及Taq酶反复摸索调整得到较稳定体系,20 μLAFLP体系中,DNA含量为150 ng,3U EcoR I和Mse I双内切酶,1.2U T4 DNA连接酶在37℃恒温培养箱中反应5 h,连接产物稀释3倍进行预扩增,预扩增产物稀释10倍进行选择性扩增,选择性扩增产物采用6%变性聚丙烯酰胺凝胶检测,可获得清晰的条带;从64对引物组合中共筛选出4对多态性较高的引物组合,平均多态性位点百分率84.36%,可为毛红椿遗传多样性和种质资源研究提供支持。
前人研究AFLP分子标记对模板DNA浓度不敏感[17,20],但是DNA质量是试验成败的关键。不同提取方法,DNA提取质量不同。改良CTAB法是通过氯仿异戊醇等有机溶剂抽提,去除蛋白、多糖、酚等杂质,加入乙醇进行沉淀,经离心去除上清液得到DNA[21]。经1%凝胶电泳检测CTAB法提取的DNA溶液含有RNA、多糖、色素或酚等杂质,这可能与有机溶剂抽提次数较少(2次),杂质没有去除干净有关;另外可能乙醇对DNA沉淀时,随着沉淀时间延长,色素、多糖、酚附着在DNA表面,经离心后,明显看出DNA呈褐色而不是白色沉淀物。DNA提取试剂盒采用离心柱法,利用特异性膜与DNA结合达到分离、回收的目的,操作简单、高效,DNA质量较高,杂质少,但是存在提取DNA含量低,所得样品溶液较少(含量一般在30~100 ng·μL-1之间,所得溶液为80~100 μL),易降解,需-20℃保存。AFLP分子标记对DNA浓度不敏感且用量少,但对DNA质量要求高,因此试剂盒提取的DNA较适用于后续研究。
AFLP酶切与连接一般采用一步法或两步法,如对珙桐[17]、梅花(Prunus mume)[22]、风信子(Hyacinth orientalis)[23]研究的过程中采用一步法,对榧树(Torreya grandis)[24]、广藿香(Pogostemon cablin)[18]采用两步法,不同的研究对象,采用的操作步骤有所差异,该研究发现毛红椿AFLP酶切与连接一步法和两步法无差别,因此选择一步法作为实验步骤。对PCR扩增所需模板稀释倍数进行研究,尤其对预扩增稀释倍数研究,直接影响着选择性扩增的结果。预扩增作为选择性扩增的模板,不稀释或稀释倍数较小,模板浓度过高,导致选择性扩增产物聚集,聚丙烯酰胺凝胶难以区分。稀释倍数过大,导致扩增条带发虚,不整齐,对数据的记录造成困难,因此摸索出合理的稀释倍数对实验结果至关重要。
AFLP引物中,3′末端选择性核苷酸数目对AFLP扩增谱带有很大影响,理论上,每增加1个选择性碱基,将只扩增限制性片段的1/4,而在两个引物上都有3个选择性碱基的情况下,则获得1/4096的片段,一般情况下,选择性碱基数不超过3个。另外,选择性碱基数目还与基因组大小有关,大于106 bp的基因组可选用3个选择性碱基,105~106bp的基因组可用2个选择性碱基[25]。姜志艳[26]对蒙古黄芪(Astragali membranaceus)AFLP分子标记研究,从36对引物组合(“2+2”“2+3”“3+3”)筛选出5对“2+3”多态性引物。本研究从64对引物组合中筛选获得4对多态性引物,在群体中多态性较高,但是获得的多态性引物较少,因此今后对于毛红椿AFLP引物的筛选中,可以考虑“2+2”“2+3”引物组合,进一步筛选更多的、多态性高的引物组合,用于毛红椿遗传分析。
PCR过程中所用到的Taq酶对实验成败至关重要,实验前期从同一厂家购买的普通Taq酶,所得到的图谱条带模糊,难以辨认,因此需要采用较高质量的Taq酶。这一研究结果与明军[22]、吴昊[24]、李雪萍[17]的研究结果一致,不同厂家的酶甚至不同批次的Taq酶对AFLP指纹式样都会有影响。
AFLP在珍稀濒危植物中广泛应用,能较好地扩增出多态性条带,如对濒危物种海菜花(Ottelia acuminate)[27]和珙桐[14]的遗传多样性分析中,分别使用了6对和7对AFLP引物,扩增得到的多态性性位点百分率都较高,证明AFLP分子标记在遗传多样性、亲缘关系和辅助育种方面具有巨大的研究潜力。该研究从64对引物组合中筛选出4条多态性引物组合,共扩增出147个位点,多态性位点122个,平均多态位点百分率84.36%,可用于后续毛红椿AFLP分子标记遗传多样性分析。AFLP分子标记还可以作为挖掘特异性识别位点的分子标记,如杨丹[28]利用AFLP对红三叶(Trifolium pratense)杂交F1代群体的抗、感白粉病单株进行鉴定,辨别真假杂种,为分子辅助育种提供依据,因此利用AFLP开发特异性标记可作为未来研究发展趋势[29]。
