朱砂根种胚繁育技术研究
2022-10-10田小桥钟双萍李佩仪
周 琪, 吕 享, 林 冰, 田小桥, 钟双萍, 李佩仪
(1.贵州中医药大学药学院,贵阳 550025;2.贵州中医药大学食品安全质量控制工程技术研究中心,贵阳 550025)
朱砂根(ArdisiacrenataSims)是紫金牛科紫金牛属植物[1],耐荫性强,四季常绿,挂果时间长,硕果鲜艳[2],常作为观赏植物,其干燥根为传统中药材[3]。现代药理表明,朱砂根干燥根具有抗菌、抗炎、抗肿瘤、抑制血小板凝聚、降血压等多方面的作用[4-6]。朱砂根药材在民间和药企有较大的使用量,市场需求量逐年增加。目前,朱砂根药材主要来源于野生资源,随着无限制的采挖,野生资源濒临枯竭,人工种植势在必行。朱砂根的繁殖方法主要有播种[7]、扦插、压条、组织培养等。研究表明,种子繁殖易出现性状分离,生长一致性差,影响朱砂根规模化育苗[8]。为解决上述问题,有学者开展了愈伤诱导[9]、幼茎丛生芽诱导[10]等生物技术研究,但未见采用朱砂根种胚进行无菌苗培养的报道。本试验以朱砂根种胚为材料,从消毒灭菌、基本培养基、胚龄选择、生长壮苗配方、移栽基质等方面开展育种技术研究,旨在掌握朱砂根种胚繁殖的调控技术,为朱砂根种胚离体培养及育苗生产技术提供参考。
1 材料与方法
1.1 材 料
本试验所用材料取自贵州中医药大学育苗大棚中朱砂根植株上的种子,由本校魏升华教授鉴定。
1.2 试验方法
1.2.1种子表面消毒灭菌
取不同成熟度的朱砂根种子,分别用75%酒精消毒0.5 min和1 min,再用0.1% HgCl2溶液分别处理6 min、8 min、10 min、12 min。消毒灭菌后,无菌水清洗5次,用滤纸吸干种子表面水分,接种于MS培养基,每组3瓶,每瓶3粒种子,重复3次,置光照培养箱,25 ℃暗培养3 d,观察并统计污染率。
1.2.2种子萌发的前处理
取已消毒灭菌好的成熟种子与未成熟种子,分别用解剖刀于无菌操作台上去掉种子果皮、切去1/3胚乳、取种胚,处理后即刻转接于已处理好的MS培养基上,置于光照培养箱中,温度设定为(23±2)℃,光照周期12 h/d,光照强度为2 500 lx(下同)条件下培养。每组处理3瓶,每瓶接3个外植体,重复3次,30 d后统计成苗率及观察无菌苗长势。
1.2.3胚龄的选择
分别取37 d、42 d、47 d、52 d、57 d等5个胚龄的种胚,接种于MS培养基上进行萌发,考察胚龄对种胚萌发的影响。每组接3瓶,每瓶接3个种胚,重复3次,培养12 d后统计萌发率。
1.2.4种胚萌发基本培养基的选择
分别以MS、1/2 MS、1/4 MS、WPM四种培养基为萌发培养基,取种胚,每组接3瓶,每瓶接3个种胚,重复3次,培养12 d后统计萌发率,筛选适宜萌发的基本培养基。
1.2.5无菌幼苗生长基本培养基的选择
将萌发早且萌发率高的萌发幼苗分别接种于MS、1/2 MS、1/4 MS、WPM等4种培养基上生长,样本量同1.2.4,培养30 d后统计株高、叶片数和根条数。
1.2.6无菌苗株型与移栽存活率的相关性考察
将培养所得无菌苗以株高和根粗两个指标分成6个级别,即株高(高:25.61~49.10 mm;中:19.17~25.07 mm;低:7.85~19.15 mm),根粗(高:1.83~2.79 mm;中:1.57~1.79 mm;低:1.12~1.56 mm),每个级别设3个重复,每组16株无菌苗,共计18组,同时统计根条数、茎粗和叶片数。移栽至育苗基质∶腐殖土(质量比)为1∶1的基质中培养,30 d后统计移栽存活率。
1.2.7无菌苗株型正交优化
为提高无菌苗的抗性,在基本培养中分别添加蔗糖、NAA和6-BA,设计此正交试验因素水平表(表1)。选取生长状况相对一致的无菌幼苗,接至相应培养基上,每组接3瓶,每瓶接1株,重复3次,每隔3 d观察一次,观察42 d后统计各生长指标。
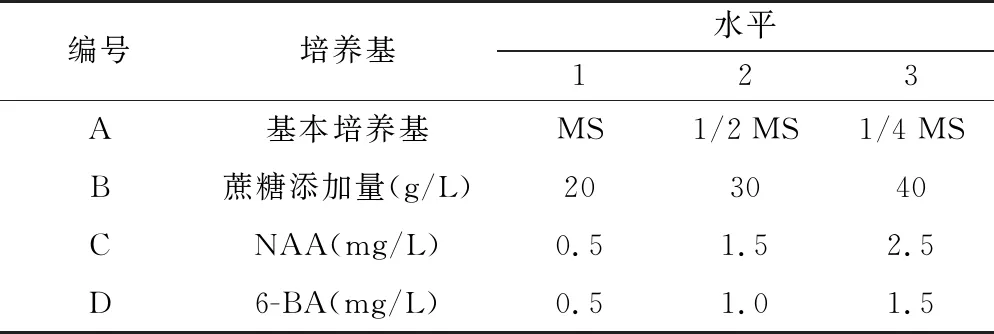
表1 正交试验因素水平Table 1 Level table of orthogonal test factors
1.2.8炼苗移栽
选取生长状况良好的无菌苗,炼苗3 d,分别移栽至育苗基质∶腐殖土(质量比为1∶1,JZ 1)、育苗基质∶黄壤土(质量比为1∶1,JZ 2)和纯育苗基质(JZ 3)中。每种基质移栽30株,做3次重复,30 d后统计存活率。
1.3 数据统计
相关分析采用GraphPad Prism 8.0软件分析作图,其他数据均采用Excel 2016和SPSS 21.0软件进行统计分析。
污染率(%)=(污染的种子数/接种数)×100%;
萌发率(%)=(萌发数/接种数)×100%;
存活率(%)=(存活数/移栽数)×100%。
2 结果与分析
2.1 灭菌效果
为保护种胚免受消毒灭菌剂的损害,直接以朱砂根果实进行无菌处理,结果(表2)表明,酒精的处理更有效,表明消毒灭菌剂的穿透能力对果实类材料灭菌效果尤为突出,最终确定朱砂根果实消毒灭菌参数为75%酒精1 min + 0.1% HgCl210 min。
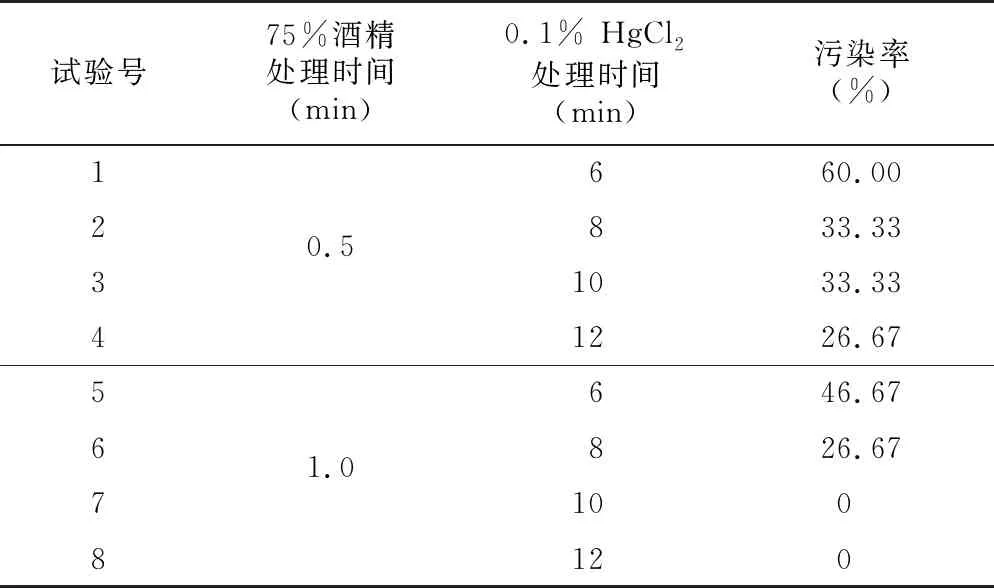
表2 灭菌处理效果Table 2 Effect of sterilization treatment
2.2 物理处理对种子萌发的影响
朱砂根果实是浆果类果实的代表之一,此类种子萌发受物理障碍较为突出,为提高萌发效率与萌发一致性,开展了物理障碍破除技术研究。结果(表3)表明,切除种子的部分胚乳,可显著提高其萌发率(p<0.05);成熟种子的种胚几乎不能在MS培养基上萌发,未成熟种子的种胚萌发率达100%,这可能与种子的生理状态有关(如种胚的含水量及细胞活性)。

表3 物理处理效果Table 3 The effect of physical processing
2.3 胚龄对种胚萌发的影响
植物种子的胚龄决定着种胚适应环境的能力,据此,开展了适宜萌发的胚龄选择研究。结果(图1)显示,在考察期内,随着胚龄增加,萌发率呈现先升后降的变化趋势,47 d胚龄的萌发率达到峰值,之后萌发率开始下降,推测种胚内种皮发育完善,一定程度上阻碍了种胚对养分的吸收。
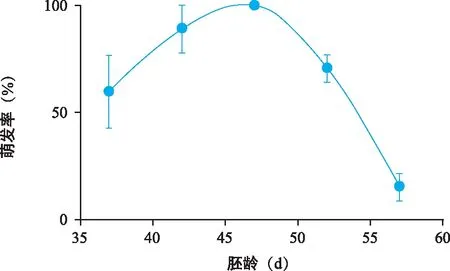
图1 种胚胚龄对萌发率的影响Fig.1 Effect of embryo age on germination rate
2.4 基本培养基对种胚萌发的影响
离体种胚的萌发不仅需要适宜的生长条件,还需充足的养分。培养基不同,其成分差异较大,因此选择4种基本培养基进行萌发实验。检测结果(图2)显示,种胚在MS和WPM培养基中的萌发率显著低于1/2 MS(p<0.05),1/2 MS与1/4 MS无显著性差异。培养12 d后,1/2 MS培养基中种胚长出绿色的子叶,且叶片全部展开,其他组的子叶未全部长出(图3)。
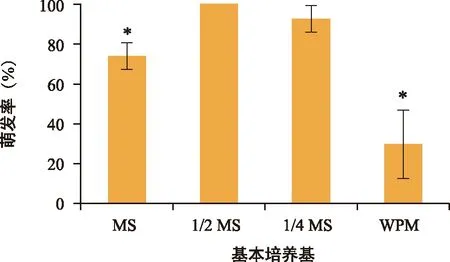
注:“*”表示与1/2 MS组比有显著性差异。图2 不同培养基中种胚萌发情况Fig.2 Effects of different media on germination of seed embryos

注:A为MS培养基;B为1/2 MS培养基;C为1/4 MS培养基;D为WPM培养基。图3 不同培养基对种胚萌发的影响Fig.3 Effects of different media on germination of seed embryos
2.5 基本培养基对无菌幼苗生长的影响
种胚萌发后,进入无菌苗生长期,为获得优质无菌苗,开展营养需求研究。结果(表4,图4)表明,1/2 MS和1/4 MS培养基中幼苗长势最好,其次是WPM,MS最差。1/4 MS培养基对幼苗根的生长最有利。
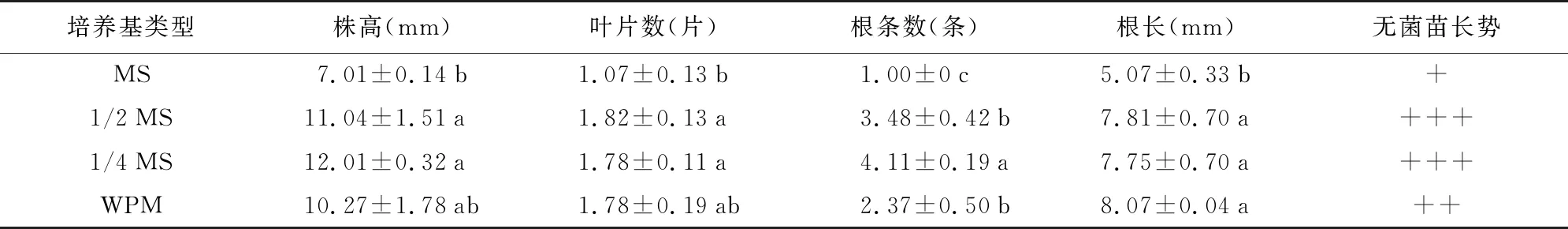
表4 不同培养基对无菌苗生长的影响Table 4 Effects of different media on growth of sterile seedlings

注:A、B、C、D分别为在MS、1/2 MS、1/4 MS和WPM培养基中培养的幼苗;E、F、G、H分别为对应培养基中幼苗的根系。 图4 不同培养基对无菌苗生长的影响Fig.4 The correlation between the survival rate and sterile seedling of different plant types
2.6 无菌苗株型对移栽存活率的影响
良好的植物株型不但能提高作物的产量,而且有助于植物移栽的成功率。结果(表5,图5)表明,朱砂根无菌苗根条数与移栽存活率呈显著正相关(p<0.05),其相关系数为0.533;然而茎粗与移栽存活率呈极显著负相关,相关系数为-0.689,这可能是叶片数与茎粗呈正相关的原因,单位叶片面积增加,蒸腾效应提高,水分丢失加快,存活率下降。
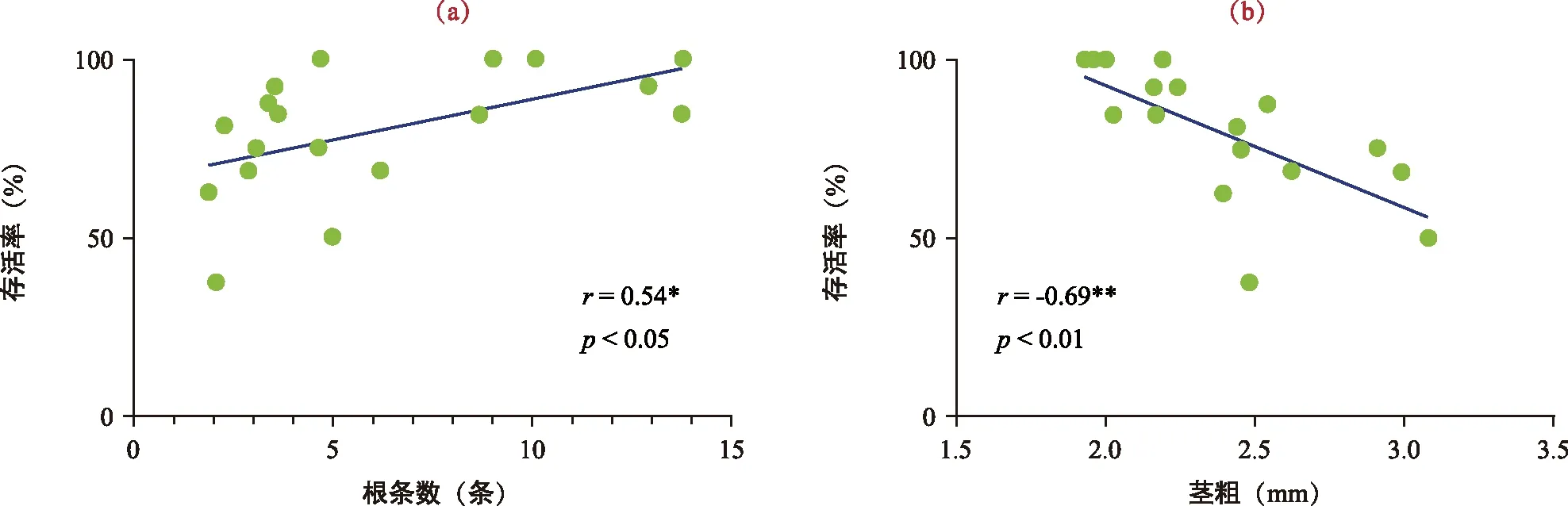
注:A为JZ 1(育苗基质与腐殖土质量比为1∶1);B为JZ 2(育苗基质与黄壤土质量比为1∶1);C为JZ 3(纯育苗基质);D为不同基质存活率条形图。图5 不同株型无菌苗与存活率的相关性Fig.5 The correlation between the survival rate and the aseptic vaccine of different plant types
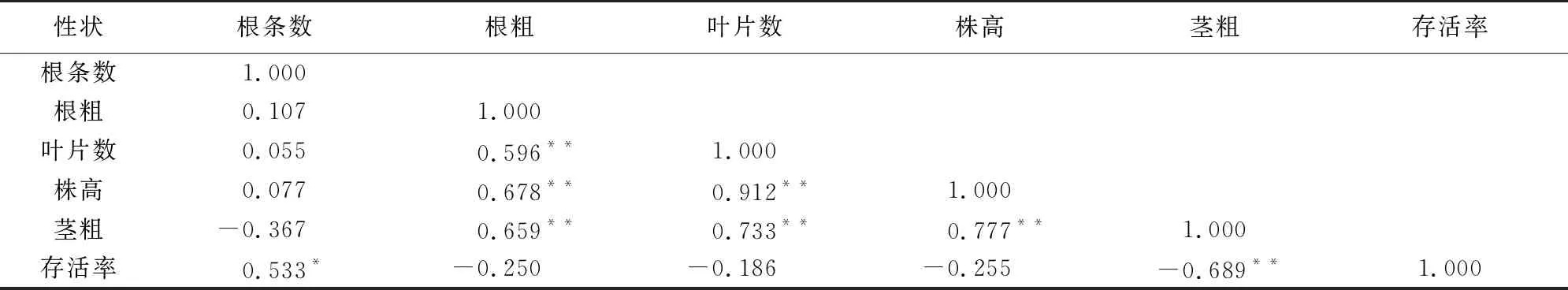
表5 无菌苗株型与移栽存活率的相关性分析Table 5 Analysis of correlation between plant types and survival rate
2.7 正交试验株型优化
为获得根系发达、株型良好且移栽存活率高的无菌苗,本研究采用正交试验优化幼苗培养条件。结果(表6)显示,基本培养基与植物激素对幼苗根粗影响较大,蔗糖与基本培养基对幼苗茎粗影响较大。综合分析,最佳无菌苗生长培养基为:1/2 MS+0.5 mg/L 6-BA+2.5 mg/L NAA+20 g/L蔗糖(pH=5.8)。
2.8 移栽基质对移栽存活率的影响
以正交优化得到的最优培养基培养的无菌苗为材料,初步探讨移栽的适宜培养基质,结果(图6)表明,在JZ 1中存活最高,且与JZ 2达到显著水平,说明基质的保湿、透气对移栽存活率有较大影响。

注:A为JZ 1(育苗基质与腐殖土质量比为1∶1);B为JZ 2(育苗基质与黄壤土质量比为1∶1);C为JZ 3(纯育苗基质);D为不同基质存活率条形图;“*”表示与JZ 1组比较有显著性差异。图6 不同炼苗移栽基质对无菌苗生长的影响Fig.6 Effects of different cultivation substrates on growth of sterile seedlings
3 结果与讨论
引起植物种子休眠的因素十分复杂,有来自种皮及其掩盖物的机械压迫,种胚发育不成熟,种子不透气、不透水,种皮抑制性成分等因素。本研究发现,朱砂根种子致密的种皮和坚硬的胚乳是导致其萌发参差不齐的主要因素,严重影响其规模化育种。谢金兰等[11]研究发现,楠木种子经物理去皮后,显著提高其萌发率和萌发的整齐度。耿晓东等[12]去除射干种子的种皮障碍后,使射干种子的萌发率提高了40.9%。曹小林等[13]研究海南红豆种子萌发特性时,发现破除其种皮限制,能显著改善种子发芽率、发芽速度、发芽势和发芽指数。本研究通过机械损伤朱砂根种子坚硬的胚乳,可提高其萌发率(表3),但整齐度依然不理想;之后,直接取其种胚进行无菌培养,在12 d后均能整齐地发出子叶,长成幼苗(图3、图4),表明朱砂根种子的机械压迫是影响其萌发一致性的主要因素。因此,采用朱砂根种胚育种能较好地解决朱砂根种子萌发一致性差的问题。
胚龄主要通过种胚细胞的活力及种胚内种皮形成过程中细胞排列的致密程度影响种胚萌发。许文天等[14]研究杧果胚龄对幼胚离体培养的影响时,发现幼胚萌发率随胚龄增大呈先升高后降低的变化趋势。此外,莲幼胚萌发实验也呈类似变化规律[15]。本研究结果也表明,朱砂根种胚的萌发率随胚龄的改变呈现相似的变化规律(图1),这为朱砂根种胚育种的取胚时间提供依据。
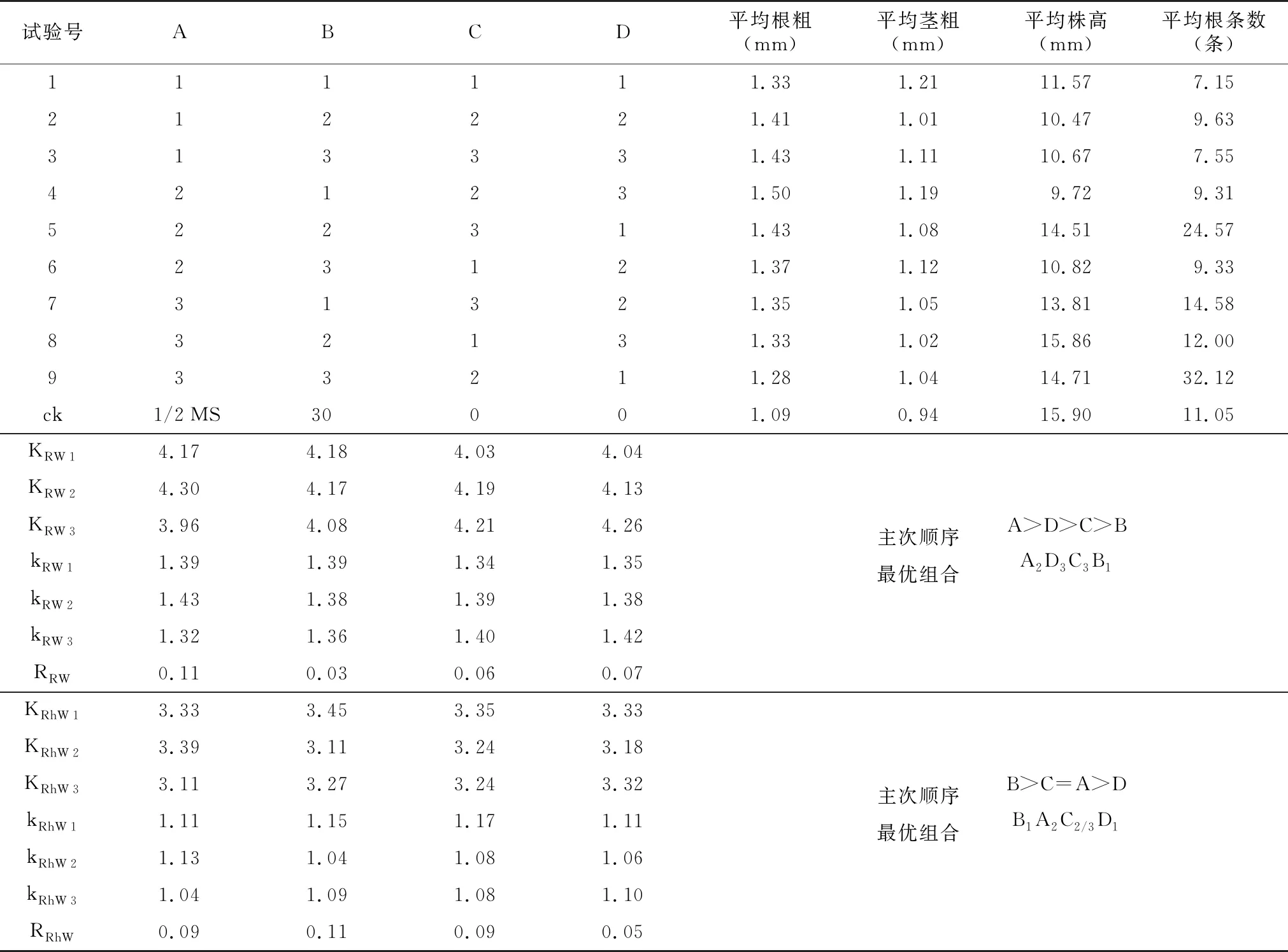
表6 正交试验结果Table 6 Orthogonal experimental results
韦媛等[16]研究表明,培养基中大量元素的浓度对植物种子萌发及其幼苗生长有较大的影响。本研究针对性地设计了一组大量元素递减的基本培养基,探讨大量元素对朱砂根种胚萌发及其幼苗生长的影响,也发现大量元素适当减少有利于朱砂根种胚的萌发及其幼苗的生长(图2、图3、表4)。
植物生长调节剂、碳源等成分对植物组织培养材料的生长发挥重要的调节作用[17-18]。张新超等[19]研究表明,适宜浓度的植物生长调节剂,对组培苗的生根率、根长及根粗度均具有显著的调控作用。本研究发现,朱砂根地上部分的叶片既多又大,水分蒸发不可避免,易导致移栽植株体内水分供应不平衡,致使苗木整株死亡,选择基本培养基、蔗糖、6-BA和NAA四种培养基,进行幼苗优化培养,获得了叶片数少,根系较为发达,根条数较多,茎细株高适中的无菌苗株型,显著提高幼苗在开放环境中的生存能力,明显提高移栽存活率。
