植物乳杆菌CD101和模仿葡萄球菌NJ201对发酵香肠多肽体内外抗氧化活性的影响
2022-10-09冯美琴张译文
冯美琴,张译文,孙 健,*
(1.金陵科技学院动物科学与食品工程学院,江苏 南京 210038;2.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095)
干发酵香肠是一种传统的肉制品,因风味独特、营养价值高及贮存时间长等优点备受欢迎,但其生产周期长、成品质量不稳定和潜在的安全隐患等问题亟待关注。发酵剂的出现解决了上述问题。其中,最常用的是乳酸菌和凝固酶阴性葡萄球菌。乳酸菌可以快速降低pH值,促进亚硝酸盐的分解并抑制病原体的生长,而葡萄球菌赋予产品良好的色泽。它们还在蛋白质降解成小肽和氨基酸的过程中发挥重要作用,从而改善产品风味和提高营养价值。肽的形成不仅促进肉类风味的形成,其本身还具有多种生物活性,其中抗氧化活性备受研究者关注。抗氧化肽可能通过阻断自由基链反应抑制自由基活性,合成抗氧化剂由于具有强烈副作用包括肝损伤和致癌性而受到消费者的抵制和质疑,所以目前开发高效、安全、无毒的天然抗氧化肽已经成为国内外的研究热点。
目前已有多项研究探究了发酵剂对发酵产物中多肽的抗氧化活性的影响。植物乳杆菌与酿酒酵母共发酵会显著增加薏仁米发酵液的体外抗氧化活性。相比于未接种的香肠,Mejri等也从接种乳酸菌和葡萄球菌的香肠中提取出更多具有更高的抗氧化和降血压活性的多肽。课题组前人报道发现植物乳杆菌CD10和模仿葡萄球菌NJ201两种菌接种肌原纤维蛋白和肌浆蛋白能有效促进蛋白降解,并且增强多肽,特别是小分子多肽的抗氧化能力。但是混合发酵剂应用于香肠实际体系后对多肽及其生物活性的影响仍缺乏深入研究。而且目前关于肉类尤其是发酵香肠抗氧化肽的研究主要停留在化学反应等体外层面,体内活性研究鲜有报道。由于人体消化环境非常复杂,抗氧化肽的实际效果仅凭体外实验无法确切衡量。因此本研究结合体外抗氧化反应和体内动物实验,全面衡量接种植物乳杆菌CD101和模仿葡萄球菌NJ201发酵香肠的多肽体内外抗氧化作用,旨在为发酵香肠的深入应用提供更多理论和实验依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌CD101(CD101,NCBI编号MG798695);模仿葡萄球菌NJ201(NJ201,NCBI编号MG798688)。
1.1.2 原料与试剂
猪后腿精肉、猪背膘、猪肠衣 江苏省苏食肉品有限公司南京分公司;盐、蔗糖、姜粉、五香粉、白胡椒粉 江苏省南京市苏果超市。
葡萄糖 南通奥凯生物技术开发有限公司;亚硝酸钠 杭州龙山化工有限公司;异抗坏血酸钠 郑州拓洋实业有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)试剂盒、丙二醛(malonaldehyde,MDA)试剂盒、总蛋白试剂盒南京建成生物工程研究所。其他试剂为分析纯。
1.2 仪器与设备
OptiMair垂直流超净工作台 新加坡艺思高科技有限公司;HVE-50自动高压灭菌锅 日本Hirayama公司;WH-2微型涡旋混合仪 上海沪西分析仪厂有限公司;螺旋接种仪、自动影像分析菌落计数仪 法国Interscience公司;ICP260生化培养箱 德国Memmert公司;GM200刀式研磨仪 德国Retsch公司;T25匀浆机德国IKA公司;TC 12E绞肉机 意大利Sirman公司;VF608灌肠机 德国Handtmann公司;KBF 720恒温恒湿箱 德国Binder公司;Avanti J-E高速冷冻离心机美国Beckman Coulter公司;RE-52AA旋转蒸发器上海亚荣生化仪器厂;HH-42水浴锅 常州国华电器有限公司;ES2030冷冻干燥机 日本Hitachi公司;Spectral Max M2e多功能酶标仪 美国伯腾仪器有限公司;PTF-A300型万分之一电子天平 瑞士Precisa公司;SIM-F124制冰机 日本三洋电子有限公司。
1.3 方法
1.3.1 发酵剂的活化与制备
于恒温37 ℃的条件在MRS(de Man,Rogosa and Sharpe)液体培养基上培养植物乳杆菌CD101 20 h,于恒温30 ℃在甘露醇盐琼脂(mannitol salt agar,MSA)液体培养基培养模仿葡萄球菌NJ201 20 h;活化两次,吸取所需体积的菌液12 000×、4 ℃离心5 min,舍弃上清液,然后用无菌生理盐水反复洗涤沉淀数次。
1.3.2 干发酵香肠的制作
参考曹辰辰等的方法。新鲜猪后腿肉与猪背膘质量比为8∶2,其他成分以肉质量为基础添加:食盐2%、蔗糖1%、葡萄糖1%、亚硝酸钠0.015%、异抗坏血酸钠0.05%、姜粉0.1%、白胡椒粉0.1%、五香粉0.1%。接种组发酵剂配比为植物乳杆菌CD101∶模仿葡萄球菌NJ201=1∶1,接种量为10CFU/g。工艺流程:原料肉→漂洗→绞肉→搅拌(发酵剂)→灌肠→恒温发酵→干燥成熟。
按照8∶2比例将瘦肉和肥肉混合均匀并加入所需的调味料。以不添加任何发酵剂的自然发酵香肠为对照组;以接种发酵剂的香肠为接种组。在恒温恒湿箱中以30 ℃、相对湿度80%的条件发酵24 h,然后在15 ℃、相对湿度75%的条件下干燥3 d,最后以12 ℃、相对湿度72%条件成熟17 d得到发酵香肠样品。
1.3.3 发酵香肠中多肽提取及含量测定
发酵香肠(21 d)中多肽提取及含量测定参考Xing Lujuan等方法,略修改。不同阶段的自然发酵和接种发酵香肠按固定25 g原始鲜瘦肉质量所得到的香肠提取多肽。样品加入100 mL pH 7.2 磷酸盐缓冲溶液,冰浴匀浆3 次(18 000×,10 s×3),4 ℃静置2 h后12 000×、4 ℃离心20 min。取上清液,经纱布过滤后加入3 倍体积40%乙醇溶液,静置过夜(12 h)。之后继续12 000×、4 ℃离心20 min,上清液经0.45 μm水系滤膜抽滤。滤液使用旋转蒸发仪浓缩去除乙醇,剩余肽液冻干,得到粗肽粉,于-20 ℃密封保存。多肽含量的测定首先需要配制邻苯二甲醛混合试剂,80 mg邻苯二甲醛溶于2 mL甲醇中,依次加入50 mL 0.1 mol/L四硼酸钠溶液、5 mL 20%十二烷基硫酸钠和200 μL-巯基乙醇后,用纯水定容到100 mL。此试剂现用现配。取100 μL的上述肽液与2.0 mL邻苯二甲醛试剂混合,室温反应2 min。随后在340 nm波长处测定吸光度。以胰酪蛋白胨作为标准蛋白绘制标准曲线,计算发酵香肠粗肽液中的多肽含量。
1.3.4 体外抗氧化活性
1.3.4.1 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力的测定
参照Shimada等的方法,略修改。配制质量浓度为1.0、2.0、3.0、4.0、5.0 mg/mL的肽液,并以谷胱甘肽(glutathione,GSH)为阳性对照组。将0.5 mL肽液加入0.5 mL以95%乙醇溶液溶解的0.2 mmol/L DPPH自由基溶液,混匀,于室温放置30 min后,测定混合物在517 nm波长处的吸光度,95%乙醇溶液替换DPPH自由基溶液为空白组,95%乙醇溶液替换肽液为对照组。肽液对DPPH自由基的清除能力计算如式(1)所示:
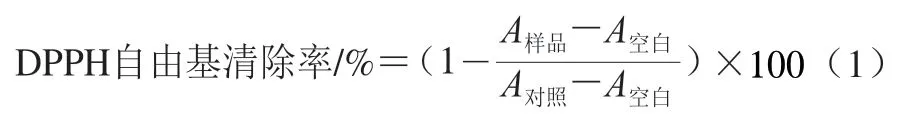
1.3.4.2 金属离子螯合能力的测定
参考Oh等方法。分别取1 mL质量浓度为1.0、2.0、3.0、4.0、5.0 mg/mL的肽液与0.05 mL 2 mmol/L FeCl溶液合并。然后将0.2 mL 5 mmol/L Ferrozine试剂加入反应混合物中并充分混合。反应混合物在室温下反应10 min。在562 nm波长处测定吸光度,并以GSH为阳性对照组。去离子水代替样品为对照组。肽液金属离子螯合能力计算如式(2)所示:

1.3.4.3 羟自由基清除能力的测定
采用邻二氮菲法。以GSH为对照组。0.6 mL 5 mmol/L邻二氮菲溶液中加入0.4 mL磷酸盐缓冲液(0.2 mol/L、pH 7.4)混匀,加入0.6 mL粗肽溶液及0.6 mL EDTA(15 mmol/L),混匀后加入0.6 mL FeSO溶液(5 mmol/L),混匀后加入0.8 mL 0.1% HO溶液,涡旋混匀后于37 ℃静置1 h,测定样品在536 nm波长处的吸光度;超纯水替换样品测得的吸光度;超纯水代替HO测得吸光度。计算公式如下:

1.3.4.4 2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力的测定
按照ABTS试剂盒步骤测定。参考Zaky等的方法。等体积ABTS溶液和氧化剂配制ABTS工作液,黑暗中反应14 h。用磷酸缓冲溶液稀释工作液45 倍后,取200 μL溶液与10 μL样品混合,室温反应4 min,然后在734 nm波长处测定吸光度。以超纯水代替肽液作为对照组;Trolox为标准品(0.15~1.5 μmol/L)制作标准曲线,计算样品对ABTS阳离子自由基的清除情况,单位为mol/L(Trolox当量计)。以GSH为阳性对照。
1.3.5 体内抗氧化活性
1.3.5.1 实验动物的饲养和分组
选用健康ICR小鼠共60 只,雌雄各半,SPF级,质量18~22 g,来源于上海斯莱克动物实验中心。饲养条件:保持室温(22±2)℃和中等相对湿度(50±10)%的条件,小鼠采用同室分笼饲养,每笼4 只,可以自由进食和饮水,噪音小于60 dB,明暗间隔12 h为一循环,以国家标准适应性喂养7 d,然后将60 只小鼠随机按照性别分为5 组,每组各12 只(雄性/雌性)。采用皮下注射100 mg/(kg·d)-半乳糖构建小鼠氧化模型。给药28 d,最后一次给药后将小鼠禁食12 h。正常对照组小鼠皮下注射和灌胃等量生理盐水;氧化模型组灌胃等量生理盐水;VC对照组灌胃5 mg/(kg·d)的VC;低质量浓度多肽添加组(低肽组)灌胃40 mg/(kg·d)的粗肽液;高质量浓度多肽添加组(高肽组)灌胃100 mg/(kg·d)的粗肽液。
1.3.5.2 生长性能的检测
最后一次给药12 h后,将小鼠称质量,处死并进行解剖;采集小鼠的肾脏、胰脏、心脏、脾脏等脏器,以4 ℃生理盐水漂洗并用滤纸吸干,称质量。脏器指数计算如式(4)所示:

1.3.5.3 血样和组织样的制备与检测
小鼠饲养28 d后,眼眶取血后处死小鼠并进行解剖,3 000×、25 ℃离心10min取上清液,测定SOD、GSH-PX、CAT活性及总抗氧化能力(total antioxidant capacity,T-AOC)。肝脏组织取出后立刻放于-80 ℃液氮罐进行急冻,测定肝脏SOD、GSH-PX、CAT活性及MDA含量。各指标的测定步骤参考南京建成生物工程研究所试剂盒说明书。
1.4 统计分析
体内实验每个处理组设置6 个重复,统计分析数据使用SAS V8软件中的Duncan’s Multiple-Range Test和单因素方差分析,结果以 ±表示,均用Origin 2020作图。<0.05,差异显著。
2 结果与分析
2.1 体外抗氧化实验
如图1A所示,在1~5 mg/mL范围内,接种发酵香肠粗肽液清除DPPH自由基的能力显著高于对照组(<0.05),都呈剂量依赖型。随着质量浓度的增加,接种组多肽清除活性不断上升,逐渐接近抗氧化肽GSH,最终在5 mg/mL时与其无显著差异,达到92.14%。而Xing Lujuan等利用G-25凝胶层析柱、离子交换柱、高效液相色谱等分离方法纯化得到宣威火腿多肽的DPPH自由基清除能力为74.45%。Oh等发现绿茶提取物的DPPH自由基清除能力为82.54%。这些结果表明发酵香肠粗肽液具有较高的抗氧化活性。香肠多肽具有较高DPPH自由基清除活性的关键可能在于其多肽成分及氨基酸组成,正如Yu Di等结果显示接种组香肠多肽含有更高比例的疏水氨基酸可能有更强的清除自由基能力。由图1B可发现,接种组粗肽液在5 mg/mL时清除羟自由基的能力接近60%,比对照组高出近1 倍。在其他质量浓度时接种组也都显著高于对照组,但都低于GSH。如表1所示,对照组和GSH的ABTS阳离子自由基清除能力显著高于接种组(<0.05)。相反地,Karwowska等发现接种乳酸菌的羊肉会产生更多多肽,且清除ABTS阳离子自由基的活性更强。这可能是由于多肽氨基酸的组成和含量不同。据研究酪氨酸和半胱氨酸的存在会显著提高多肽ABTS阳离子自由基清除能力,以及组氨酸在特定位置时肽链抗氧化活性会更强。
如图1C所示,接种发酵香肠粗肽液Fe螯合能力与对照组和GSH相比显著升高,最高为53.31%。Zaky等发现分子质量为3~10 kDa的米糠蛋白水解物的金属离子络合能力最高为61.04%。推测原因可能是多肽含有的酸性氨基酸如天冬氨酸侧链中包含的氨基和羧基有较强的螯合 Fe的能力,抑制了自由基的产生,与Phongthai等的结果一致。相似地,发酵剂可能改变了粗肽液的氨基酸组成从而提高了其Fe螯合能力。总结来说,接种发酵香肠多肽具有更高的体外抗氧化能力。这可能因为混合发酵剂促进香肠蛋白水解,暴露了更多疏水性氨基酸残基如亮氨酸、脯氨酸,或者增加了一些特定氨基酸的含量提高了清除自由基的能力。但这需要进一步对粗肽液进行纯化鉴定后得到验证。

图1 21 d接种组和对照组香肠中不同质量浓度多肽的抗氧化活性Fig. 1 Antioxidant activity of different concentrations of peptides derived from naturally and starter fermented sausage
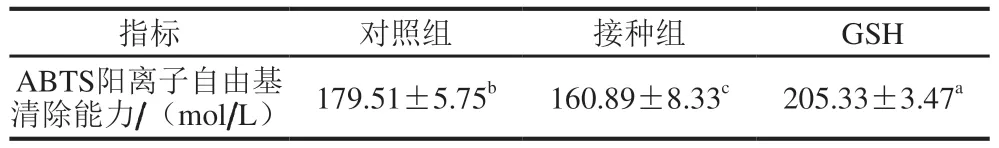
表1 接种组和对照组发酵香肠多肽的ABTS阳离子自由基清除能力Table 1 ABTS radical cation scavenging activity of T peptides derived from naturally and starter fermented sausage
2.2 体内抗氧化实验
2.2.1 接种发酵香肠源多肽对小鼠生长性能的影响
生物体抗氧化能力和生长免疫功能有密切的联系,脾脏是机体的主要免疫器官。由表2可知,-半乳糖构建的氧化模型组小鼠体质量与其他组小鼠没有显著差异(>0.05)。各组小鼠的胰脏指数、心脏指数差异均不显著(>0.05)。但高肽添加组雄雌小鼠的脾脏指数显著高于氧化模型组小鼠(<0.05)。结果表明:在-半乳糖刺激后,添加接种发酵香肠源多肽可以有效减少和缓和小鼠脏器指数的下降,促进小鼠正常生长。初欢欢等得到了相同的结论,发现小鼠体质量不受人工合成肽的影响,但脏器指数显著提高。也有文献发现大豆活性肽对断奶仔猪的生长性能有显著的促进作用,但是对脏器发育没有显著影响。推测可能是不同来源的活性肽侧重于不同的生理功能。发酵香肠源抗氧化肽干预后可明显提高脾脏系数,其或许可以抑制器官老化、增强免疫功能,但后续需要更深入研究对生长和免疫性能的影响。

表2 接种发酵香肠源多肽对小鼠体质量、脏器指数的影响(n=6)Table 2 Effect of peptides from starter fermented sausage on body mass and viscera indices of mice (n = 6)
2.2.2 接种发酵香肠源多肽对小鼠血清抗氧化指标的影响
2.2.2.1 接种发酵香肠源多肽对小鼠血清抗氧化酶活性的影响
SOD可以有效清除超氧阴离子自由基,是抗氧化系统的关键酶之一。GSH-PX和CAT也是机体抗氧化系统的重要组成酶,能清除体内多余的HO和羟自由基,阻止脂质的氧化。

表3 接种发酵香肠源多肽对小鼠血清抗氧化酶的影响(n=6)Table 3 Effect of peptides from starter fermented sausage on antioxidant enzyme activities in serum of mice (n = 6)
由表3可知,氧化模型组小鼠血清中SOD、GSH-PX活性显著低于其他各组(>0.05),而低肽组、高肽组及VC对照组小鼠血清SOD、GSH-PX活性之间无显著差异(>0.05),说明-半乳糖加剧小鼠细胞氧化,导致抗氧化酶活性降低,而添加接种发酵香肠源多肽可以减少氧化刺激,加固防线,增加抗氧化酶SOD、GSH-PX活性,甚至优于添加VC组的抗氧化效果。与氧化模型组相比,添加高含量接种发酵香肠源多肽的小鼠血清CAT活性显著增加,以上结果表明在-半乳糖刺激后,氧化组血清中抗氧化酶活性显著下降。而添加了接种发酵香肠源多肽后,可以使抗氧化酶SOD、CAT、GSH-PX恢复甚至高于正常水平,这与Sun Yangying等的研究结果相似。Sun Yangying等利用-半乳糖诱导氧化小鼠测定鸡蛋白水解物的体内抗氧化能力,结果发现水解物能显著提高SOD、CAT和GSH-Px等抗氧化酶活性。You Lijun等用木瓜蛋白酶水解泥鳅肉制备泥鳅多肽,发现泥鳅多肽可以提高SOD、CAT和GSH-Px活性改善小鼠内源性细胞抗氧化活性,但提高SOD活性的幅度较小。
2.2.2.2 接种发酵香肠源多肽对小鼠血清T-AOC的影响
T-AOC全面直接地反映机体酶和非酶抗氧化系统应对外界刺激的调节能力,是代表机体抗氧化能力的关键指标。由图2可知,添加高质量浓度粗肽液显著提高氧化模型组小鼠T-AOC,效果优于添加VC组。低质量浓度粗肽液缓和了衰老小鼠的氧化程度,但没有显著差异。添加接种发酵香肠源多肽后,小鼠血清抗氧化酶活性和T-AOC能力一致提高,说明抗氧化肽对提高血清抗氧化能力有较好效果。因此,接种发酵香肠源多肽对小鼠衰老的抑制作用可能部分源于它们对血清抗氧化酶系统的影响。
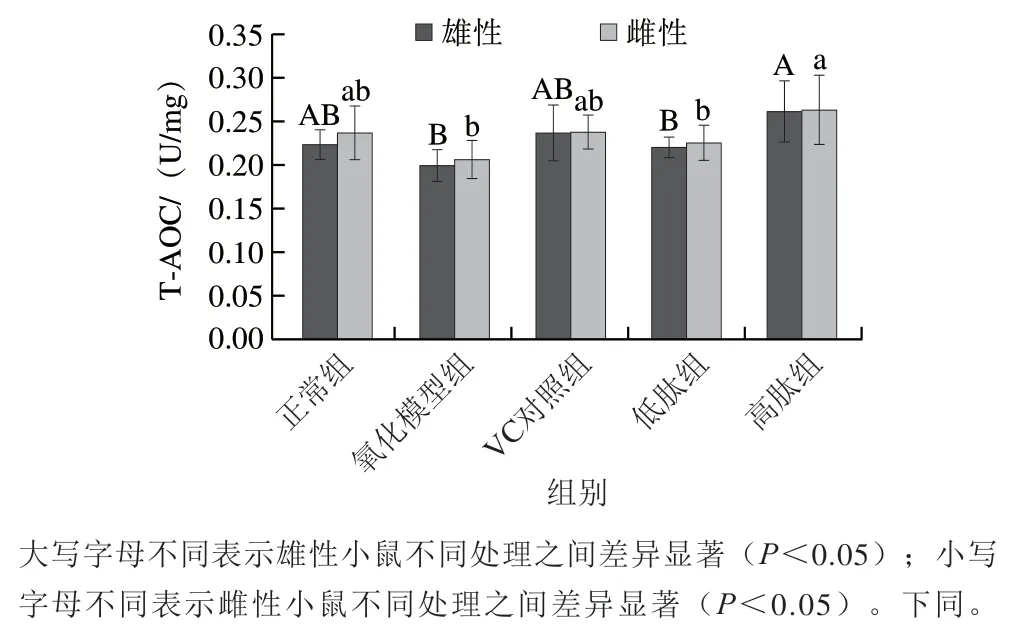
图2 接种发酵香肠源多肽对小鼠血清T-AOC的影响Fig. 2 Effect of peptides from starter fermented sausage on serum T-AOC in mice
2.2.3 接种发酵香肠源粗肽液对小鼠肝脏抗氧化指标的影响
2.2.3.1 接种发酵香肠源粗肽液对小鼠肝脏抗氧化酶活性的影响
由表4可知,-半乳糖刺激后,模型组雄、雌小鼠肝脏组织的SOD(61.89、59.80 U/mg)、CAT(36.38、34.62 U/mg)活性显著低于其他各组(<0.05),结合本研究及前人文献得出-半乳糖诱导氧化模型组抗氧化酶活性显著低于对照组,表明-半乳糖可以引起体内大量过氧化物的产生,成功构建了动物氧化模型。添加低含量接种发酵香肠源多肽能提高CAT活性达到正常水平,提高粗肽液添加量后,CAT活性显著增加,高含量接种发酵香肠抗氧化肽对CAT活性的恢复效果甚至优于VC,呈现一定的量效依赖关系。与氧化模型组相比,高肽组小鼠SOD活性显著提高,恢复到正常水平,和VC对照组作用效果相当。低肽添加组小鼠SOD水平和氧化模型组没有显著差异(>0.05)。添加接种发酵香肠源多肽对小鼠肝脏GSH-PX活性没有显著影响,而添加VC能显著提高小鼠GSH-PX活性。但与之相反的是,接种发酵香肠源多肽能够改善小鼠血清中GSH-PX活性,祝超智也得到了相同的研究结果。推测可能是因为在肝脏中抗氧化肽中所含的谷氨酰胺、半胱氨酸、甘氨酸等合成GSH-PX的前体物质被消化。此外,接种发酵香肠源多肽的给予方式可能会影响其在血清和肝脏中吸收程度。
综合以上结果表明,在-半乳糖刺激后,氧化模型组肝脏中抗氧化酶活性显著下降,而添加了接种发酵香肠源多肽后,可以使抗氧化酶 SOD、CAT恢复到正常水平,但是对GSH-PX活性的作用效果不显著,深入分析得出接种发酵香肠抗氧化肽能限制活性氧类氧化损伤,直接清除自由基,维持机体功能。

表4 接种发酵香肠源多肽对小鼠肝脏抗氧化酶的影响(n=6)Table 4 Effect of peptides from starter fermented sausage on antioxidant enzyme activities in liver of mice (n = 6)
2.2.3.2 接种发酵香肠源粗肽液对小鼠肝脏氧化物质积累的影响
MDA水平间接反映组织中脂质过氧化的程度。由图3可知,氧化模型组雄雌小鼠肝脏中的MDA含量达到4 nmol/mg左右(<0.05),而低肽添加组、VC对照组及高肽添加组小鼠肝脏MDA含量分别比氧化模型组降低了48%、55%和68%(<0.05)。这说明-半乳糖氧化促使细胞产生过量氧活性自由基,使氧化模型组小鼠肝脏MDA含量显著增加,与前文结果一致。而添加接种发酵香肠源多肽恢复效果甚至优于添加 VC组,都可以避免体内脂质过氧化物的不断积累,有效减轻肝脏的脂质过氧化损伤,具有显著的抗氧化作用。值得注意的是,添加发酵香肠源粗肽液后,小鼠MDA含量显著减少,但均不能使其恢复到正常状态,这与Xu Fangzhi和马丽艳等的实验结果一致。说明抗氧化剂只能在一定程度上减轻-半乳糖造成的氧化损失,并不能完全抑制脂质氧化。从抗氧化基因表达上看,王丽英发现花生四烯酸代谢生物通路可能会影响玉米抗氧化肽氧化作用,通过抑制基因表达提高修复产物的水平。但在体内发酵香肠抗氧化肽发挥抗氧化效应的途径仍需深入研究,可以通过体外细胞培养和荧光定量等手段,在细胞和基因水平上探讨抗氧化肽的构效关系和发挥作用的机制。

图3 接种发酵香肠源抗氧化肽对小鼠肝脏氧化物质积累的影响Fig. 3 Effect of peptides from starter fermented sausage on MDA level in liver of mice
3 结 论
研究对接种发酵香肠源多肽的体内外抗氧化作用进行了较为系统的评价。体外抗氧化实验结果表明,接种发酵增强了香肠粗肽液的DPPH自由基、羟自由基清除活性和Fe螯合能力,达到强于GSH的水平。发酵剂会增强香肠多肽的体外抗氧化活性。体内动物实验发现,接种发酵香肠抗氧化肽能够提高小鼠脾脏指数,增强血清和肝脏SOD、CAT、GSH-PX特征抗氧化酶活性和T-AOC,减少MDA生成,减缓氧化损伤,最终表明其具有良好的抗衰抗氧化作用,为发酵香肠抗氧化肽作为天然抗氧化剂提供了参考依据。虽然推测接种发酵香肠源粗肽液作用机制是可以直接抑制自由基的产生,相应地减少SOD、CAT、GSH-PX消耗,保护抗氧化防御系统,但具体的通路还需要更多验证。
