群体感应系统对单增李斯特菌生物被膜形成的影响
2022-10-09张心怡陆兆新郑丽平吕紫岩周立邦孟凡强别小妹
张心怡,陆兆新,郑丽平,吕紫岩,周立邦,孟凡强,别小妹
(南京农业大学食品科学与技术学院,江苏 南京 210095)
单增李斯特菌()是一种食源性致病菌,在许多食品供应链中普遍存在,能够在低水分活度、高渗透环境和低温等条件下生存。单增李斯特菌能够引起脑膜炎、败血症等严重的李斯特菌病,给食品工业造成经济损失,对人类健康造成严重威胁。细菌生长过程中形成的生物被膜是病原体的持久来源,它使细菌对消毒剂等耐受性变强,能够耐受高渗环境和冷冻环境等,对食品安全造成严重威胁。在食品工业中,控制单增李斯特菌生物被膜的形成是防止其污染的重要环节。
生物被膜的形成过程包含多种复杂的调控机制,其中群体感应系统对细菌生物被膜形成的调控研究是当前微生物学研究的热点。在革兰氏阳性菌中广泛存在着两种群体感应系统,即依赖于的群体感应系统和LuxS/AI-2系统,这两个系统在单增李斯特菌的生物被膜形成中发挥重要作用。其中,Agr系统由编码蛋白质的4 种基因组成:膜蛋白AgrB负责将信号前体AgrD转化为自诱导肽AIP并将其转运至胞外,AgrCA是一个双组分系统,其中AgrC为组氨酸蛋白激酶,它能够识别AIP,然后信号被转录调节因子AgrA转导到下游基因,包括生物被膜形成的基因和毒力因子。基因编码的LuxS酶是一种甲基循环必需的酶,AI-2是LuxS酶在活化甲基环中合成的4,5-二羟基-2,3-戊二酮自发环化形成的一组互相转化的信号分子。当AI-2积累到一定浓度后便与受体结合从而激活群体感应系统,调控生物被膜、抗生素耐药性等相关基因的表达。
当环境中细菌浓度达到一定阈值时,群体感应系统能够调控菌体中相关基因的表达,从而调控多种生物行为,包括细菌生物被膜的形成、耐药性等,增强了细菌对不利环境的耐受性,使其在食品加工环境中变得难以清除,所以干扰群体感应系统是控制生物被膜形成的一个新方向。因此,本研究通过探索单增李斯特菌群体感应系统对其生物被膜形成的调控机制,旨在为控制单增李斯特菌的污染提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌JM109、穿梭载体pKSV7(Amp)质粒均由本实验室保存;单增李斯特菌LMB33426、FSIS57034菌株由合作单位赠送,本实验室保藏;ATCC19116菌株美国菌种保藏中心;CICC21662菌株 中国工业微生物菌种保藏管理中心;JM110 Chemically Competent Cell上海唯地生物技术有限公司;pMD18-T 宝日医生物技术(北京)有限公司。
1.1.2 培养基与试剂
Luria-Bertani(LB)培养基:10 g/L蛋白胨、5 g/L酵母粉、10 g/L NaCl;脑心浸出液(brain heart infusion,BHI)培养基、肉汤培养基(Mueller-Hinton broth,MHB)北京索莱宝科技有限公司。
Zol UpRNA Kit 提取试剂盒 北京全式金生物技术有限公司;HiScriptII Q RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒、AceQ qPCR SYBR Green Master Mix(High ROX Premixed)荧光聚合酶链式反应(polymerase chain reaction,PCR)试剂盒南京诺唯赞生物科技有限公司;细菌基因组DNA提取试剂盒 南京丁贝生物科技有限公司;限制性核酸内切酶I、I 美国赛默飞公司。
1.1.3 引物
本研究引物见表1。

表1 本研究所用的引物Table 1 Primers used in this study
1.2 仪器与设备
T1300II级生物安全柜 美国赛默飞公司;Step One Plus荧光定量PCR仪 美国ABI公司;MicroPulser电穿孔仪 美国Bio-Rad公司;JS-380c全自动数码凝胶成像分析仪 上海培清科技有限公司。
1.3 方法
1.3.1 real-time PCR测定群体感应系统基因在生物被膜形成各时期的表达量
37 ℃在LB培养基中分别静置和180 r/min振荡培养生物被膜态和游离态的4 株单增李斯特菌细胞,在培养时间为12、24、36、48 h时分别收集细胞,提取总RNA后使用反转录试剂盒合成cDNA。以16S rRNA为内参基因,选择群体感应基因///及基因进行realtime PCR验证,每个基因做3 个平行,采用2的方法计算基因的相对表达量,比较目的基因在单增李斯特菌生物被膜态和浮游态中的表达差异。
1.3.2 Δ突变株和Δ突变株的构建
用细菌总DNA提取试剂盒提取LMB33426菌株的基因组,然后分别使用基因和基因的引物对F/R和F/R扩增上、下游同源臂片段。PCR产物经1%琼脂糖凝胶电泳检测正确后进行凝胶回收。以F/R为引物,通过重叠延伸PCR构建上下游同源臂的融合片段。将融合片段与pMD19-T载体连接并转化至大肠杆菌JM109中。将PCR验证后的阳性转化子与pKSV7质粒同步双酶切,纯化后相连接并转化至JM109中。对验证为阳性的转化子进行抽提质粒,转化至JM110中以去甲基化。将通过PCR验证以及测序正确的重组穿梭质粒命名为pKSV7-Δ、pKSV7-Δ,用电转化的方法将重组穿梭质粒导入LMB33426感受态细胞中。通过41 ℃氯霉素的双重压力诱导其发生同源重组,然后在30 ℃无抗条件下连续传代以丢失质粒。通过影印平板法筛选得到对抗生素敏感的菌株,进行PCR以及测序验证得到Δ突变株和Δ突变株。
1.3.3 野生株和突变株生物被膜形成能力的测定
通过96 孔板结晶紫染色法对生物被膜进行定量分析,具体如下:将LMB33426野生株和突变株接种于BHI培养基中,37 ℃、180 r/min振荡培养至对数生长期并调节菌液的OD为0.5(10CFU/mL)。按1%接种量接种至BHI培养基后,每孔200 μL加入到96 孔板中。培养12、24、36、48、60、72 h后,弃去培养基并加入200 μL的磷酸盐缓冲液洗涤3 次。干燥后每孔加入200 μL的0.1%结晶紫染液染色30 min,然后用磷酸盐缓冲液(phosphate buffered saline,PBS)洗去浮色。风干后每孔加入200 μL 95%乙醇溶液溶解结晶紫,室温放置15 min后,用酶标仪在595 nm波长处测定样品OD值。生物被膜生成量由样品和空白对照OD值之间的差值表示。
1.3.4 激光共聚焦显微镜观察野生株和突变株的生物被膜
调节培养至对数生长期的LMB33426野生株和突变株的菌液OD为0.5(10CFU/mL)。在NEST玻底培养皿中加入2 mL新鲜的BHI培养液,再加细菌悬液100 μL。37 ℃培养36 h后,使用PBS冲洗2 次,室温下在黑暗中用SYTO 9(染色活细胞)20 μmol/L和碘化丙啶(propidium iodide,PI,染色死细胞)30 μmol/L溶液的混合物200 μL对生物被膜染色30 min。然后使用具有488 nm和560 nm激发波长的激光共聚焦显微镜扫描染色的生物被膜。
1.3.5 野生株和突变株运动能力的测定
运动能力由试管穿刺实验以及细菌泳动性、爬动性结果评估,泳动性和爬动性的测定参照已有研究方法。
1.3.5.1 试管穿刺实验
用接种针蘸取培养至对数期的LMB33426野生株和突变株的菌液,穿刺接种于含0.3%琼脂的半固体试管中,分别在37 ℃和30 ℃下培养36 h观察穿刺线周围细菌扩散情况。
1.3.5.2 野生株和突变株的泳动性和爬动性
用接种针蘸取培养至对数期的LMB33426野生株和突变株的菌液,刺入琼脂含量0.3%的泳动平板和0.5%的爬动平板,分别在37 ℃和30 ℃恒温培养箱中正置培养36 h观察运动情况;用游标卡尺测量每株菌的扩散圈直径。
1.3.6 野生株和突变株疏水性的测定
用BATH法测定单增李斯特菌细胞表面疏水性:将LMB33426野生株和突变株分别接种于20 mL LB液体培养基中,37 ℃恒温静置培养36 h。将菌液以10 000×离心5 min并弃去上清液。用0.1 mol/L PBS重悬后再10 000×离心5 min,反复洗涤2 次。然后将沉淀重悬于0.1 mol/L PBS,调节其OD值为0.9±0.05,记为OD;每取4 mL样品,向其中加入1 mL二甲苯,剧烈振荡120 s后37 ℃静置30 min。待体系分层后,测得下层水相在540 nm波长处的OD值并记为OD;由此,细胞疏水性可由下式计算:

1.3.7 野生株和突变株耐药性的测定
1.3.7.1 野生株和突变株浮游态下耐药性的测定

表2 本研究中使用的抗生素Table 2 Antibiotics used in this study
本实验测定单增李斯特菌对10 种抗生素(表2)的敏感性,采用二倍稀释法制备药敏培养孔板,将培养至对数期的LMB33426野生株和突变株的菌液用MHB培养基稀释100 倍,每孔50 μL接种于药敏平板中,37 ℃静置培养24 h。测定每孔的OD值,以OD<0.1且抗生素浓度最低孔中对应的抗生素浓度作为此抗生素的最小抑菌浓度(minimal inhibitory concentration,MIC)。选取抗生素浓度大于MIC且澄清透明的孔,吸取50 μL涂布在LB琼脂平板上,37 ℃静置培养24 h后进行菌落计数,以单菌落数小于3 个对应的最低抗生素浓度,作为此抗生素的最小杀菌浓度(minimal bactericidal concentration,MBC)。
1.3.7.2 野生株和突变株被膜态下耐药性的测定
将培养至对数期的LMB33426野生株和突变株菌液用MHB培养基稀释1 000 倍,每孔200 μL接种于96 孔板中,37 ℃恒温静置培养36 h。培养完成后弃去培养基并用无菌水清洗3 次,在超净工作台中晾干代用。同时制备药敏平板,将培养基和抗菌药物的混合液对应加入已经清洗和晾干的96 孔细胞培养板中,37 ℃恒温静置培养24 h,并按上述方法判定MIC和MBC。
1.4 数据处理
采用Microsoft Excel软件进行数据处理,采用GraphPad Prism 8软件作图,采用IBM SPSS Statistics 19软件进行方差分析。
2 结果与分析
2.1 单增李斯特菌群体感应系统基因在生物被膜形成各时期的表达量
4 株菌在不同生长时期群体感应各基因的表达量见图1。在前期研究的基础上,获得了4 株生物被膜形成能力不同的单增李斯特菌,其强弱顺序分别是LMB33426、FSIS57034、ATCC19116、CICC21662。通过分析发现,在强生物被膜形成能力菌株LMB33426中,被膜态的、基因表达量显著高于浮游态。培养24 h,在被膜态细胞中的表达量比浮游态提高了36 倍,在第36小时,基因在被膜态细胞中的表达量比浮游态提高31 倍,这表明它们可能在生物被膜形成的过程中起到了正向调控的作用。另外,基因和基因在不同生长阶段的表达量相对浮游态无明显提高,而基因在生长过程中的相对表达量均低于浮游态(图1A)。在FSIS57034菌株中,培养时间为24 h,基因的相对表达水平比浮游态高21 倍;培养时间为36 h和48 h,基因的相对表达水平分别比浮游态高2.6 倍和5.8 倍;总体来看,//的相对表达水平低于浮游菌(图1B)。在2 株生物被膜形成能力弱的菌株中,ATCC19116菌株的基因在36 h相对表达水平最低,是浮游态的2%(图1C)。在CICC21662菌株中,从总体来看基因的相对表达量最低,其次是基因和基因(图1D)。综上,可以看出,在强生物被膜形成能力的菌株当中,和基因相对表达量较高。在生物被膜形成的过程中,和基因可能发挥着主要的正向调控作用,通过构建基因缺失株来进一步研究群体感应系统在单增李斯特菌生物被膜形成过程中的调控作用。

图1 不同培养时间下4 株单增李斯特菌的群体感应基因表达情况Fig. 1 Expression of quorum sensing genes in four L. monocytogenes strains at different culture times
2.2 单增李斯特菌ΔagrD突变株和ΔluxS突变株的构建
通过PCR鉴定突变株的构建是否成功,使用引物-F/R扩增野生株时,目的条带为1 531 bp(图2泳道1),扩增Δ缺失株基因组获得片段为1 122 bp(图2泳道2);使用-F/R引物扩增野生株的基因组时,目的片段为1 348 bp(图2泳道3),扩增Δ缺失株基因组获得片段为1 186 bp(图2泳道4)。对所获得的PCR产物进行测序,结果表明单增李斯特菌-Δ和-Δ构建成功。
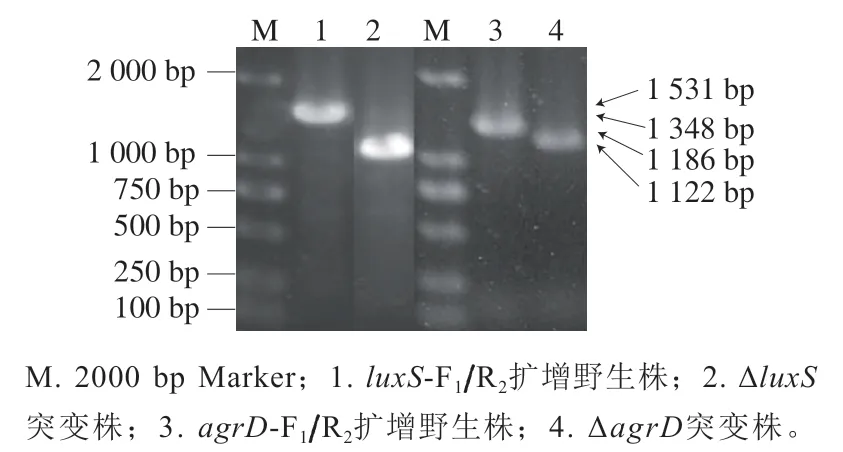
图2 单增李斯特菌突变株ΔluxS和ΔagrD的PCR鉴定Fig. 2 PCR identification of L. monocytogenes mutant strains ΔluxS and ΔagrD
2.3 单增李斯特菌野生株和突变株生物被膜形成能力
图3表明,与野生株LMB33426相比,Δ基因突变株的生物被膜形成能力减弱,Δ基因突变株的生物被膜形成能力显著下降。这3 株菌的生物被膜形成能力在前36 h的培养过程中均表现为上升的趋势,在培养至36 h生物被膜形成能力最强,36 h后生物被膜形成能力开始下降。培养时间为24 h,Δ和Δ突变菌株的生物被膜形成能力下降显著,与野生株存在极显著差异(<0.01);培养时间为48 h和60 h,Δ基因突变株的生物被膜形成能力均显著低于野生株。在培养时间为24~60 h区间内,Δ基因突变株的生物被膜形成能力也显著低于野生株。在培养时间达到72 h,不同菌株生物被膜形成能力之间的差异消失,且生物被膜生成量较低,这可能是此时已到达生物被膜的脱落阶段。

图3 野生株和基因突变株生物被膜形成能力Fig. 3 Biofilm formation ability of wild-type and mutant strains
2.4 激光共聚焦显微镜观察野生株和突变株的生物被膜
通过SYTO 9和PI荧光染料染色,可使生物被膜中的活菌呈绿色荧光,而受损或死亡细胞呈红色荧光。对生物被膜进行荧光染色后发现LMB33426野生株形成的生物被膜厚度较厚,结构紧密,部分连成片(图4)。与野生株相比,Δ菌株绿色荧光的数量及密集程度比野生株低,形成的生物被膜厚度均匀且较野生型薄;Δ菌株绿色荧光的数量及密集程度明显降低,形成的生物被膜分散,且显著少于野生株。

图4 激光共聚焦显微镜观察野生株和基因突变株的生物被膜Fig. 4 CLSM Observation of biofilms formed by wild-type and mutant strains
2.5 单增李斯特菌野生株和突变株运动能力
试管穿刺实验中(图5A),在37 ℃下Δ和Δ突变株的穿刺线周围都有明显的白色扩散圈,且Δ突变株的扩散范围明显宽于野生株,说明基因的缺失导致LMB33426菌株在37 ℃下的运动性增强;在30 ℃下,野生株和突变株的穿刺线周围有白色扩散圈,且3 株菌的扩散范围接近,说明该温度下群体感应系统对LMB33426的运动性未产生显著影响。
泳动及爬动实验中,在37 ℃下,Δ和Δ基因突变株在0.3%的半固体培养基上都能够形成泳动圈,且扩散范围宽于野生株LMB33426(图5B)。Δ基因突变株在37 ℃下形成的泳动圈直径显著宽于野生株,表现出比野生株更强的泳动能力(图5C),这表明在37 ℃时、基因的缺失使得LMB33426菌株的运动性增强。在30 ℃时,Δ和Δ突变株穿刺线周围的扩散范围与野生株无显著差异,这表明在30 ℃时野生株及基因缺失株的运动性无明显差异(图5B、C)。另外,野生株和基因缺失株在37 ℃和30 ℃下都不能形成爬动圈(图5B、B)。

图5 野生株和基因突变株运动能力Fig. 5 Swimming motility of wild-type and mutant strains
2.6 单增李斯特菌野生株和突变株疏水性的测定
2 个基因突变菌株的疏水性均低于野生株,其中Δ基因突变株的疏水性与野生株无显著差异,而Δ基因突变株的疏水性极显著低于野生株(<0.01)(图6),这与3 株菌生物被膜形成能力的趋势一致。以上结果表明,群体感应系统可能通过改变菌株的疏水性调节其生物被膜的形成能力。
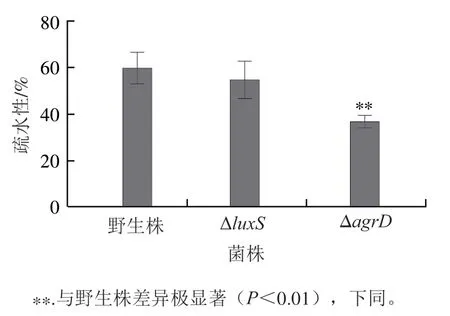
图6 野生株和基因突变株疏水性的测定Fig. 6 Hydrophobicity of wild-type and mutant strains
2.7 单增李斯特菌野生株和突变株耐药性的测定
野生株和突变株对各抗生素的MIC及MBC值见图7。单增李斯特菌对喹诺酮类和氨基糖苷类、四环素类抗生素比较敏感,如CIP和GEN、OT比较敏感,对-内酰胺类抗生素、磺胺类抗生素比较耐受,如CRO、CFP、SF。、基因的缺失使得菌株在浮游态和生物被膜态下对SF的MIC值显著降低。另外,基因的缺失使得菌株对头孢曲松钠的MIC及MBC值降低。但是整体来看,和基因的缺失并没有对菌体的耐药性产生显著的影响。


图7 野生株和基因突变株MIC值及MBC值Fig. 7 MIC and MBC values of antibiotics against wild-type and mutant strains
3 讨 论
单增李斯特菌可引起人畜共患病,给人类社会带来严重的威胁。细菌的群体感应系统可以通过控制下游基因表达调控生物被膜的形成,病原菌由此可以依靠生物被膜防御各种环境压力。本研究通过real-time PCR发现,在强生物被膜形成能力菌株LMB33426的被膜态细胞中,和基因的表达量处于较高水平。故选其为研究对象,通过同源重组的方法构建群体感应系统基因突变株,分析和基因在单增李斯特菌生物被膜形成过程中的调控作用。
本实验通过结晶紫染色法和激光共聚焦显微镜对LMB33426野生株和Δ突变株、Δ突变株的生物被膜形成能力进行测定和观察。结果显示,基因的缺失会使LMB33426菌株在培养12~60 h内生物被膜形成能力显著降低。通过激光共聚焦显微镜观察发现,Δ突变株形成的生物被膜比野生株疏松且厚度降低。有研究表明,基因缺失会导致细胞在玻璃表面的黏附能力受损,且生物被膜形成能力降低,这表明Agr系统可能参与单增李斯特菌的初期黏附过程调控生物被膜的形成。另外,通过构建缺失株发现,在培养24、48、60 h突变株生物被膜形成能力均减弱。而有研究表明,单增李斯特菌基因缺失后生物被膜形成量显著增加,通过添加外源AI-2对其生物被膜的形成不产生影响。在Δ突变株培养液的上清液中能够累积大量AI-2的前体物质S-核糖同型半胱氨酸,这使得单增李斯特菌黏附能力增强,从而调节其生物被膜的形成。本研究缺失基因并没有导致生物被膜形成量增加,这可能是由于不同菌株的特征导致生物被膜形成能力表现出菌株差异性。此外,单增李斯特菌生物被膜的形成还受到基质组分以及第二信使信号分子等多种调控的影响,单增李斯特菌生物被膜形成过程中的分子调控机制还需要深入研究。
除影响生物被膜的形成,群体感应系统还参与细菌运动能力的调节。目前关于运动性与生物被膜形成能力之间的关系没有统一定论。此前有研究表明,鞭毛运动在单增李斯特菌的黏附和生物被膜形成中发挥作用,单增李斯特菌运动性的丧失将导致生物被膜形成能力减弱。而在本研究中,Δ突变株在琼脂含量为0.3%的半固体培养基上表现出比野生株更强的泳动能力。也有研究表明,单增李斯特菌的运动性与生物被膜的形成能力并不呈正相关。相反,单增李斯特菌在不锈钢上形成生物被膜的能力与其泳动能力之间呈负相关。另外,将LMB33426菌株的基因敲除后发现并未影响菌株的运动能力,这与Belval等的结果相同。
细菌对接触表面的附着不仅受到鞭毛和运动性的影响,还受到微生物疏水性等的影响。单增李斯特菌在聚苯乙烯表面的生物被膜形成能力与细胞表面疏水性呈正相关关系。本研究基因突变株的疏水性显著弱于野生株,基因突变株的疏水性与野生株无显著差异,这与它们的生物被膜形成能力趋势相同。这可能是由于细胞在接触面的附着能力随表面疏水性的增加而增加,生物被膜的形成量从而增加。因此,本研究结果提示缺失基因和基因可能会导致单增李斯特菌黏附能力下降,进而导致生物被膜形成能力发生变化。群体感应系统还对菌体的耐药性产生影响,但本研究和的缺失没有对耐药性产生显著的影响,其具体机制仍有待进一步的研究。
通过前期研究获得了生物被膜形成能力不同的4 株单增李斯特菌,real-time PCR表明及基因可能是单增李斯特菌生物被膜形成的关键调控基因。通过同源重组成功构建了群体感应系统基因缺失株Δ及Δ。结晶紫染色实验及激光共聚焦显微镜观察结果表明,群体感应系统基因的缺失会使LMB33426菌株的生物被膜形成能力减弱。另外,LMB33426菌株的生物被膜形成能力与菌株的疏水性有密切关系。近年来,通过抑制群体感应开发新型抗菌疗法已经引起研究者的广泛关注。群体感应抑制剂能够在不抑制细菌生长的条件下,影响细菌的群体感应系统进而抑制其生物被膜的形成,实现对食源性致病菌的控制。因此可以通过作用于群体感应系统,进而控制生物被膜的形成以减少单增李斯特菌在食品工业中的污染,本研究为在食品工业中更有效防止单增李斯特菌污染、控制生物被膜形成提供新的理论支持。
