以不同体外模拟系统评价大豆蛋白的胃消化特性
2022-10-09吴凯云徐子惠杨晓泉孟赫诚
吴凯云,徐子惠,郭 健,杨晓泉 ,孟赫诚
(华南理工大学食品科学与工程学院,食物蛋白与胶体研究中心,广东省天然产物绿色加工与产品安全重点实验室,广东 广州 510640)
日益增长的世界人口与有限的自然资源之间的矛盾已成为全球化问题,而动物性食品生产比植物性食品生产需要消耗更多的自然资源,同时会排放更多的温室气体。除了可持续发展与环境压力,动物蛋白对健康的负面影响和动物福利等因素也是“植物基”风潮掀起的主要驱动力。人们尝试以植物蛋白代替动物蛋白,目前已有许多基于植物蛋白的产品被开发以替代肉类或其他动物制品。尽管取得了初步成功,但植物性替代品仍然面临诸多挑战,其食品安全特性和营养问题还未得到充分解决。目前,尚未明确植物蛋白在人体中发挥健康效应的作用机制。
研究食物的健康效应,有必要研究食物在人体胃肠道消化过程中的变化。食物的消化是一个复杂的过程,食物经口腔咀嚼形成食糜进入消化道,消化道主要发生两方面的作用:机械分解作用,包括口腔咀嚼和胃蠕动;酶促转化作用,人体胃肠道内存在多种酶,会将大分子物质水解为可以被小肠上皮细胞吸收的小分子物质。植物蛋白经胃肠消化后转化为小分子多肽,在人体中起健康效应的是多肽而不是蛋白本身。因此,要剖析植物蛋白的健康效应,需首先理解植物蛋白在胃肠道的水解过程和变化。
近年来,多个体外消化模型已被广泛应用于研究食物在胃肠道消化过程中的变化及其对人体健康的影响。INFOGEST组织于2014年提出了一套标准化的、适用于各种研究目的、模拟成人消化的体外静态模型,并于2019年发布了INFOGEST 2.0版本。在每个消化阶段,该体外静态消化实验均在恒定pH值和酶浓度下进行。此模型具有简单、易操作,可以有效预测结果的特点,但也存在一些局限性;此模型过分简化了消化生理过程,未能模仿消化过程的动态方面,比如消化液的连续分泌,胃排空等动力学。Kong等在2010年开发的HGS模型模拟了胃消化的动态过程,可用于研究胃消化过程中酸和酶的分泌及收缩力等生理条件对食物分解动力学和营养物质释放的影响。但该模型的构建比较复杂,且设备昂贵,维护成本较高,不具备普适性。基于上述因素,Mulet-Cabero等在INFOGEST体外静态模型的基础上提出半动态消化模型,对复杂的动态模型进行简化,特别关注了胃消化阶段的关键动力学。该模型虽然不能模仿胃部的蠕动收缩,但可以实现HGS模型中的连续胃分泌和胃排空的机制,并可以提供营养物质消化和结构变化的动力学数据。此外,大部分实验室都具备构建该模型的条件。
大豆是优质蛋白的主要来源,是中国膳食模式的重要组成部分,其加工产物大豆蛋白,产量大、价格低廉、氨基酸组成合理,是最广泛用作植物基产品开发的植物蛋白之一。因此,本研究以大豆蛋白为研究对象,分别采用INFOGEST静态消化模型和半动态消化模型评价经透析处理和未经透析处理的大豆蛋白的胃消化特性,并比较两种消化模型的适用性,为研究植物蛋白的健康效应提供一定参考。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕 山东御馨生物科技有限公司。
胃蛋白酶(酶活力≥2 500 U/mg),α-淀粉酶(酶活力≥500 U/mg)、Nα-苯甲酰-L-精氨酸-4-硝基苯胺盐酸盐西格玛奥德里奇(上海)贸易有限公司;邻苯二甲醛(o-phthalaldehyde,OPA) 源叶生物科技有限公司;其他试剂均为分析纯;所有实验用水均为去离子水。
1.2 仪器与设备
CR 22GII高速离心机 日本Hitachi公司;Rapid N Cube杜马斯定氮仪 德国Elementar公司;888型pH电位滴定仪 瑞士Metrohm公司;LSP01-1A微量注射泵河北保定兰格恒流泵有限公司;TS-3D圆周旋转摇床江苏海门其林贝尔仪器制造有限公司;DYCZ-24KF四板垂直电泳仪 北京六一生物科技有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 大豆蛋白的制备与理化性质测定
将粉碎的脱脂豆粕与去离子水以1∶10(g/mL)混合,用2 mol/L NaOH溶液调pH值至8.0,室温下低速搅拌2 h,8 000 r/min离心20 min后,取上清液冷冻干燥,得到未透析的大豆蛋白(SP-ND),室温保存备用。将上述上清液装入透析袋(截留分子质量14 kDa),在去离子水中于4 ℃透析48 h后冷冻干燥,得到透析的大豆蛋白(SP-D),室温保存备用。
用杜马斯燃烧法测定两种蛋白的蛋白含量。称取约100 mg样品于锡箔纸上,经包裹、压片置于杜马斯定氮仪的自动进样盘中。仪器燃烧管温度960 ℃;二级燃烧管温度800 ℃;还原管温度810 ℃;二氧化碳压力1 200~1 250 mbar;流速650 mL/min。
参考Gao等的方法测定大豆蛋白的植酸含量。称取样品0.5 g,用2.4%盐酸溶液(m/m)配成25 mg/mL大豆蛋白溶液,搅拌1 h,5 000 r/min离心15 min。取上清液加入1.0 g NaCl,搅拌20 min,4 ℃静置1 h,再5 000 r/min离心15 min。取0.5 mL上清液,加入4.5 mL去离子水和4.0 mL显色液(0.03%六水三氯化铁+0.3%二水合-5-磺基水杨酸),混匀,静置20 min,在500 nm波长处测定吸光度。配制梯度质量浓度植酸溶液(0、0.01、0.02、0.04、0.06、0.08、0.1 mg/mL),取1.0 mL植酸溶液,按上述方法测定吸光度,根据质量浓度与吸光度绘制植酸标准曲线。
参考王英男等和华蕾的方法测定大豆蛋白的胰蛋白酶抑制剂活性。
1.3.2 体外模拟静态消化模型的建立
根据Brodkorb等的方法建立体外模拟INFOGEST静态消化模型,并略作改动。将适量大豆蛋白分散于去离子水中配成3.6%蛋白溶液(m/m),室温搅拌2 h,将pH值调为7.0。取5.0 g蛋白溶液与模拟唾液(simulated salivary fluid,SSF)1∶1(g/mL)混合,其中α-淀粉酶在整个体系中的酶活力为75 U/mL,在37 ℃水浴中保温2 min。然后与模拟胃液(simulated gastric fluid,SGF)1∶1(V/V)混合,在加入胃蛋白酶前将pH值调至3.0,胃蛋白酶在整个体系的酶活力为2 000 U/mL,在37 ℃水浴中分别反应不同时间(0、5、10、30、60、90、120 min)。最后用2 mol/L NaOH溶液将pH值调至7.2终止反应,在-20 ℃放置保存。SSF与SGF模拟消化液的成分如表1所示。
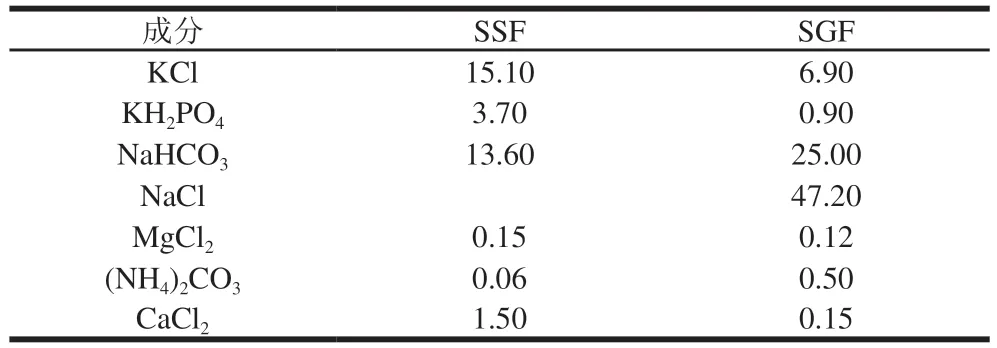
表1 SSF与SGF模拟消化液的组成Table 1 Composition of SSF and SGF mmol/L
1.3.3 体外模拟半动态消化模型的建立
根据Mulet-Cabero和Ye Anqian等的方法建立体外模拟半动态消化模型,并略作改动。如图1所示,该模型用于模拟胃部的半动态消化。pH电位滴定仪恒定滴加SGF(pH 1.5)并记录消化过程中的pH值变化,用微量注射泵滴加胃蛋白酶溶液,3D圆周旋转摇床模拟胃糜的混合,水浴循环泵模拟37 ℃的恒温环境。将适量大豆蛋白分散于去离子水中配成3.6%蛋白溶液(m/m),室温搅拌2 h,将pH值调为7.0。取50 mL蛋白溶液与10 mL SSF(用NaCl代替NaHCO,下述SGF同)混合,37 ℃反应2 min,然后与17.5 mL基础胃液(模拟禁食状态,含14 mL SGF和3.5 mL胃蛋白酶溶液)混合,反应开始并计时。SGF流速0.5 mL/min,胃蛋白酶溶液质量浓度5 mg/mL(酶活力为1 101 U/mL),流速0.125 mL/min,排空速率为0.75 mL/min,每隔15 min从容器底部取样模拟排空,即排空内容物。将排空内容物的pH值调为7.2终止反应,冷冻干燥,然后称其质量,将不同时间点排空内容物的质量累加计算排空程度。
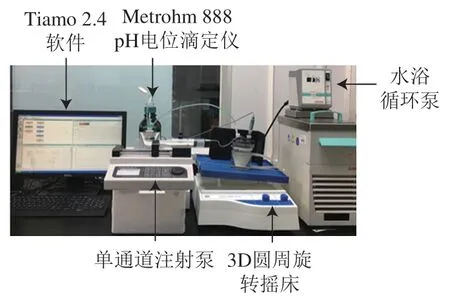
图1 半动态消化模型Fig. 1 Photograph of semi-dynamic digestion system
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测定
根据Laemmli的方法,并略作改动。在还原条件下,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析消化产物的分子组成。将样品稀释液与上样缓冲液、去离子水混合,然后放入沸水中加热5 min。采用DYCZ-24KF四板垂直电泳仪,胶板厚度1.5 mm,分离胶质量分数12%,浓缩胶质量分数5%,上样量15 μL。于恒压下进行电泳,样品在浓缩胶中电压80 mV,进入分离胶后调为120 mV。采用0.1%考马斯亮蓝R250对胶片进行染色30 min,之后使用乙醇乙酸脱色液(乙醇∶乙酸∶水=100∶100∶800,V/V)进行脱色。
1.3.5 消化产物的游离氨基含量测定
根据Duque-Estrada等的方法,采用OPA法测定游离氨基含量。取200 μL稀释后的样品,与1.5 mL OPA试剂混合,避光反应3 min,在340 nm波长处测定吸光度。
配制梯度质量浓度丝氨酸溶液(0、0.02、0.04、0.06、0.08、0.1 mg/mL),取200 μL丝氨酸溶液,按上述方法测定吸光度,绘制丝氨酸标准曲线。
1.3.6 静态消化产物中不溶性蛋白含量测定
将5%三氯乙酸溶液加入到静态消化产物溶液中(1.66∶1,V/V),以10 400 r/min离心20 min,弃上清液,将沉淀烘干,冷却后称量其质量直至质量无变化。
1.4 数据处理
所有实验得到的数据用SPSS 23.0软件进行单因素方差分析检验(P<0.05)。每个样品平行测定3 次,所有实验重复两次,用Origin 2019 b软件作图。
2 结果与分析
2.1 两种大豆蛋白的基本理化性质
如表2所示,SP-ND的蛋白质量分数为(58.24±0.84)%,SP-D的蛋白质量分数为(81.07±0.57)%。未经酸沉制备的大豆蛋白保留了较多碳水化合物、矿物质等成分,因此,本研究制得两种大豆蛋白的蛋白含量明显低于大豆分离蛋白含量(约90%)。此外,透析可将盐离子、低聚糖等小分子物质除去,故SP-D的蛋白含量高于SP-ND。
从表1可知,透析对大豆蛋白的植酸含量有一定影响。王睿粲研究发现生豆乳中一部分植酸以游离的形式存在,一部分植酸倾向于通过Ca/Mg与大豆蛋白7S组分结合,所以透析可能减少大豆蛋白中游离植酸含量。此外,两种大豆蛋白的胰蛋白酶抑制剂活性差异显著。大豆中的胰蛋白酶抑制剂主要有两种,Kunitz型(KTI)和Bowman-Brik型抑制剂(BBTI),其分子质量分别为20 kDa和8 kDa。透析不能除去胰蛋白酶抑制剂,但随着蛋白质纯度的提高,胰蛋白酶抑制剂也被浓缩,因此SP-D的胰蛋白酶抑制活性高于SP-ND。

表2 大豆蛋白的基本理化性质Table 2 Physicochemical properties of SP-D and SP-ND
2.2 两种大豆蛋白静态消化产物的分析
2.2.1 SDS-PAGE分析
如图2所示,观察两种大豆蛋白消化后的电泳条带(泳道2~8),发现两种蛋白的条带变化趋势一致,7S的α(68 kDa)、α’(72 kDa)亚基在第10分钟消失,48~63 kDa之间的条带随着消化时间的延长强度逐渐增强,其原因在于α、α’亚基和β亚基(52 kDa)的核心区高度同源,α、α’亚基各具有一个带糖链的延展区,β亚基只有核心区。随着消化时间的延长,天然大豆分离蛋白的α、α’亚基的延展区被消化,抵抗消化的核心区富集在48~63 kDa之间。11S酸性多肽(28~42 kDa)的条带在第10分钟消失;碱性多肽(18~20 kDa)条带随着消化时间强度逐渐降低。消化结束时,第120分钟所对应的电泳条带主要是7S的β亚基和11S的碱性多肽,这与Santos-Hernández等的研究结果一致。在INFOGEST静态消化模型中,两种大豆蛋白经胃蛋白酶水解后,多肽组成和水解程度基本一致。
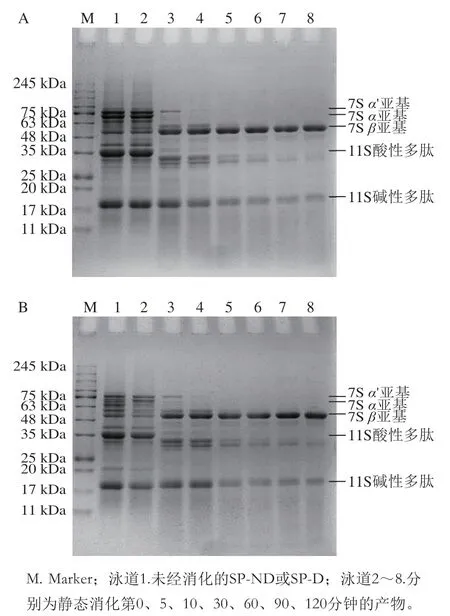
图2 SP-ND(A)和SP-D(B)的INFOGEST静态消化SDS-PAGE图谱Fig. 2 SDS-PAGE patterns of SP-ND (A) and SP-D (B) subjected to INFOGEST static digestion
2.2.2 游离氨基含量分析
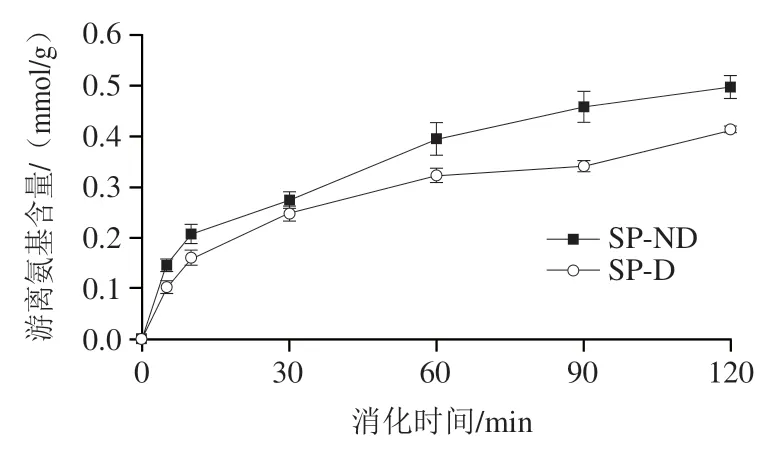
图3 大豆蛋白INFOGEST静态消化过程中游离氨基含量变化Fig. 3 Changes in free amino content during INFOGEST static digestion of soy protein
消化产物的游离氨基含量可以反映蛋白质的水解程度。如图3所示,SP-ND和SP-D的游离氨基含量在消化初期上升较快,尤其是消化前10 min,此后增长趋缓。消化结束时,SP-ND为(0.50±0.02) mmol/g,SP-D为(0.41±0.01)mmol/g。
2.2.3 不溶性蛋白质量浓度分析
如图4所示,两种大豆蛋白的消化产物经三氯乙酸处理后,发生聚集沉淀,其不溶性蛋白的质量浓度均随消化进程呈持续下降的趋势,这表明大豆蛋白被逐渐消化降解成多肽。在消化的前10 min,SP-ND和SP-D不溶性蛋白的质量浓度迅速下降,随后下降趋势变缓;消化120 min后,两者不溶性蛋白的质量浓度均为5.2 mg/mL。

图4 大豆蛋白INFOGEST静态消化过程中不溶性蛋白质量浓度的变化Fig. 4 Changes in insoluble protein content during INFOGEST static digestion of soy protein
由两种大豆蛋白静态消化产物的SDS-PAGE、游离氨基含量及不溶性蛋白质量浓度的结果分析可知,以INFOGEST静态消化模型对SP-ND和SP-D进行模拟胃消化,蛋白质逐渐水解成多肽;在此过程中,两者水解产物的组成基本一致,水解程度和消化速率基本相近。
2.3 两种大豆蛋白半动态消化产物的分析
2.3.1 半动态消化过程pH值及外观变化
如图5所示,SP-ND和SP-D的初始pH值在6.9左右,在整个消化过程中,SP-ND的pH值基本呈线性下降趋势;第120分钟,pH值下降至2.3。在消化的前75 min,SP-D的pH值几乎呈线性下降,此后pH值下降趋缓;第120分钟,pH值下降至1.8。在整个消化过程中,经过透析的大豆蛋白pH值均明显低于SP-ND。

图5 大豆蛋白半动态消化过程中pH值变化Fig. 5 pH changes during semi-dynamic digestion of soy protein

图6 大豆蛋白半动态消化过程中的外观图Fig. 6 Appearance of soy protein during semi-dynamic digestion
大豆蛋白的等电点为pH 5左右,pH值接近等电点时,蛋白质的表面电荷被屏蔽,在疏水相互作用下容易发生聚集。如图6所示,在消化开始时大豆蛋白溶液就出现大量沉淀。在Wang Xin等评估豆浆胃消化过程中结构变化的研究中也出现了类似的情况,豆浆在消化初期pH 6.59时发生了聚集,推测初期的沉淀可能是由胃蛋白酶的作用引起的。整个消化过程中沉淀的变化与pH值变化息息相关。由图5和图6可知,SP-ND在第15和30分钟时的pH值分别为5.5和5.1,均靠近等电点,所以这两个时间点均有大量沉淀;第45分钟pH值下降至4.6,远离等电点,沉淀明显骤减。SP-D类似,在第30分钟,沉淀明显骤减。由于SP-ND的pH值一直高于SP-D,在消化至第105分钟,SP-ND消化液仍然有较多沉淀且呈浑浊状态,而SP-D消化液澄清,仅底部能观察到少量白色沉淀。
2.3.2 SDS-PAGE分析
如图7所示,在排空内容物中,SP-ND的电泳条带在前45 min无明显变化,说明此时排空内容物中仍有大量未水解的蛋白质;第60分钟,各个亚基的条带颜色开始变浅;第75分钟,7S的α、α’亚基消失;第90分钟,11S的酸性多肽消失,直至消化结束时,7S的β亚基和11S的碱性多肽还有不同程度的保留。在排空内容物中,SP-D的电泳条带变化类似,只是在第45分钟,各亚基条带的颜色开始变浅。虽然消化结束时SP-ND和SP-D亚基组成相同,但SP-ND的消化进程至少比SP-D慢15 min。
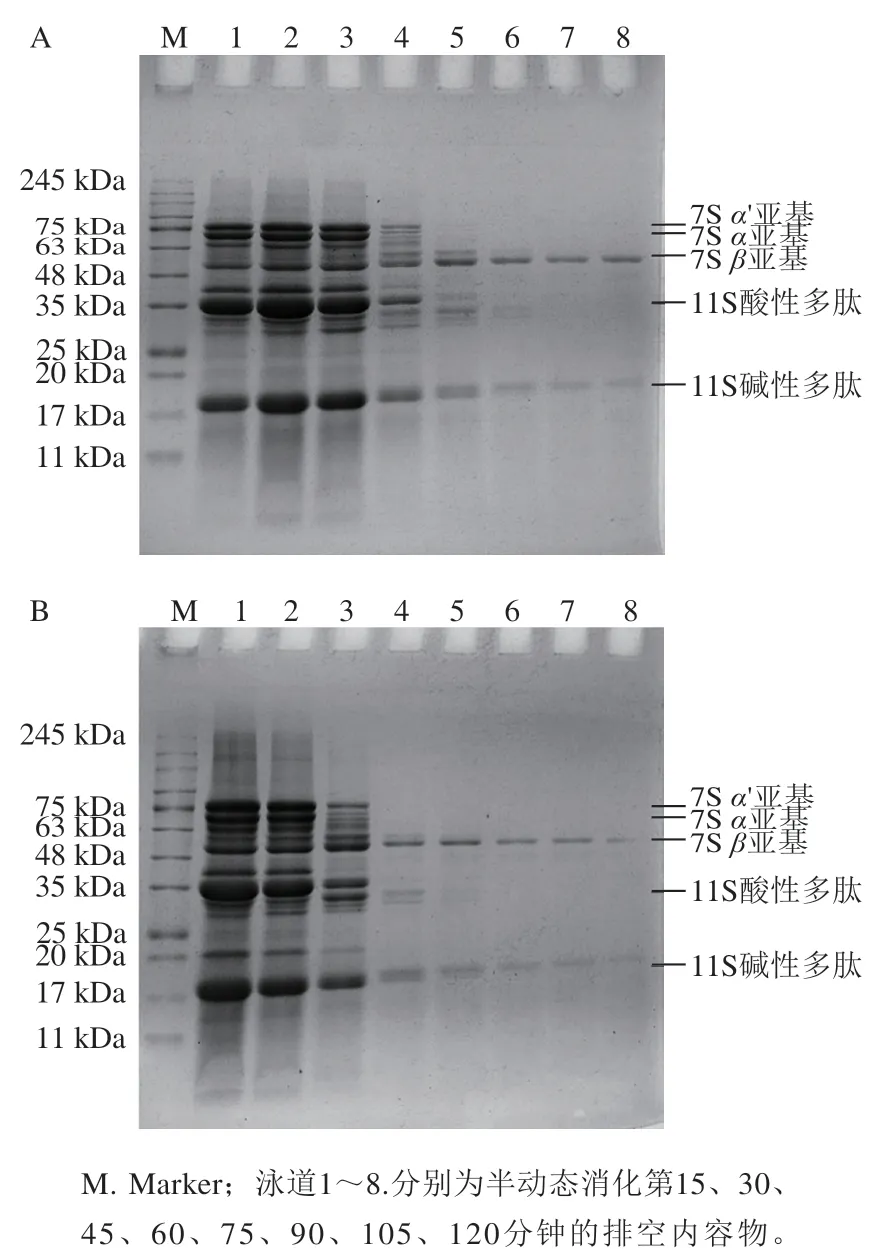
图7 SP-ND(A)和SP-D(B)在半动态消化过程中的SDS-PAGE图谱Fig. 7 SDS-PAGE patterns of SP-ND (A) and SP-D (B) during semi-dynamic digestion
2.3.3 排空内容物的干物质及其游离氨基含量分析
两种大豆蛋白在半动态消化过程排空内容物的质量变化如图8A所示,与消化过程中的外观图可相互印证。SP-ND排空内容物干物质的质量呈先上升后下降再上升的趋势:消化第30分钟,该值达到最高,为0.62 g;因为,此时pH值最接近等电点,聚集程度最高;30 min后其质量开始下降。SP-D的排空内容物干物质的质量则从15 min开始呈现下降趋势。SP-D在消化30 min后排空内容干物质的质量均低于SP-ND。这可能是因为SP-ND消化过程中一直有明显的沉淀,故排空取样时仍有较多的干物质;另外,SP-ND溶液的质量分数相对较高(6.1%),可能导致其干物质的质量高于SP-D。
两种大豆蛋白排空内容物累积质量占总固形物质量的比值随消化过程的变化如图8B所示。SP-ND累积排空为83%,SP-D累积排空为87%;两者胃糜排空50%时对应的时间(t)分别为44、29 min,可用来衡量胃排空速率。

图8 大豆蛋白半动态消化过程中排空内容物干物质的质量(A)及累积排空程度(B)Fig. 8 Dry matter mass of emptied digesta (A) and cumulative amount of emptied digesta (B) of soy protein during semi-dynamic digestion
如图9所示,游离氨基含量的变化趋势与其排空内容物干物质质量变化相似。SP-ND整体呈先增加后下降的趋势,消化第30分钟游离氨基含量最高,为1.03 mmol/g;60 min后,游离氨基含量无明显变化。SP-D的游离氨基含量在消化前60 min呈下降趋势,之后无明显变化。
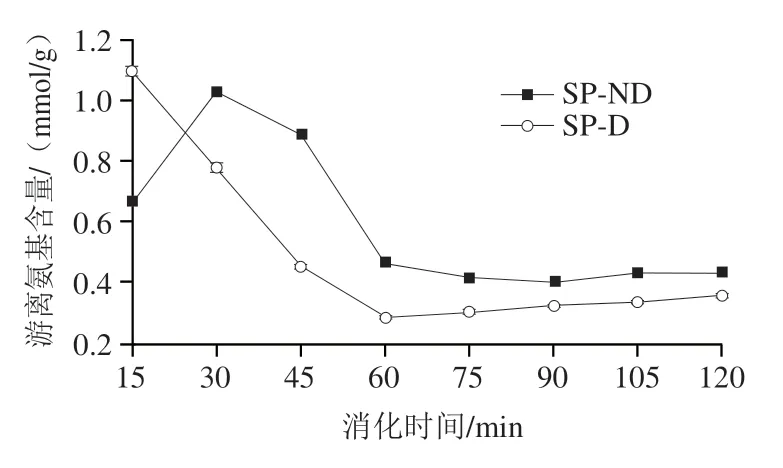
图9 大豆蛋白半动态消化过程中排空内容物的游离氨基含量变化Fig. 9 Changes in free amino group content in emptied digesta of soy protein during semi-dynamic digestion
以半动态消化模型对SP-ND和SP-D进行模拟胃消化,各种表征的实验结果可以相互印证,表明SP-ND的半动态消化进程至少比SP-D慢15 min。
3 讨 论
在INFOGEST静态消化模型中,pH值维持在3左右,pH 3是胃蛋白酶的最适pH值,该模型重点关注酶与底物之间的关系。但人体内胃消化是一个逐渐酸化的过程,在食糜进入胃部15 min内,人体胃部pH值从禁食时的2.0快速上升至4.5~6.7;随后,由于胃酸的逐渐分泌,该pH值逐渐下降。半动态消化模型正是模拟了胃内逐渐酸化的过程,在这个过程中,蛋白质从接近等电点到远离等电点,发生聚集、组装,Singh团队报道的一系列基于HGS模型的关于蛋白质胃消化研究,表明蛋白质在胃消化过程中发生的聚集、组装等结构变化会影响胃排空和胃消化速率;此外pH值影响胃蛋白酶的活性。因此pH值变化是半动态消化过程中的关键影响因素。
在半动态消化过程中,SP-ND的pH值变化比SP-D慢,从消化产物表征可知,SP-ND的消化进程比SP-D至少慢15 min。两种大豆蛋白的pH值变化趋势不同,反映的是缓冲能力的差异。从图5可知,SP-ND的缓冲能力比SP-D的缓冲能力强。缓冲能力定义为加入酸或碱后对pH值变化的抵抗力,蛋白质的缓冲能力来自多肽链上的可电离基团,包括氨基酸侧链、末端氨基和末端羧基。
食物缓冲能力除了受固有因素,如蛋白质含量、氨基酸组成、有机酸含量等影响,也会受到脂肪、碳水化合物、颗粒大小等影响,这些因素会影响H扩散或者影响H与蛋白质、氨基酸、有机酸的反应。两种大豆蛋白溶液蛋白质含量相同,均为3.6%左右;氨基酸组成基本一致;推测缓冲能力的差异可能主要是因为两者成分的差异,两者蛋白含量相差约23%,未经透析的SP-ND成分比SP-D复杂;其次是固形物含量的差异,SP-ND质量分数为6.1%,SP-D质量分数为4.4%。
比较两种大豆蛋白采用两种消化模型消化后的电泳图谱,可知水解程度基本一致。故如果仅考察蛋白质的水解产物和水解程度,那么两种消化模型均适用,其中INFOGEST静态模型程序更简单,易操作。而半动态消化模型的优点在于可以获得蛋白质在消化过程中的聚集、组装信息。因此可以根据不同的研究目的采用不同的消化模型。
4 结 论
采用INFOGEST静态消化模型和半动态消化模型研究未经透析和经透析的大豆蛋白的胃消化特性。结果表明:未经透析和经透析的大豆蛋白在静态消化过程中无明显差异;在半动态消化过程中存在胃排空和消化速率等差异,未经透析处理的大豆蛋白保留较多大豆中的成分,使其缓冲能力更强,胃排空滞后,蛋白质消化速率减慢。此外,比较两种体外消化模型,半动态消化模型易于获得蛋白质在消化过程中的聚集、组装信息。本研究结果将为基于大豆蛋白的产品的开发和健康效应提供新的见解。
