新生儿高促甲状腺素血症围产期危险因素分析
2022-10-08张彩营奎正平赵小龙侯晓梅齐志业
张彩营 ,奎正平 ,王 琼 ,赵小龙 ,侯晓梅 ,齐志业 1,
(1)昆明医科大学第一附属医院儿科;2)新生儿遗传代谢病筛查中心;3)产科,云南 昆明 650032)
近年来,随着新生儿遗传代谢病筛查工作的开展,越来越多的先天性甲状腺功能减低症(congenital hypothyroidism,CH)患儿得到早期诊断和治疗[1]。而新生儿遗传代谢病筛查过程中,促甲状腺素(thyroid stimulating hormone,TSH)筛查阳性新生儿最终诊断为CH 的患儿相对较少,更多的新生儿诊断为高促甲状腺素血症(hyperthyrotropinemia,HT)[2]。目前国内尚无针对HT 的规范治疗方案,随访过程中亦存在治疗不足或过度治疗情况[3],并有罹患CH,影响儿童生长发育的可能[4]。国内外关于新生儿CH 围产危险因素分析较多[5],关于HT 相关危险因素的报道并不多见[6],国内尚未见相关报道。本研究通过病例对照研究探讨与新生儿HT 相关的母亲和新生儿围产危险因素,为判断HT 的预后、制定新生儿随访计划提供指导。
1 资料与方法
1.1 病例资料
选择2016 年1 月至2020 年12 月在昆明医科大学第一附属医院分娩并接受遗传代谢病筛查的新生儿为研究对象。对TSH 筛查阳性新生儿进行召回,使用美国Abbott ARCHITECT i2000SR 型全自动免疫分析仪,采用化学发光法完善甲状腺功能检查。胎龄 < 34 周或出生体重 < 2 000 g 的新生儿在出生后28 d 或出院时复查甲状腺功能[7]。TSH 增高、游离甲状腺素(free thyroxine,FT4)正常者诊断为HT;TSH 增高,FT4 降低者诊断为CH。TSH 的参考范围为(0.35~4.94)µIU/mL,FT4的参考范围为(0.70~1.48)ng/dL。召回复查新生儿中,诊断为HT 的新生儿作为病例组,甲状腺功能检查正常新生儿作为对照组。所有进行的检测均获得新生儿监护人知情同意,并签署知情同意书。
1.2 研究方法
自行设计调查问卷,并通过预调查进行修改和完善。根据调查问卷内容由经过统一培训的调查人员查阅产科诊疗记录收集临床数据,并由质量控制人员对收集的资料进行审核,缺失数据通过电话随访进行补充。使用统一的软件进行双录入审核,以保证录入信息的准确性。调查内容包括社会人口学资料、不良孕产史、妊娠期合并症、新生儿分娩信息及患病情况等。高龄产妇定义为分娩年龄 ≥35 岁[8];不良孕产史包括既往有胚胎停育、死胎、死产、自然流产、不良生育史等病史;妊娠期并发症[8]、胎儿宫内窘迫[9]的诊断指标参考文献;新生儿根据出生体重分为低出生体重(< 2 500 g)、正常出生体重(2 500 g~3 999 g)和巨大儿(≥4 000 g),根据胎龄分为早产(胎龄 <37 周)和足月(37 周≤胎龄 < 42 周)。
1.3 统计学处理
采用SPSS 26.0 软件进行统计学分析。计数资料采用例数及百分比(%)表示。单因素分析采用χ2检验,按α=0.10 的水平将单因素分析筛选出的变量纳入Logistic 回归模型。以P< 0.05 为差异有统计学意义。
2 结果
2.1 研究对象基本情况
2016 年1 月至2020 年12 月共完成新生儿遗传代谢病筛查36 024例,其中TSH 筛查阳性276例,筛查阳性率0.77%。筛查阳性新生儿召回过程中,失访19例,新生儿死亡5例。完成甲状腺功能检查252例,其中母亲高龄43例(17.1%),早产39例(15.5%),低出生体重52例(20.6%),需转儿科治疗136例(54.0%)。最终诊断HT 109例,HT 发病率30.3/万,诊断CH 16例,CH 发病率4.4/万。甲状腺功能正常127例。
2.2 新生儿HT 围产期危险因素的单因素分析
新生儿HT 围产因素的单因素分析结果表明,病例组高龄产妇和早产的比例均为23.9%(26例),显著高于对照组(P< 0.05),见表1。

表1 新生儿HT 围产因素的单因素分析 [n(%)]Tab.1 Univariate analysis of perinatal risk factors for neonatal hyperthyrotropinemia
2.3 新生儿HT 围产期危险因素的多因素Logistic 回归分析
对单因素分析中P< 0.10 的因素纳入多因素Logistic 回归模型。变量赋值及多因素分析中变量的参考类别见表2。结果表明,高龄产妇(OR=2.320,95%CI:1.099~4.897)和早产(OR=2.960,95%CI:1.354~6.473)是新生儿HT 发生的危险因素,见表3。
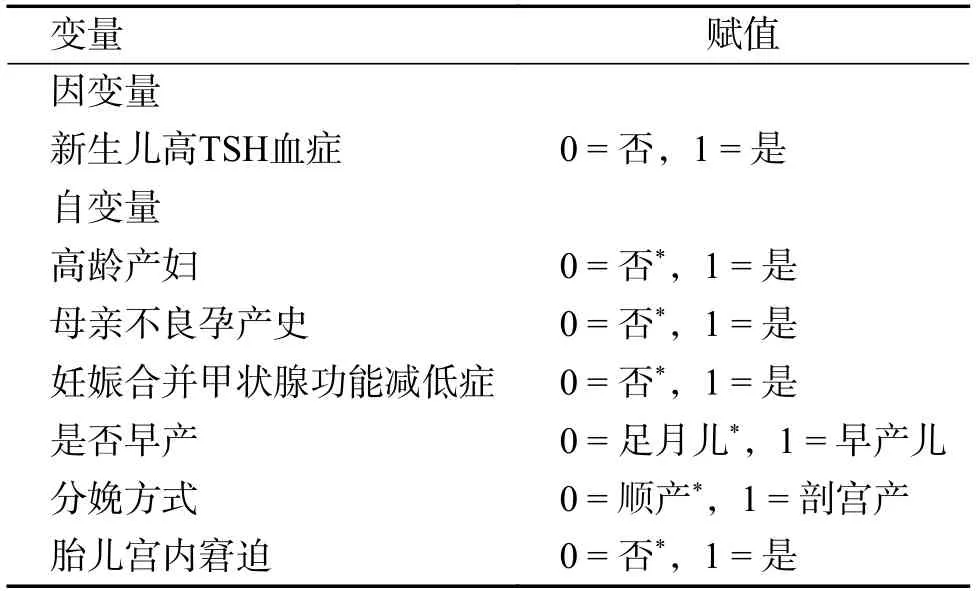
表2 变量赋值表Tab.2 Variable assignment

表3 新生儿HT 危险因素的Logistic 回归分析Tab.3 Multivariate logistic regression analysis of perinatal risk factors for neonatal hyperthyrotropinemia
3 讨论
HT 是涵盖亚临床甲状腺功能减低症、甲状腺素不敏感综合征和TSH 不敏感综合征的一组疾病[3],可能的病因包括下丘脑-垂体-甲状腺轴发育不成熟、TSH 对促甲状腺激素释放激素敏感性增加、新生儿体内存在抗甲状腺抗体、甲状腺发育异常和甲状腺过氧化物酶或TSH 受体基因突变等[6]。国外关于新生儿HT 危险因素的研究结果并不一致,部分研究结果提示新生儿HT 与母亲年龄、妊娠期甲状腺疾病、新生儿民族、性别、胎龄、分娩方式、出生体重和出生后患病情况等有关[6,10]。我国先天性甲状腺功能减低症筛查中,CH 发病率约为4.13/万[1],HT 发病率约为5.2/万[11]。本研究中,CH 发病率与以往研究接近,但HT 发病率明显增高,这可能和本研究中TSH筛查阳性新生儿早产(15.5%)、低出生体重(20.6%)和需进一步转儿科治疗(54.0%)的比例较高而导致新生儿暂时性TSH 增高有关。
Raj S 等[12]的研究提示,随着母亲年龄的增长,新生儿脐带血TSH > 20.1 mIU/L 的比例明显增高。中国天津的前瞻性出生队列研究表明,新生儿TSH 水平与母亲年龄呈现正相关关系[13],这些新生儿最终诊断为HT 的概率也明显增高。本研究结果中,高龄母亲所生新生儿发生HT 的风险增加2.320 倍。高龄母亲血清可溶性fms 样酪氨酸激 酶-1(soluble FMS-like tyrosine kinase-1,sFLT1)浓度更高[14]。sFLT1 可与血管内皮生长因子(vascular endothelial growth factor,VEGF)结合,拮抗VEGF 促血管生成作用,并影响胚胎期甲状腺组织的发育,导致新生儿TSH 增高[15]。同时,高龄母亲下丘脑-垂体-甲状腺轴功能减退,释放TSH 功能减弱,影响胎儿甲状腺发育,导致新生儿自身甲状腺素分泌减少而负反馈调节TSH 增高[16]。
国内关于新生儿TSH 参考区间的研究[17]结果表明,新生儿FT4 水平与胎龄呈正相关,而TSH 水平与胎龄呈负相关;意大利一项回顾性队列研究[18]提示新生儿TSH 与早产存在明显的负相关关系,均表明早产是HT 的危险因素。本研究结果也表明,和足月儿相比,早产儿HT 的发生风险增加了2.960 倍。甲状腺是胚胎发育的第一个内分泌腺,并随着孕周的增加而逐渐增大。至胚胎第11 周,胎儿甲状腺开始合成甲状腺素,但其主要来源于仍依赖母体转运。孕中期开始,胎儿自身合成甲状腺素逐渐增多,直至孕36 周达到足月儿水平[19]。而为了满足胎儿生长发育需求,其TSH 水平也逐渐增加,并且持续高于母体水平[19]。早产儿宫内生长受限,下丘脑-垂体-甲状腺轴功能和甲状腺发育不成熟[20],使得其在新生儿早期甲状腺素和TSH 水平明显低于足月儿。而出生后肠道吸收碘和甲状腺聚碘、合成和碘化功能较差[21],加之对甲状腺素的生理需求增加,导致早产儿TSH 延迟增高,HT 发生率增高。
多项研究表明,母亲合并妊娠期甲状腺疾病可影响新生儿甲状腺功能[5,22],这可能和母亲抗甲状腺药物治疗和妊娠合并甲状腺功能减低症孕妇血清促甲状腺激素受体抗体(thyroid-stimulating hormone receptor antibodies,TRAbs)受到抑制[23],而甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)浓度增高[24],导致发生HT 的风险增加有关。本研究将母亲妊娠合并甲状腺功能减低症纳入回归分析,提示母亲合并妊娠甲状腺功能减低症和HT 的发生风险之间存边界显著性(P=0.090),但差异无统计学意义(P> 0.05),这可能和本研究未将母亲甲状腺功能的具体检测指标(如TSH、FT4 或TPOAB 水平)进行分层分析有关。以往研究表明,经阴道分娩或胎儿宫内窘迫可导致新生儿体内儿茶酚胺浓度增高,影响下丘脑-垂体-甲状腺轴激素的合成和分泌,从而导致新生儿TSH 增高[25]。但有研究[26]并未发现二者之间相关性,与本研究结果一致,具体原因尚不清楚。因此,关于围产期因素和新生儿HT 之间的关系仍有待进一步研究。
本研究采用病例对照设计对新生儿HT 的围产期危险因素进行分析,发现母亲高龄和早产是新生儿HT 的危险因素,避免高龄分娩和早产是预防新生儿HT 的重要手段。本研究存在一定的局限性:样本量小,可能降低统计功效;回归分析模型并未纳入全部与新生儿HT 相关的混杂因素,比如母亲甲状腺功能相关指标、母亲体质指数、妊娠期心理压力和环境有害物质暴露[15]等;新生儿HT 可能与遗传因素有关[27],本研究并未将研究对象中有甲状腺相关遗传病病史的新生儿排除。因此,关于母亲和新生儿围产危险因素与新生儿HT 的相关性仍需大样本前瞻性出生队列研究进行检验。
