Linc-ROR RNA在卵巢癌干细胞样细胞干性调控及功能维持中的作用*
2022-10-07文小玲陈思盼娄艳辉
文小玲,陈思盼,田 甜,于 啸,娄艳辉*
(1.青岛大学附属医院妇科,青岛 266003;2.华中科技大学同济医学院附属武汉儿童医院,武汉市妇幼保健院,武汉 430000)
上皮性卵巢癌(epithelial ovarian cancer,EOC)恶性程度高,侵袭性强,进展迅速,70%以上患者就诊时已出现盆腹腔内广泛转移及恶性腹水。目前卵巢癌转移的相关分子机制尚未阐明[1]。肿瘤干细胞(cancer stem cells,CSCs)是一群具有自我更新及多向分化潜能的增殖细胞群体,是肿瘤转移和复发的重要原因之一[2-3]。因此,寻找并明确卵巢癌干细胞样细胞(ovarian cancer stem-like cell,OCS-LC)转化过程中的重要作用基因,进而阐明卵巢癌转移的分子机制,对卵巢癌的临床治疗具有重要意义。目前关于长链非编码RNA(long intergenic non-coding RNA,LncRNA)在OCS-LC中作用的研究报道较少。基因间长链非编码RNA-重编码调控因子ROR(Linc-ROR)是Lnc RNA的一种,因其能上调细胞中核心转录因子Oct-4和Nanog蛋白表达,在维持胚胎干细胞自我更新和多分化潜能中发挥重要作用[4-5]。近年研究发现,Linc-ROR与CSCs的干性表型和功能调控密切相关[6],但在OCS-LC中的作用尚未被研究。本课题组前期研究发现,Linc-ROR在上皮性卵巢癌组织中高表达,并且能促进卵巢癌细胞系SKOV3细胞的增殖、侵袭和迁移,与卵巢癌的转移密切相关[7]。本研究通过研究Linc-ROR在OCS-LC干性调控及功能维持中的重要作用,旨在探讨Linc-ROR是否通过增强OCS-LC干性特征进而促进肿瘤复发和转移。
1 材料与方法
1.1 材料来源 高糖DMEM培养基、DMEM/F12培养基和胎牛血清(FBS)购自美国Gibco公司;含牛血清白蛋白(BSA)和胰岛素购自美国Sigma公司;表皮细胞生长因子(epidermal growth factor,EGF)、重组人碱性成纤维细胞生长因子(recombinant human fibroblast growth factor,bFGF)购自美国Peprotech公司;慢病毒载体构建于上海吉凯基因;鼠抗人CD133(抗CD133-APC)流式抗体及同型鼠IgG抗体购自美国Biolegend公司;Trizol试剂、Script RT Reagent Kit试剂盒和SYBR®Premix Ex TaqTMⅡ试剂盒购自日本TaKaRa公司。
1.2 细胞培养 人卵巢癌细胞系A2780细胞购自美国模式培养物集存库。A2780细胞在含10%胎牛血清、10g/L青链霉素(100kU/L青霉素和0.1g/L链霉素)的高糖DMEM培养基中,于37℃、5% CO2培养箱培养。
1.3 实验方法
1.3.1 OCS-LC的诱导及鉴定
1.3.1.1 OCS-LC诱导 将A2780细胞消化离心,重悬于以DMEM/F12(1∶1)为基础,含0.4% BSA、0.02g/L EGF、0.01g/L bFGF、5g/L胰岛素的无血清培养基中,按2000细胞/孔接种于超低吸附6孔板,于37℃、5% CO2细胞培养孵箱继续培养,隔天换液。
1.3.1.2 OCS-LC的鉴定 (1)成球实验:待诱导成球后,收集上述诱导所得直径大于70μm的干细胞球,消化离心,用无血清培养基重悬,重新接种于超低吸附6孔板中培养7~10d,观察可否二次成球。(2)分化实验:收集胰酶消化后的OCS-LC单细胞悬液,重新置于含血清的培养基中,于37℃、5% CO2培养箱继续培养,不同时间段观察细胞能否分化为贴壁状态。(3)流式分析技术分析OCS-LC的CD133+细胞阳性率:分别收集对数生长期的A2780贴壁细胞和诱导所得的OCS-LC,胰酶消化,加含血清的培养基终止消化,1000r/min离心5min,弃上清,PBS洗涤2次,重悬于4℃预冷PBS(2% BSA)中,调整细胞浓度1×109细胞/mL。两组细胞各取100μL细胞溶液,加1μg抗CD133-APC抗体,IgG为同型对照;4℃避光孵育30min,重悬于100μL PBS中,2h内在BD FACS Aria流式细胞仪上进行检测。实验重复3次,实验结果取均值。
1.3.2 双荧光素酶实验验证Linc-ROR RNA与miR-181c-5p RNA结合情况 生物信息学分析软件预测Linc-ROR RNA与miR-181c-5p的靶向结合位点,分别构建Linc-ROR野生型和突变型(Linc-ROR-WT/MUT)报告基因质粒,将报告基因质粒分别转染至过表达miR-181c-5p RNA(miR-181c-5p mimics)的A2780卵巢癌细胞中。48h后,使用双荧光素酶报告系统(Promega,Madison,WI,USA)测定细胞裂解物的荧光素酶活性。实验重复3次,实验结果取均值。
1.3.3 慢病毒转染 构建Linc-ROR小分子干扰RNA(Linc-ROR siRNA)和阴性对照Linc-ROR siRNA(Linc-ROR siRNA-NC),通过慢病毒感染技术分别转染Linc-ROR siRNA和Linc-ROR siRNA-NC至A2780细胞。按摸索条件MOI=10,对慢病毒液冰上溶解并稀释后感染细胞,于37℃、5% CO2细胞培养箱继续培养24h,更换培养基,并筛选出稳转株用于后续实验。实验重复3次,实验结果取均值。
1.3.4 OCS-LC成球能力的评估 采用与1.3.1.1相同方法,分别将si-ROR A2780细胞和control-ROR A2780细胞诱导生成si-OCS-LC和control-OCS-LC。显微镜下拍照记录各组成球情况,通过成球率、成球周期及最大球直径来评估各组OCS-LC成球能力。OCS-LC成球率=直径超过70μm的细胞球数/接种细胞数×100%。实验重复3次,实验结果取均值。
1.3.5 免疫荧光染色检测OCS-LC中CD133+细胞率 收集si-OCS-LC和control-OCS-LC细胞球,制备成细胞玻片,4%冰冻多聚甲醛固定,0.1% TritonX-100室温下打孔,PBS洗涤3次,5% BSA室温封闭30min,加一抗CD133(1∶300)4℃过夜避光孵育,加FITC标记的羊抗兔二抗(1∶500),37℃避光孵育1h,PBS洗涤3次,DAPI染色。激光共聚焦显微镜(Olympus FV1200,Japan)下观察、照相。实验重复3次,实验结果取均值。
1.3.6 实时荧光定量PCR(RT-qPCR)技术检测各组OCS-LC中Linc-ROR、miR-181c-5p及核心转录因子Oct-4、Nanog mRNA表达 采用RT-qPCR技术检测诱导生成的OCS-LC中Linc-ROR mRNA较诱导前A2780贴壁细胞的表达差异,si-OCS-LC和control-OCS-LC细胞球中核心转录因子Oct-4、Nanog mRNA表达水平,以及Linc-ROR RNA、miR-181c-5p RNA的变化情况。用Trizol试剂分别提取各组细胞中总RNA,用Prime Script RT Reagent Kit试剂盒和SYBR®Premix Ex TaqTMⅡ试剂盒分别进行反转录和扩增。所涉及引物序列见表1。以U6为miR-181c-5p RNA的内参照,磷酸甘油醛脱氢酶(GAPDH)为其他基因的内参照,采用2-ΔΔCT法计算Linc-ROR、miR-181c-5p、Oct-4和Nanog mRNA的相对表达量。实验重复3次,实验结果取均值。

表1 RT-qPCR所用引物序列
1.3.7 Western blot实验检测Oct-4、Nanog蛋白表达 收集细胞,用PBS洗涤,并在含蛋白酶抑制剂混合物的RIPA裂解缓冲液中裂解。按试剂盒说明书配好SDS-聚丙烯酰胺凝胶,SDS-PAGE电泳,蛋白转移到PVDF膜,室温5%脱脂奶粉封闭2h。一抗4℃孵育过夜,辣根过氧化物酶标记抗体(1∶15000)室温孵育2h,化学发光增强剂(ECL)进行显色。一抗:兔源单克隆抗GAPDH(1∶1000)、兔源单克隆抗Oct-4(1∶1000)、兔源单克隆抗Nanog(1∶1000)。
1.3.8 CCK-8实验检测细胞增殖能力 收集两组细胞悬液,调整细胞密度1×104细胞/mL,按1000细胞/孔分别接种于96孔板,培养24、48、72、96h后,每孔加10μL的CCK-8试剂,37℃避光孵育2h,于酶标仪450nm波长下检测吸光度OD值,绘制细胞增殖曲线。
1.3.9 Transwell小室实验检测细胞的迁移、侵袭能力 细胞迁移实验:将200μL的control-OCS-LC和si-OCS-LC无血清细胞悬液分别接种于Transwell小室上室,下室加600μL含30%FBS的DMEM培养基。于37℃、5%CO2培养箱孵育48h,取出小室,PBS清洗3遍,4%多聚甲醛固定,0.1%结晶紫染色,漂洗干燥。倒置显微镜下随机选取3个视野,计数迁移细胞数,取平均值。实验重复3次。细胞侵袭实验:Transwell小室上室需提前涂好人工基质胶matrigel,37℃培养箱自然风干,其余操作同细胞迁移实验。评估两组OCS-LC的迁移、侵袭能力。

2 结 果
2.1 OCS-LC诱导、鉴定结果 部分A2780细胞呈圆形悬浮于培养液,2~3d后逐渐形成松散的串珠样结构,4~7d后形成较规则的细胞球,7~10d后细胞球持续扩大,形态更加致密规则。细胞成球实验显示,干细胞样细胞悬液在无血清培养基中继续培养时,能聚集成球克隆生长。分化实验中,将细胞球重悬于含有血清的培养基培养48h,可重新分化成贴壁样生长的卵巢癌细胞。流式分析结果显示,OCS-LC和A2780贴壁细胞的CD133+比率分别为(18.00±0.30)%和(0.92±0.32)%,差异有统计学意义(P<0.05)。RT-qPCR结果显示,OCS-LC的Linc-ROR mRNA相对表达量显著高于A2780贴壁细胞组,差异有统计学意义(t=34.02,P<0.001)。见图1。

图1 流式细胞分析技术分析A2780贴壁细胞和OCS-LC的CD133+比率A:OCS-LC细胞可呈球克隆生长(×100);B:OCS-LC在特定培养条件下,可再次定向分化成贴壁样生长的卵巢癌细胞(×40);C:RT-qPCR显示OCS-LC的Linc-ROR mRNA相对表达量显著升高(***P<0.001)
2.2 双荧光素酶报告实验分析 通过生物信息学分析软件预测到Linc-ROR RNA和miR-181c-5p RNA存在靶向结合位点。见图2。双荧光素酶实验靶向性验证报告显示,过表达miR-181c-5p RNA明显降低Linc-ROR WT的荧光素酶活性,miR-181c-5p mimics+Linc-ROR WT组A2780细胞的荧光素酶活性(0.56±0.08),低于NC mimics+Linc-ROR WT组(1.01±0.03),两组比较差异有统计学意义(t=9.316,P<0.01);结合位点突变序列的Linc-ROR MUT报告基因的荧光素酶活性不变,miR-181c-5p mimics+Linc-ROR MUT组A2780细胞的荧光素酶活性为(0.94±0.05),与NC mimics+Linc-ROR MUT组比较(0.98±0.03),差异无统计学意义(P>0.05)。

图2 Linc-ROR与miR-181c-5p结合位点的预测
2.3 Linc-ROR RNA对OCS-LC成球能力的影响 转染后的成球实验显示,两组OCS-LC均能继续成球生长,si-OCS-LC组和control-OCS-LC组的成球周期分别为(17±1)d、(11±1.5)d;最大球直径分别为(78.6±4.0)μm、(108.0±2.0)μm;成球率分别为(0.53±0.1)%、(1.08±0.15)%。si-OCS-LC组和control-OCS-LC组相比,成球周期延长,最大球直径变小,成球率降低,差异均有统计学意义(P<0.05)。
2.4 Linc-ROR RNA对OCS-LC CD133+细胞率的影响 免疫荧光显示,si-OCS-LC和control-OCS-LC分别经FITC-CD133免疫荧光染色后,在激光共聚焦显微镜下可观察到细胞有明显的绿色荧光,为CD133阳性,其中si-OCS-LC组CD133显色细胞数更少,即CD133+细胞率较低。见图3。
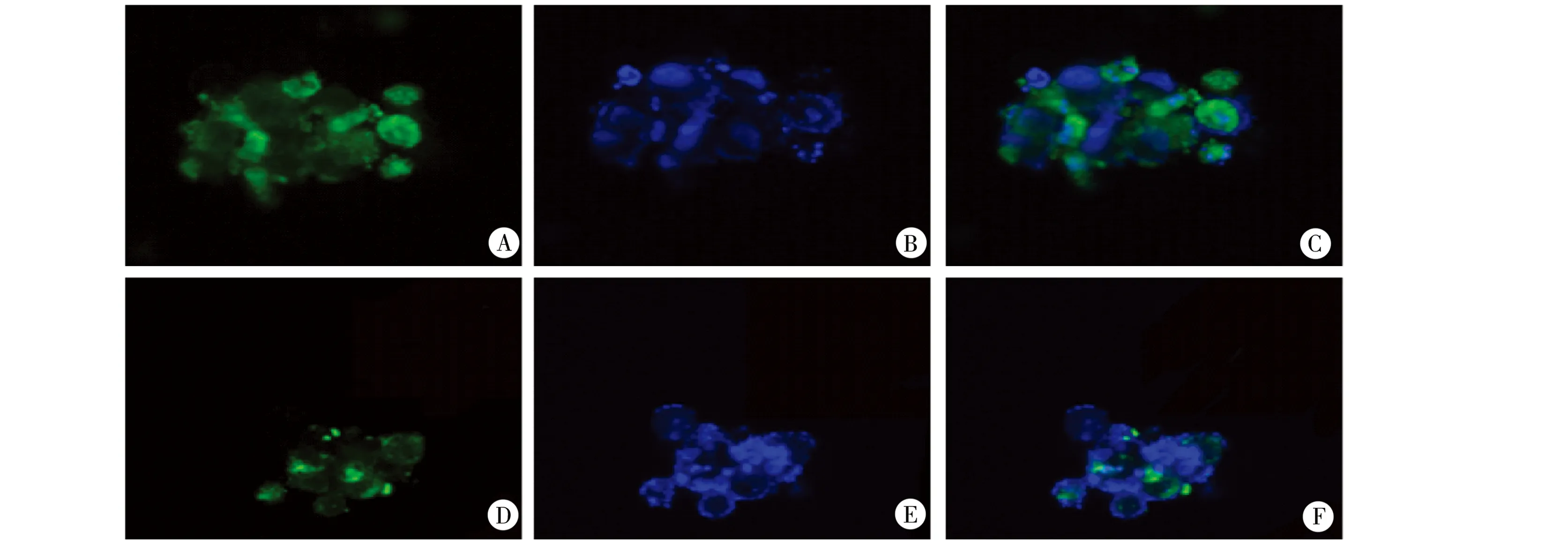
图3 激光共聚显微镜下OCS-LC的CD133+比率A、B:分别为control-OCS-LC组的CD133+细胞与DAPI染核情况;C:图A、B合成图;D、E:分别为si-OCS-LC组的CD133+细胞与DAPI染核情况;F:图D、E合成图
2.5 Linc-ROR RNA对OCS-LC中miR-181c-5p及核心转录因子Oct-4、Nanog表达的影响 实时荧光定量PCR结果表明,沉默Linc-ROR后,OCS-LC中核心转录因子Oct-4、Nanog mRNA表达水平下降,miR-181c-5p mRNA表达水平则升高。Western blot结果显示,沉默Linc-ROR RNA后,OCS-LC中核心转录因子Oct-4、Nanog蛋白表达水平下降,差异均有统计学意义(P均<0.05)。见图4。

图4 Linc-ROR对OCS-LC中miR-181c-5p、Oct-4及Nanog表达的影响A:RT-qPCR检测mRNA相对表达量;B、C:Western blot检测Oct-4、Nanog蛋白表达。*P<0.05,**P<0.01,***P<0.001
2.6 敲降Linc-ROR抑制OCS-LC的增殖、迁移、侵袭能力 敲降Linc-ROR后,si-OCS-LC的增殖能力显著被抑制(P<0.05)。Transwell实验显示,si-OCS-LC组较control-OCS-LC组迁移、侵袭细胞数显著减少,迁移、侵袭能力显著被抑制(P<0.001),见图5。

图5 敲降Linc-ROR后2组OCS-LC的增殖、迁移、侵袭能力比较A:control-OCS-LC和si-OCS-LC的增殖能力比较(*P<0.05);B:control-OCS-LC和si-OCS-LC迁移细胞数比较(***P<0.001); C:control-OCS-LC和si-OCS-LC侵袭细胞数比较(***P<0.001)
3 讨 论
上皮性卵巢癌是病死率最高的妇科恶性肿瘤,70%以上的晚期卵巢癌患者会在2~3年内复发、转移和化疗耐药,5年生存率仅为43%[8]。目前,卵巢癌治疗后的复发转移和化疗耐药仍是改善患者预后的重要挑战。卵巢癌干细胞(ovarian cancer stem cells,OCSCs)是卵巢肿瘤组织或肿瘤微环境中的一类具有自我更新特性、多向分化潜能以及高致瘤性的细胞亚群,常以聚集的球体结构存在,在卵巢癌恶性腹水中富含该类细胞,被认为是肿瘤恶性生长、耐药、转移和复发的主要驱动因素,是肿瘤形成的根源[3,9]。因此,明确OCSCs的转化及其功能的调控机制对卵巢癌的临床治疗具有重要意义。
Linc-ROR是近年新发现的一种基因间Lnc RNA,可作为竞争性内源性RNA(ceRNA)调控干细胞转录因子的表达,在维持胚胎干细胞自我更新和多分化潜能中发挥重要作用。目前研究发现,Linc-ROR RNA在多种肿瘤中过高表达,在肿瘤的发生发展中发挥致癌Linc RNA作用[10]。本课题组前期研究发现,Linc-ROR RNA在Ⅲ~Ⅳ期卵巢癌患者肿瘤组织中的表达明显高于早期患者,而且与淋巴结转移密切相关[11-12]。进一步的功能学实验证实,沉默Linc-ROR RNA可抑制卵巢癌细胞的侵袭和迁移能力。因此,卵巢癌组织中Linc-ROR RNA表达升高可能促进了肿瘤的侵袭转移,然而相关分子调控机制目前尚未阐明。近年研究发现,Linc-ROR RNA与CSCs的干性表型和功能调控密切相关[13],但其与OCSCs的相关研究尚未见相关报道。本研究成功诱导生成OCS-LC,其Linc-ROR mRNA水平明显高于诱导前A2780细胞,提示Linc-ROR RNA可能在OCS-LC转化中发挥重要作用。基于此,进一步通过构建低表达Linc-ROR RNA的细胞株并诱导生成OCS-LC,与A2780贴壁细胞相比,发现成球周期延长,最大球直径减小,且成球率降低,且干细胞标志物CD133+细胞率下降。此外,低表达Linc-ROR RNA可下调干细胞转录因子Oct-4、Nanog mRNA表达。实验结果表明,抑制Linc-ROR RNA可通过下调干细胞转录因子Oct-4、Nanog mRNA而减弱OCS-LC的干性特征,Linc-ROR RNA在OCS-LC的干性调控和维持中发挥重要作用。
在LncRNA的调控模式中,可竞争性结合和吸附一些特定的微小RNA(miRNA),从而调控miRNA靶基因的表达,共同形成一个复杂的调控网络[14]。研究显示,在子宫内膜癌、结直肠癌、乳腺癌及胰腺癌等组织中,Linc-ROR RNA作为“分子海绵”干扰miR-145的功能,进而调控靶基因Oct-4、Sox2和Nanog表达,促进干细胞的转化,从而促进肿瘤细胞的增殖、侵袭、转移进程[10,15-16]。为进一步探究Linc-ROR RNA调控OCS-LC干性的分子机制,本研究通过生物信息学网站Segal Lab(https://genie.weizmann.ac.il/pubs/)预测发现,Linc-ROR RNA和miR-181c-5p RNA之间存在靶向结合位点,双荧光素酶报告分析也验证了二者具有靶向性,miR-181c-5p可能是Linc-ROR的下游靶基因。miR-181c-5p是微小RNA-181家族的重要成员之一,能通过转录后调控靶基因的表达在多种肿瘤中发挥抑癌作用[17]。目前研究发现,miR-181c RNA在宫颈鳞状细胞癌中低表达,过表达能负性调控EMT,抑制肿瘤细胞侵袭和转移,是患者预后不良的重要指标,且抑制干细胞转录因子Oct-4、Nanog表达,可抑制肿瘤干细胞的干细胞特性[18]。本研究中,抑制细胞Linc-ROR RNA表达后,诱导生成的OCS-LC中miR-181c-5p mRNA表达水平明显升高,OCS-LC的成球周期延长,成球率降低,细胞增殖、迁移及侵袭能力下降,而且干细胞标志物CD133+细胞率、Oct-4和Nanog表达降低。以上研究表明,Linc-ROR RNA通过负向调控miR-181c-5p表达和功能,进一步干扰下游靶基因Oct-4和Nanog的表达从而调控OCS-LC干性,可能在卵巢癌侵袭转移过程中发挥重要作用,但具体调节机制尚有待进一步深入探讨和验证。
本研究对Linc-ROR/miR-181c-5p调控轴在卵巢癌干性特征及功能调控中的作用进行了初步探讨,对OCS-LC干性调控分子机制提供了新的认识,为进一步探讨卵巢癌侵袭转移机制提供新的研究靶点和实验基础。
