肝移植术后早期发生胰岛素抵抗的危险因素
2022-10-03孙聚珊王智鹏曹助张龙华白磊李涛赵晋明何翼彪
孙聚珊,王智鹏,曹助,张龙华,白磊,李涛,赵晋明,何翼彪
(新疆医科大学第一附属医院 消化血管外科中心/肝脏·腹腔镜外科,新疆 乌鲁木齐 830054)
自1963 年Starzl教授首次实施了全世界首例原位肝移植手术(liver transplantation,LT)以来,LT逐渐成为治疗各种终末期肝病唯一有效的方法[1],目前手术成功率已高达90%,术后1年生存率也达到了90%,术后5年生存率也接近70%[2]。随着受体存活时间的逐渐延长,LT术后的一些并发症开始困扰着广大的临床医师,如移植物失去功能、血管并发症、胆道并发症、代谢并发症。而代谢并发症中包括了糖尿病、肥胖、高脂血症、骨质疏松等[3],其中LT术后糖代谢紊乱发生率较高,大约30%~50%的受体无需胰岛素处理短期内恢复正常。部分受体术后1个月内需使用胰岛素控制血糖,后期血糖可自主恢复正常,此类受体称为一过性高血糖(transient-high glucose,T-HG);部分转化为不可逆的术后新发糖尿病(new-onset diabetse mellitus,NODM)[4]。无论是T-HG还是NODM都是术后发生胰岛素抵抗(insulin resistent,IR)的结果,LT术后IR增加了心血管疾病、感染和移植物失功的风险,甚至增加了受者的病死率。目前关于NODM危险因素的研究报道较多,但关于术后IR的研究较少,本研究的主要目的是分析IR的危险因素,为术后糖代谢紊乱的诊治提供新的思路。
1 资料和方法
1.1 肝移植受体资料及纳入与排除标准
本研究为单中心回顾性病例分析,选取2016年1 月至2021 年6 月于新疆医科大学第一附属医院行LT的受体。纳入标准:(1)首次行LT的受体;(2)受体年龄≥18岁;(3)随访时间>1个月;(4)术后有规律稳定的免疫抑制剂治疗方案。排除标准:(1)术后24 h内死亡;(2)术前患有糖尿病;(3)在其他移植中心移植后于我科随访的受体;(4)自体LT;(5)多脏器联合移植。共有46例纳入本研究。所有的LT手术由相同外科团队实施,手术方式为背驼式LT或原位LT,胆道重建采取端端吻合的方式。本研究收集的数据包括受体术前一般资料、术后1 个月内的检验结果,出院后随访内容为血糖、血药浓度、炎症指标。本研究符合赫尔辛基宣言的伦理准则,在涉及人类参与者的研究中执行的所有程序都符合伦理制度审查委员会的伦理标准(K202106-01)。
1.2 IR的诊断标准
T-HG定义为术后1个月内血糖高于正常值,后期无需胰岛素及降糖药物控制,血糖可自主恢复正常。临床上常用的是2003年ADA和WHO的诊断标准:出现糖尿病症状,且随机血糖(random plasma glucose,RPG)≥11.1 mmol/L或快速血糖(fasting plasma glucose,FPG)≥7.0 mmol/L;或口服糖耐量实验(oral glucose tolerance test,OGTT)检测2 h血糖值≥11.1 mmol/L,以上数值需两次检测予以证实,NODM诊断方可成立。按照血糖浓度分为正常对照组和IR组(T-HG组、NODM组)。
1.3 免疫抑制药物方案
所有受体在LT术后常规免疫抑制治疗采用钙调磷酸酶抑制剂(TAC)+骁悉(MMF)+激素三联用药,术后48 h内开始服用TAC 0.15 mg·kg-1·d-1,MMF 1 500 mg/d,bid;术中开放门静脉前静脉推注甲强龙500 mg,术后第2至7天分别为240、200、160、120、80、40 mg,然后改为口服强的松,起始剂量20 mg/d,每10日递减5 mg,直至停药;术后早期抗感染采用头孢类抗生素;术后早期3~5 d常规预防性使用抗真菌及抗病毒药物预防感染;口服拉米夫定/恩替卡韦预防乙型肝炎复发。
1.4 统计学分析
2 结果
2.1 正常对照组与IR组受体基线资料
46 例受体中,共有31 例(67.39%)术后发生了IR,其中17例受体发展为不可逆的NODM(36.96%),公民逝世后器官捐献(DCD 移植)的受体26 例(56.52%),单因素分析中有5个变量与IR显著相关,分别为受体的年龄(P=0.008)、热缺血时间(warm ischemia time,WIT)(P=0.004)、ALT(P=0.034)、术前FBG(P=0.045)、BMI(P=0.008)、术前IL-6(P=0.008)。其余变量在两组间无明显统计学差异。见表1。
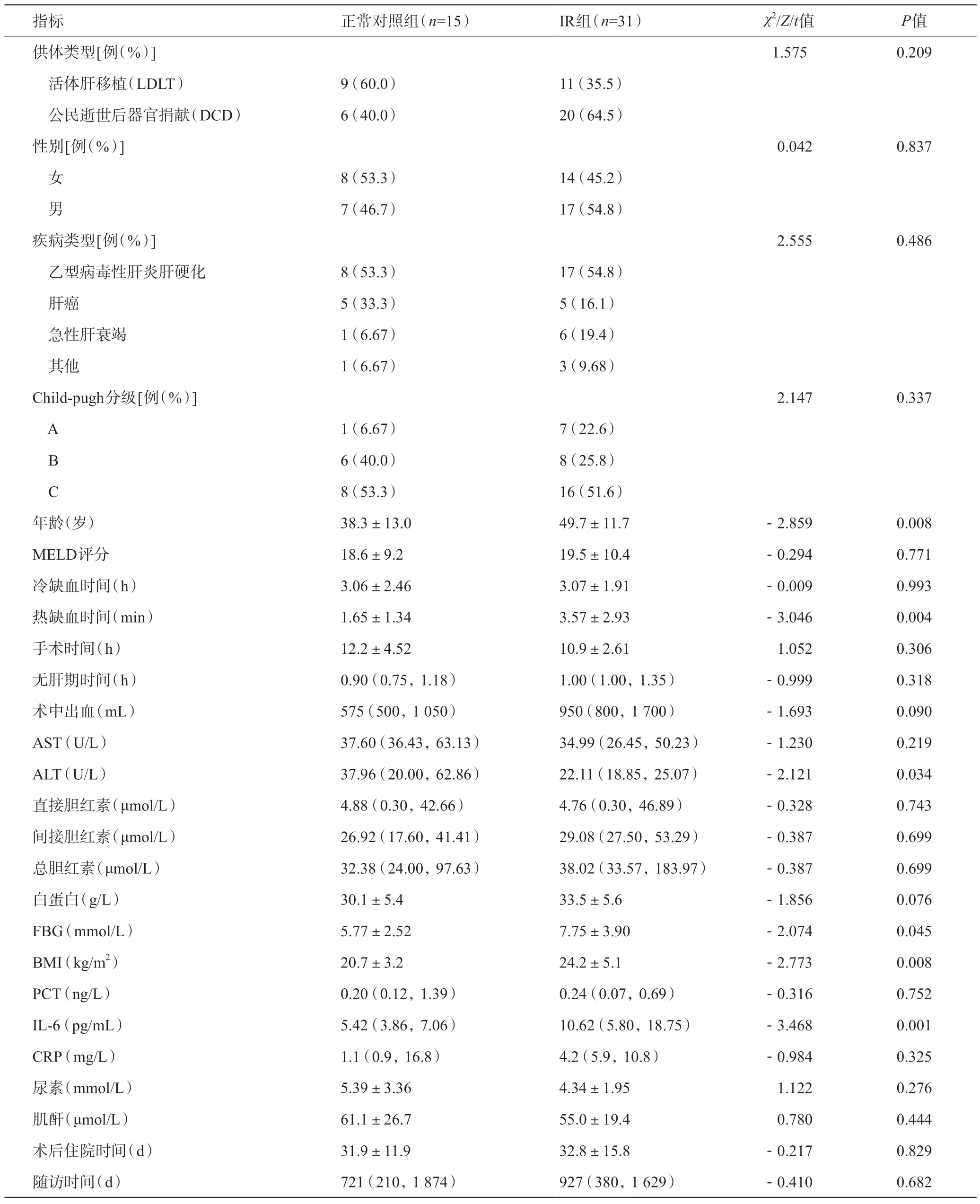
表1 正常对照组和IR组受体术前基线资料
2.2 T-HG组与NODM组受体基线资料
对T-HG组和NODM组受者基线特征进行了比较,发现乙型病毒性肝炎肝硬化、高龄、BMI较高的受体及接受DCD供肝的受体术后发生NODM的风险更高(P<0.05);NODM组随访时间高于T-HG组(P<0.05),其余变量在两组间无明显统计学差异。见表2。
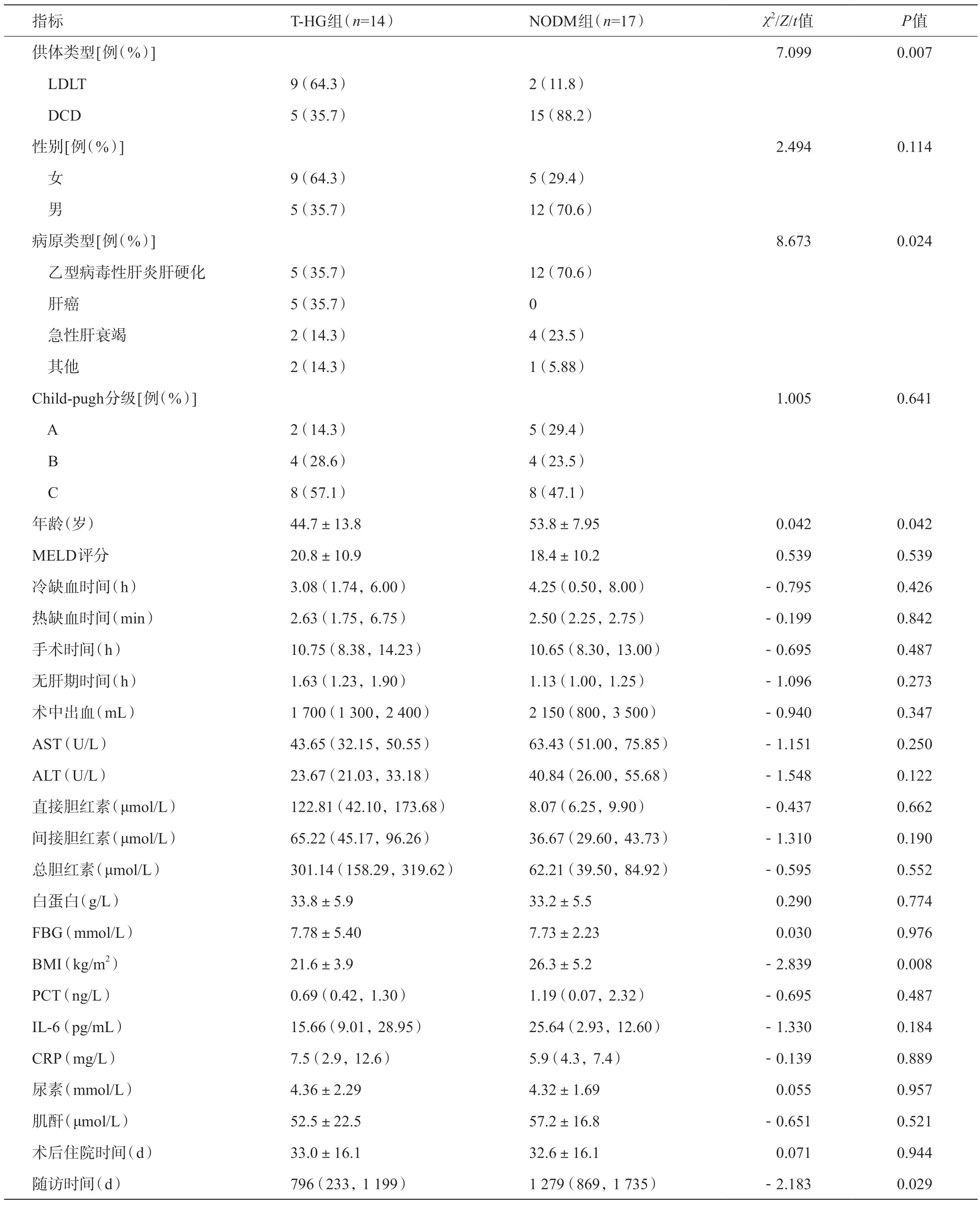
表2 T-HG组和NODM组受体术前基线资料
2.3 IR相关多因素Logistic回归
将表1 中单因素分析中有意义的指标纳入多因素Logistic回归分析中,表3显示WIT每增加1 min,发生IR的风险是原来的3.175 倍(OR3.175;95%CI0.641~1.670,P=0.025)。Logit(P)=-14.095+0.0735×年龄+1.155×WIT+0.271×FBG+0.267×BMI+0.069×IL-6,并绘制ROC曲线(AUC=0.771,95%CI0.667~0.875),同时构建校准曲线,证明模型拟合效果好,误差小(见图1)。
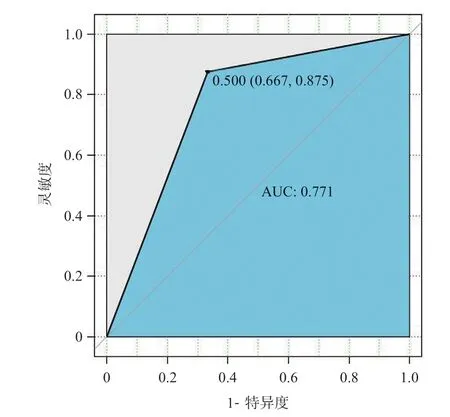
图1 多因素Logistic回归分析AUC曲线
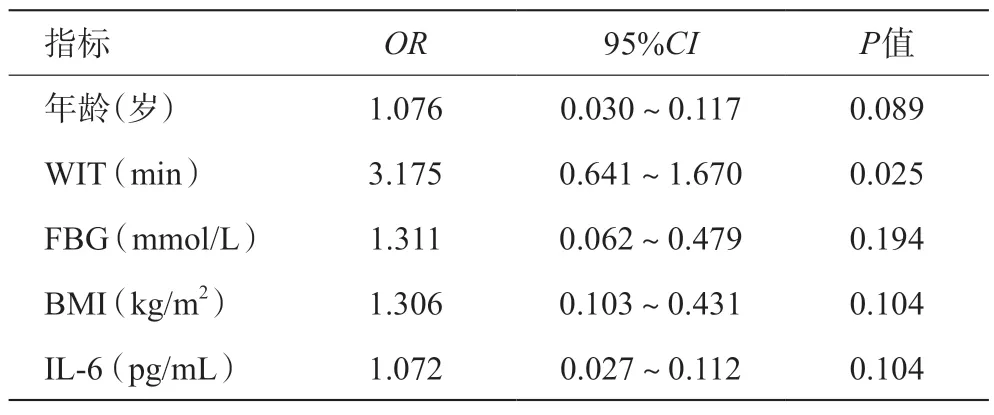
表3 LT术后IR的多因素Logistic回归分析
2.4 正常对照组与IR组术后CRP、IL-6、PCT水平
与正常对照组比较,IR组CRP水平在术后第4、7、14、21、28天明显升高,而IL-6水平在术后第7、14、21、28天明显升高,差异有统计学意义(P<0.05),见图2~3,术后30 d内两组PCT水平无统计学差异(P>0.05),见图4。
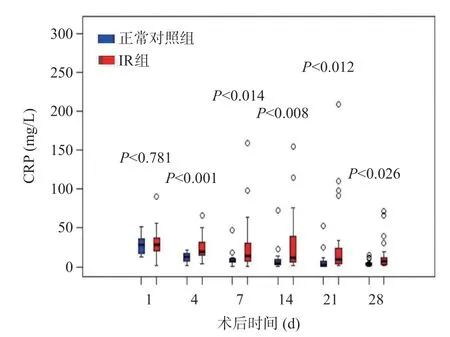
图2 LT术后正常对照组和IR组的CRP水平变化
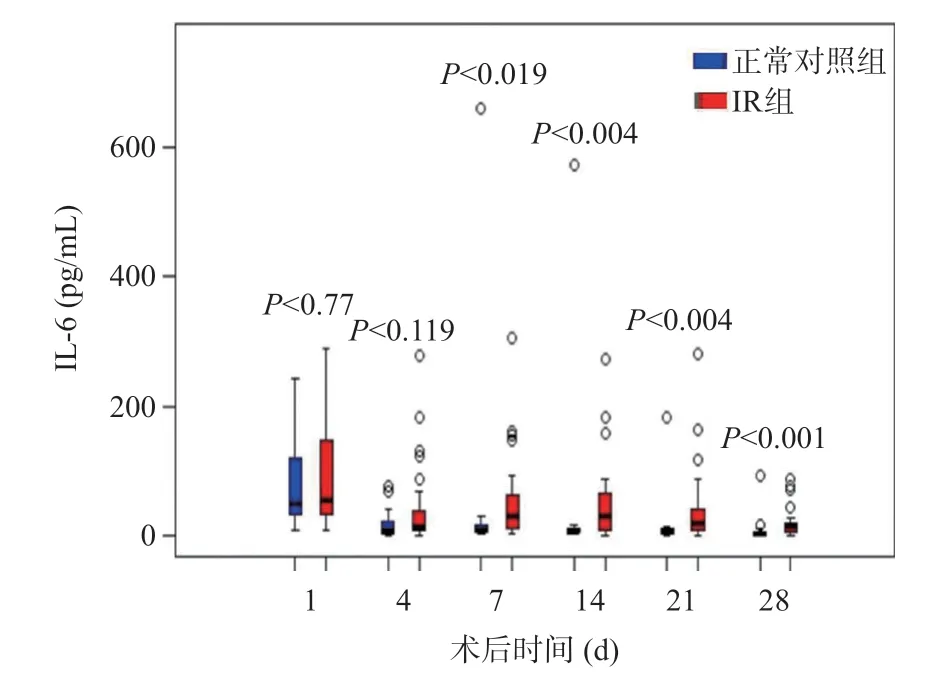
图3 LT术后正常对照组和IR组的IL-6水平变化
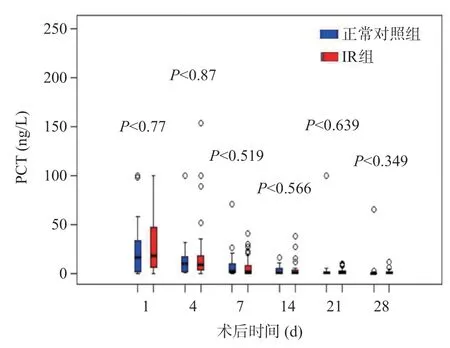
图4 LT术后正常对照组和IR组的PCT水平变化
2.5 正常对照组与IR组术后TAC血药浓度
TAC是公认的器官移植术后新发糖尿病的危险因素,通过对TAC浓度比较发现IR组术后第12、21天TAC浓度明显高于正常对照组,两组间差异有统计学意义(P<0.05),见图5。
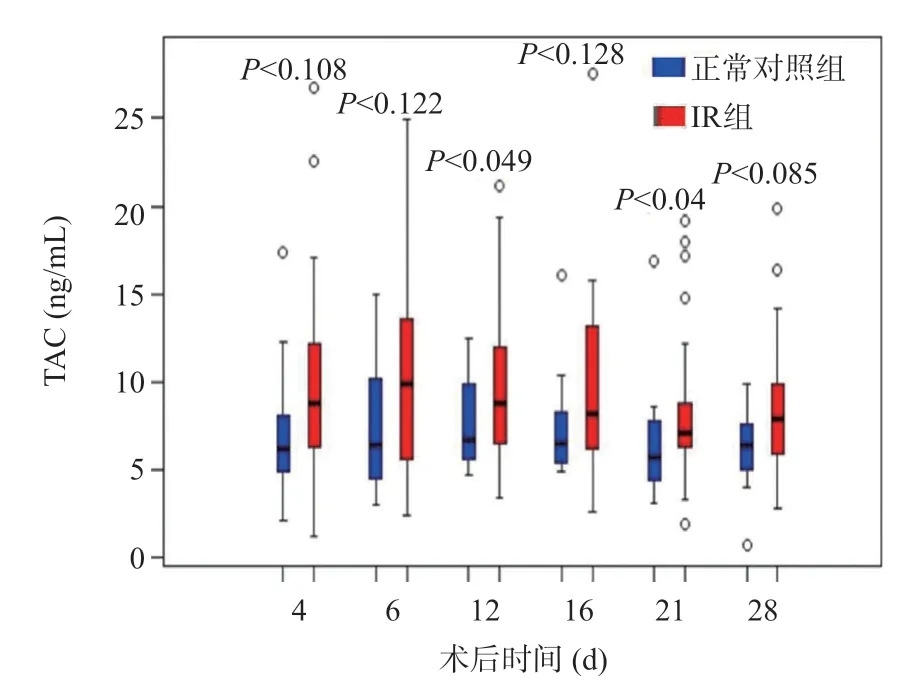
图5 LT术后正常对照组和IR组TAC浓度变化
2.6 正常对照组与IR组术后FBG水平
IR组术后第4、7、14、21、28天FBG明显高于正常对照组,差异有统计学意义(P<0.05),见图6。
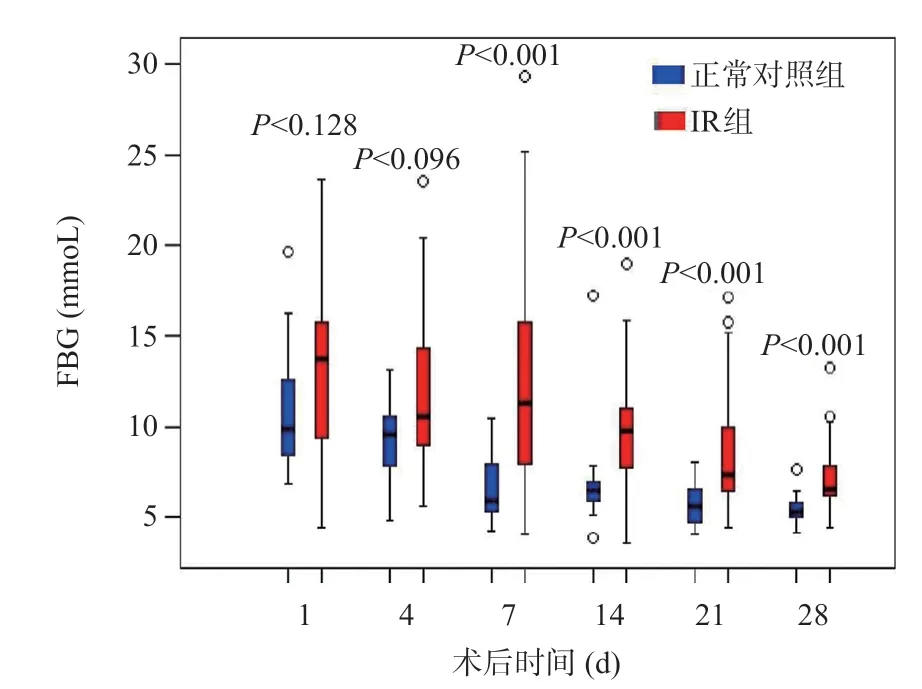
图6 LT术后正常对照组和IR组FBG浓度变化
2.7 IR与预后的关系
正常对照组死亡7例,随访时间(969±807)d,IR组死亡9 例,随访时间(1 035±632)d。构建Kaplan-Meier生存曲线,并进行Log-rank检验P=0.1817,两组受体存活率无统计学差异(P>0.05),见图7。
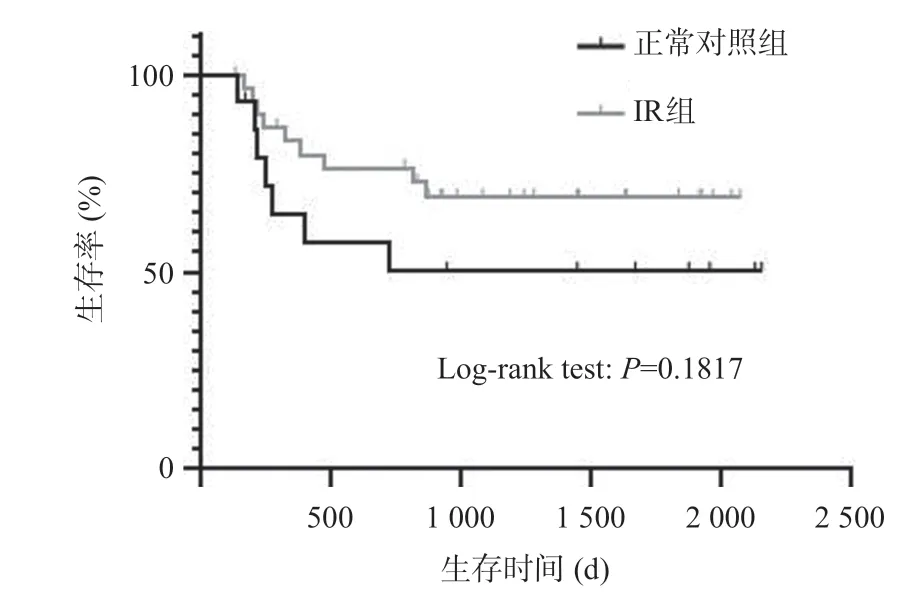
图7 两组Kaplan-Meier生存曲线对比
3 讨论
本研究发现:(1)高龄、BMI高、WIT时间长,术前FBG及IL-6较高LT术后发生IR的危险因素,其中WIT是独立危险因素;(2)年轻、BMI较低或接受LDLT供肝的受体,发展成为NODM的风险较低;(3)术后1个月内CRP、IL-6、FBG、TAC血药浓度高的受体发生IR的风险较高。
Hartog等[5]的研究证实肝脏WIRI影响IRS-1、IRS-2 和PI3K来诱导IR,且与移植物失功相关,是术后早期发生NODM的危险因素,热缺血可能会耗尽肝糖原储备并通过影响移植物的代谢储备而危及早期LT功能[6]。我们的研究结果也证实了这一发现,在LT的过程中包括了热缺血、冷缺血及缺血再灌注损伤,在我们的研究中WIT是受体术后发生IR的独立危险因素(OR3.175,95%CI0.641~1.670,P=0.025),有研究表明DCD肝移植术后早期的IR可能与热缺血损伤有关,长时间冷保存所造成的冷缺血是LDLT肝移植术后NODM的独立危险因素[7]。同时,在进行T-HG组与NODM组相比时,发现接受LDLT供肝的受体IR更容易逆转(P<0.05),原因可能是LDLT供受体一般情况和各项指标都好于DCD,包括年轻、较低的BMI,换而言之当肝脏代谢中的胰岛素信号通路激活时,这类受体可以提供更适宜的碳水化合物代谢环境[8]。表1中发现ALT(P=0.034),考虑与受体原发疾病有关。目前尚无文献报道ALT与术后IR有关,且其余肝功能指标组间比较无明显差异,故未纳入分析。
Toshiki等[9]的研究结果表明,在病理状态下,肝细胞中产生的大量炎性细胞因子如IL-1β和IL-6通过蛋白磷酸化的信号通路影响胰岛素的糖调节,在细胞因子和胰岛素的不同信号通路之间互相作用,互相影响,导致糖原沉积,也初次证明了是细胞因子,而不是糖调节激素,优先控制肝脏糖代谢,从而导致血糖异常。我们的研究发现术前IL-6较高的受体术后IR的发生率较高(P<0.05),同时我们的研究发现即使存在抗生素的使用、受体的个体差异等混杂因素,术后第7、14、21、28天IR组的IL-6水平均高于正常对照组,且差异有统计学意义(P<0.05)。术后IL-6水平升高的部分原因在于肝脏缺血再灌注损伤,有研究表明LT后释放的细胞因子对于血糖代谢的影响的潜在作用会在早期阶段变得明显,并随着多种因素的影响而使细胞因子的作用随着时间流逝而减弱[9],这也是我们的研究重点放在LT术后的早期阶段的原因所在。IL-6 在胰岛素信号传导通路的上游通过抑制胰岛素受体、IRS-1和PI3K激酶,进而影响胰岛素信号通路,导致IR[7]。通过我们的研究结果与既往文献佐证可以明确,IR与炎症反应相互影响、相互加重,通过炎症因子相关通路的研究可能为预防和治疗IR的提供新的思路和策略。
年龄是公认的NODM危险因素,Kuo等[10]报告的一项样本量为20 172 大型回顾性研究结果表明,年龄≥50岁是NODM的独立危险因素。我们的研究发现年龄每增加1岁发生IR的风险是原来的1.076倍(OR1.076,95%CI0.03016~0.11688,P=0.089)。年龄大于45~50岁的受者术后更容易发展为NODM,但只有受者年龄才是NODM发生逆转的独立因素,即受者年龄越小,其发生逆转可能性越大[11-12],在我们的研究中也证实了这一观点,T-HG组的平均年龄小于NODM组(P<0.05)。同时我们也发现BMI较高的受体术后发生IR的风险较高(P<0.05),BMI正常或较低的受体术后不容易发展为NODM。研究表明,当BMI≥25 kg/m2时NODM的发病率较BMI<25 kg/m2高1.25倍[13]。Anastácio等[14]的一项关于LT术后Meta的研究中指出脂联素水平较低是LT术后受体发生IR的危险因素,肥胖受体脂联素水平较低,TNF-α、IL-6、CRP、HOMA-IR较高。因此,肥胖受体在术前通过合理饮食和锻炼,来达到降低体重及腹围的目的,对于降低IR的发病率是有必要的。
有文献表明,术前FBG较高是术后NODM较强的预测因子[15],在我们的研究中通过单因素分析证实发现术前FBG较高的受体术后发生IR的风险更大(P<0.05),可能与肝功能不全和β细胞功能异常有关。Ling等[13]通过对中国肝移植数据库的10 204例受体数据进行分析发现术后30 d内持续血糖较高是NODM的独立危险因素,通过对本中心受体术后1个月内的血糖进行分析,发现IR组的术后5 次血糖结果中有4次血糖水平高于正常对照组(P<0.05),说明LT术后高血糖原因不能完全用手术创伤后的应激反应来解释,可能与LT特有的缺血再灌注损伤有关。
TAC是公认的导致LT术后IR的危险因素,在我们的研究中,纳入的受者术后标准免疫抑制剂方案均为TAC,无法评估TAC对于术后IR的发病率是否有预测意义,但是在术后1 个月的TAC血药浓度随访中我们发现第12、21天IR组高于正常对照组,且差异有统计学意义(P<0.05)。TAC作为钙调磷酸酶抑制剂,已经被证实可以引起IR,并进一步导致受体发生NODM[16]。Yagi等[17]研究证实LDLT术后3个月TAC血药浓度≥8 ng/mL是NODM的独立危险因素。Rodriguez-Rodriguez等[18]的研究证实TAC的毒性依赖于已经存在的β细胞功能障碍所导致的IR,转录因子在胰岛素产生和增殖中有重要的作用,如果不存在IR,TAC将不存在这些毒性作用。Lione等[19]的一项关于肾移植术后TAC临床试验证实缓释剂与普通剂型效果相当,因此,在免疫抑制不同剂型效果相同的情况下,选择对人体葡萄糖代谢影响最小的免疫抑制治疗方案,可能降低IR的发病率。
本研究样本量较小,存在选择偏倚和信息偏倚,但我们将数据尽可能详尽分享,希望能够充实LT数据库并在未来预防LT术后IR的研究中提供新思路,通过对LT术后IR的机制和危险因素进行研究对降低IR的发生率,提高受体远期生存率及生活质量具有重大的临床意义。
