计算机辅助手术系统在儿童肝脏原发性间叶肿瘤手术中的应用
2022-10-03何静陈胜男夏楠王菲菲李桐刘红郝希伟陈鑫董蒨
何静,陈胜男,夏楠,王菲菲,李桐,刘红,郝希伟,陈鑫,董蒨
(1.青岛大学附属医院 小儿外科,山东 青岛 266000;2.青岛大学 山东省数字医学与计算机辅助手术重点实验室,山东 青岛 266003)
肝脏间叶肿瘤是一类由纤维、脂肪和其他间叶细胞分化而来的良性和恶性肿瘤[1]。其中肝脏错构瘤(hepatic melancholy hamartoma,HMH)是一种良性间叶源性肝肿瘤,由各种间叶构成,大部分发生在2岁以内,个别病例可超过5岁。有研究证明该肿瘤可恶化成为肝未分化肉瘤,使肿瘤恶性程度加剧[2]。另外,未分化胚胎性肉瘤(undifferentiated sarcoma of the liver,UESL)是肝脏原发间叶源性肿瘤(hepatic mesenchymal tumor,HMT)类别中发病率最高的恶性肿瘤,该肿瘤仅发生于肝脏,约占所有小儿肝脏恶性肿瘤的7%[3]。综合来看,这两种间叶肿瘤都具备生长迅速、瘤体大的特点[4-5],最有效的治疗手段仍以手术切除为主[6-7]。
由于肝脏解剖结构复杂,手术难度较大,尤其是婴幼儿肝脏血管精细且多变,处理比成人更困难[8],因此精准的术前判断与规划尤为重要。近年来随着数字医学技术的兴起和人体脏器三维可视化技术的临床应用,大大提升了外科手术的精准性和安全性[9]。海信计算机辅助手术系统(Hisense computer assisted surgery system,Hisense CAS)是一款基于小儿肝胆胰脾疾病研发改进的计算机辅助手术系统。我们前期应用发现其可以清晰显示肿瘤与血管的关系,实现对小儿肝脏血管的精准重建,提高肝脏肿瘤的可切除性[10]。现已应用于小儿及成人肝、胆、胰、胃、腹膜后肿瘤、肺及泌尿系统疾病的诊断,取得良好效果。本研究对2009年4月至2020年11月青岛大学附属医院收治并进行肝脏肿瘤切除术的原发性肝脏间叶肿瘤患儿临床资料进行回顾性分析。
1 资料和方法
1.1 一般资料
2009年4月至2020年11月在青岛大学附属医院小儿外科共收治肝脏间叶肿瘤8例,其中男3例,女5例,年龄0.9~9岁。临床表现:均有腹部膨隆、腹部不适等症状。AFP 0.61~52.98 ng/mL,详见表1。4例仅进行上腹部增强检查(表1病例5至8),4例对增强CT进行三维重建(表1病例1至4)。
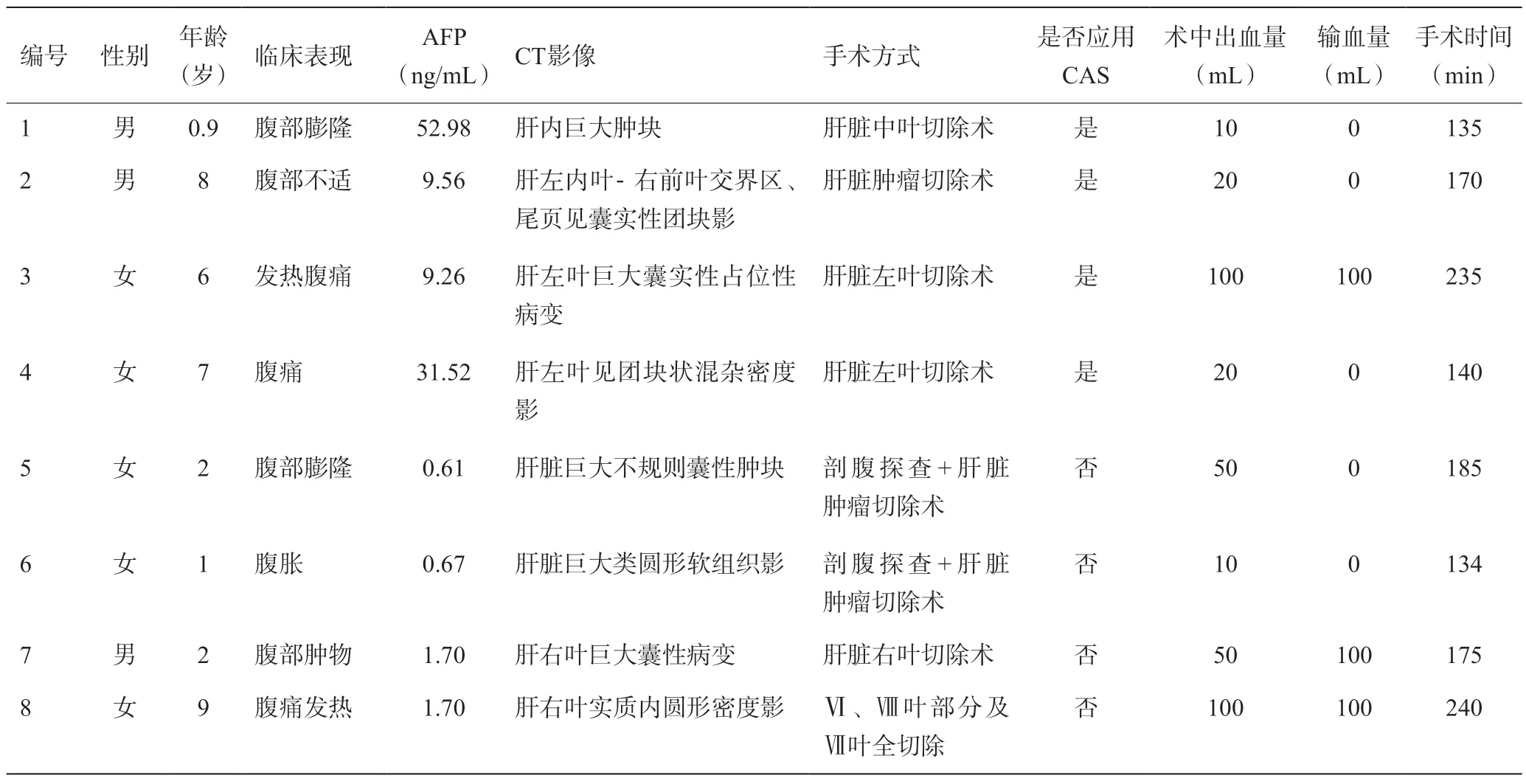
表1 肝脏原发性间叶肿瘤患儿的临床资料
1.2 设备及材料
CT:美国GE64层螺旋CT、飞利浦MX4000双层螺旋CT、美国Gebrightspeed Elite16层CT。
海信计算机辅助手术系统:青岛大学附属医院在国家科技计划课题支持下与海信集团联合研发的手术规划系统[11]。
1.3 术前检查与手术规划
1.3.1 上腹部增强CT检查:检查前常规禁饮食4~6 h,对不配合的儿童采取10%的水合氯醛保留灌肠,剂量为0.5 mg/kg。建立静脉通道,注入碘海醇15~20 mg/kg。扫描结束时将图像数据传至工作站并以医学数字成像和通信(digital imaging and communications in medicine,DICOM)格式存储。
1.3.2 三维重建:将所扫描CT的三期图像文件导入CAS海信系统进行三维重建。
1.3.3 手术模拟:手术方案设计及模拟肝切除的方法及对比分析:(1)患儿术前由术者团队首先通过观察二维CT影像制定手术切除方案。患儿1 至4 再行三维成像,深度分析及对手术规划方案进行重新修订,使用计算机辅助手术系统进行模拟切除,精确计算肝脏体积。根据肝脏肿瘤的部位、数目、与周围重要血管和胆管的关系制定相应的手术方案。(2)对比分析计算机辅助三维成像与二维影像的不同及对手术规划的影响。
1.4 手术方法
根据术前CT或三维成像结果系统规划手术方案,选择右上腹肋缘下斜切口或“人”字形切口进入腹腔,探查肿瘤位置、大小、以及与周围脏器、血管的关系。依据术前规划切断肝脏相应的周围韧带,显露并解剖肝门,将欲切除肝叶的脉管予以结扎切断。注意保护重要血管,将肿瘤完整切除。肿瘤切离过程可行肝门阻断,阻断时间小于20 min。
2 结果
2.1 影像学检查结果
8例间叶肿瘤患儿CT均显示为单发囊实性占位,其中5例边缘尚清,3例边缘欠清,具体位置见表1。瘤体表现为肝内巨大低密度影,最大径约113~150 mm。可见团块状或条索状混杂密度影,周围组织器官受压明显,肝内胆管可有扩张。部分病例增强CT检查显示三期扫描强化程度不明显。超声检查发现,部分病例表现为实性肿块,主要为高回声,并伴有局灶性无回声、囊性部分,CT扫描的囊性外观与超声检查上的实性外观之间存在差异。
2.2 三维成像及模拟肝切除
4 例患儿成功对肿瘤、肝脏及周围血管进行三维重建。根据患儿肿瘤的情况,结合肿瘤、肝管系统等进行模拟切割,进行多种模拟肿瘤切除的方法,选择最优的切除方式,进行合理的术前规划(见表2)。
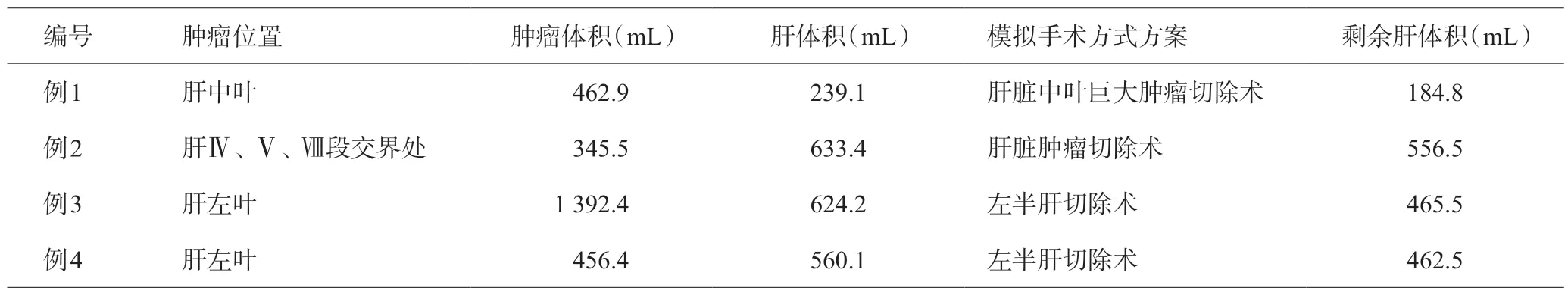
表2 三维重建结果
2.3 手术结果
8例均成功切除肿瘤,肿瘤位置形状符合术前判断(见表1)。术中所见与三维重建结果相符,手术过程预见性强。4例未行三维重建的患儿平均手术时间为(184±44)min,术中平均出血量为(53±37)mL,行三维重建的4 例病例平均手术时间为(170±46)min,术中平均出血量为(38±42)mL。术后患儿均恢复良好,随访时间3个月~5年,未见复发。
2.4 典型病例
病例1:患儿男,0.9岁,因“发现腹腔实性占位14 d”入院。于外院行腹部超声检查示肝脏占位,后于我院行CT检查提示,患儿肝脏实性占位,肿瘤巨大,肝内巨大软组织肿块延伸至下腹部腹腔内,压迫门静脉的主干,肝门静脉的左右支。左下腹脾下方片状影,肝母细胞瘤可能性大(见图1A~C),后行超声引导下病理穿刺,提示穿刺结果为错构瘤可能性大,但由于穿刺结果较少,仍需结合临床及影像学。三维重建提示:肿瘤位于肝中叶,挤压肝脏变形(见图1D~F)。由于肿瘤位置居中,涉及肝脏Ⅳ、Ⅴ、Ⅷ,与肝脏主要血管、胆管结构及深度有关,需要大量切除,计划采取肝中叶切除术,肝中叶切除术技术复杂,严密谨慎的术前规划是实施手术的前提条件。术前精确评估肿瘤体积为462.9 mL,肿瘤虽紧贴周围血管,但未侵犯门静脉(见图1G)。利用海信CAS系统模拟手术后,计算出行肝脏中叶切除术后,肝脏剩余体积为184.8 mL,发生术后肝衰竭可能性较小。按照术前规划进行手术,完整切开肿瘤(见图1H),术后病理证实为肝错构瘤(见图1I),患儿术后恢复好,无复发。
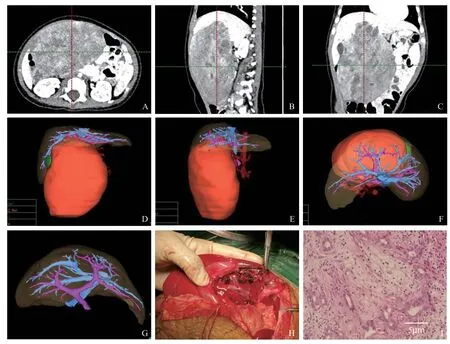
图1 病例1,患儿男,0.9岁,肝错构瘤诊疗情况
病例3:患儿女,6 岁,因“发热腹痛5 d,发现肝占位性病变3 d”入院。行CT提示肿瘤体积较大,位于肝左叶,肿瘤凸向上方生长,食管下段及邻近器官受压,周围脂肪间隙模糊。伴有肝内胆管扩张(见图2A~C)。由于患儿肿瘤体积较大,属于巨大肝脏肿瘤,以往对于小儿巨大肝脏肿瘤,多认为是不可切除肿瘤。因巨大肝脏肿瘤易出现术中大出血、术后肝功能衰竭等围手术期最危险的并发症。应用三维重建后(见图2D~F),显示肝脏体积624.2 mL,肿瘤体积1 392.4 mL,占肝脏体积69%。患儿左半肝挤压变形,肝静脉、门静脉及其右侧分支、下腔静脉均被肿瘤挤压移位,但无明显浸润、包裹。术者进行多种术式的模拟,对肿瘤、肝脏管道系统等进行组合、模拟切割确定手术方案为左半肝切除术。术中取上腹正中“人”字形切口,探查见肝左叶15 cm×12 cm×10 cm大小囊实性肿块。按计划决定行左半肝切除术(见图2G)。手术顺利,术中出血量约100 mL,输血浆100 mL。术后病理证实为肝脏未分化胚胎性肉瘤(见图2I)。患儿自2020年11月手术至今,定期返回我院术后化疗,恢复良好。
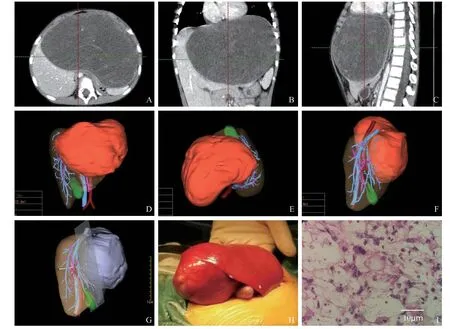
图2 病例3,患儿女,6岁,肝脏未分化胚胎性肉瘤诊疗情况
3 讨论
肝脏原发性间叶肿瘤临床罕见,其良性病变以海绵状血管瘤最为常见,少见的有局灶性结节增生、肝脏炎性假瘤和错构瘤等,恶性的有纤维组织细胞瘤、各种肉瘤等。由于血管瘤起源于动静脉短路,生长模式继发于扩张,而不是肥大或增生,严格来说属于血管畸形。故排除于此次研究,选择病例较多的错构瘤和未分化胚胎性肉瘤列入了研究范围。
在本组病例中,8 例患儿AFP均未升高或仅轻微升高。而肝母细胞瘤或肝脏等实体肿瘤中,AFP水平常可达500 ng/mL以上。将AFP水平与影像学相结合,可以将间叶肿瘤与实体肿瘤相鉴别。另外,免疫组化研究表明,AFP是由增生的肝细胞和肿物的囊性胆管上皮细胞产生的[12]。本组病例中,囊性成分更多的错构瘤AFP水平升高稍明显,这也支持AFP局部产生的假设。
无论是良性还是恶性的间叶肿瘤,化疗效果均不理想。现阶段,肝脏错构瘤和肝未分化胚胎性肉瘤的首选治疗方式都是肿瘤切除或以肿瘤切除为主辅助化疗等[6-7]。而肝切除术前需根据各种影像学检查判断是否能安全地完成肿瘤切除。增强CT可以清晰地显示肿瘤的界限,但很难更加清楚地显示肿瘤与门静脉及肝静脉的关系[13]。典型病例1中,患儿肿瘤巨大,且位于肝脏中心,肿瘤的特殊位置给手术带来了困难,三维重建后,清晰显示了肿瘤部位及与血管的毗邻关系,调整角度见肿瘤虽贴近门静脉,但未对其造成侵犯,进行术前规划后,成功实施了肝中叶肿瘤切除术。计算机辅助三维成像能全方位显示肝脏及其内部管道结构的位置、形态及其肿瘤与周围大血管等结构的解剖关系,提供二维CT图像难以显示的区域,提高术者术前对肿瘤与血管关系的精准定位,为肝切除手术的安全实施提供保证[14]。
由于肝脏间叶肿瘤往往体积巨大,完整切除肿瘤后,会因为剩余肝体积不足,导致术后肝功能障碍等并发症的发生,因此术前残肝比率的评估对手术预后至关重要[15]。典型病例3中,患儿CT提示肝脏体积624.2 mL,肿瘤体积1 392.4 mL。我们在术前模拟肿瘤切除,预测行左半肝手术切除后,患儿剩余肝脏体积约为465.5 mL,保证了手术的安全性。术前模拟手术切除及计算残肝体积作为三维重建图像的优势,可以提高手术安全性,降低术后肝功能衰竭的发生率[16]。同时三维重建还可以模拟手术还能预见性的制定血管离断及重建方案来保护残肝功能,帮助患者术后肝功能恢复。
综上所述,Hisense CAS计算机辅助手术系统能立体直观显示肿瘤位置、周围组织压迫及血管系统变异情况,并辅助医师进行术前手术规划,为巨大原发性间叶肿瘤患儿的个体化精准手术治疗提供保障,提高儿童复杂化肝肿瘤切除的成功率,对精准手术的实施具有重要意义。由于肝脏间叶肿瘤发生率较低,研究数据较少,但小范围内可见行三维重建后的病例在手术时间和出血量方面都具有一定优势,即手术时间更短,出血量相对较少。后续我们团队仍会继续扩大病例样本和应用范围,进行对照研究,验证结果。
