不对称脱羧加成反应研究进展
2022-09-29武京杰
武京杰
(温州大学 化学与材料工程学院,浙江 温州 325035)
手性普遍存在我们身边,是生物体的基本组成部分。由于R、S 构型的药理活性不一致,药品监督管理机构要求上市的药物是单一的有效构型。近年来,人们对手性药物以及手性功能材料的需求日益增多。而目前获取这些手性化合物的主要途径通过人工合成,其中不对称催化和手性拆分是获得手性化合物最直接和有效的方法[1]。
Aldol-脱羧反应是获得手性羧酸衍生物重要途径之一。在自然界普遍存在各种脱羧反应,因此许多课题组以此为出发点研究了不同种类的不对称脱羧加成反应,希望以此能得到高对映选择性、高效率的手性羧酸衍生物[2-7]。图1为一些手性羧酸衍生物的结构式。
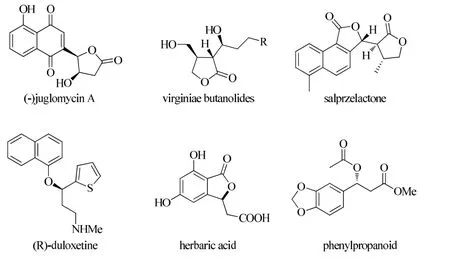
图1 一些手性羧酸衍生物的结构式
早期不对称aldol-脱羧反应主要集中于在活性较高的丙二酸单硫酯、β-酮酸、氰基乙酸等。近几年来利用丙二酸及其衍生物作为亲核试剂,进行aldol-脱羧反应得到宽泛的研究,单边氧酯类的手性分子普遍存在自然界中,可以通过丙二酸单边氧酯进一步反应得到其衍生物。而丙二酸单边酯在脱羧构建的手性β-羟基酯有其重大的药物价值,因而活性较低的丙二酸单边氧酯的脱羧反应具有较高的应用前景。
1 丙二酸类脱羧反应
2004年,Franco Cozzi 课题组首次报道了丙二酸单边硫酯与醛类化合物的反应。当反应在催化量的铜(II)盐、手性酒石酸衍生的双苯并咪唑和非手性碱的情况下进行时,向醛中添加丙二酸半硫酯得到了39%的对映选择性。最终实现了丙二酸单边硫酯与脂肪醛和芳香醛化合物的aldol-脱羧反应。该反应缺点在于仅得到中等收率及较低的对映选择性。但对于后面丙二酸类不对称脱羧加成反应探究具有一定的指导性作用[8]。图2为丙二酸单边硫酯的aldol-脱羧反应式。
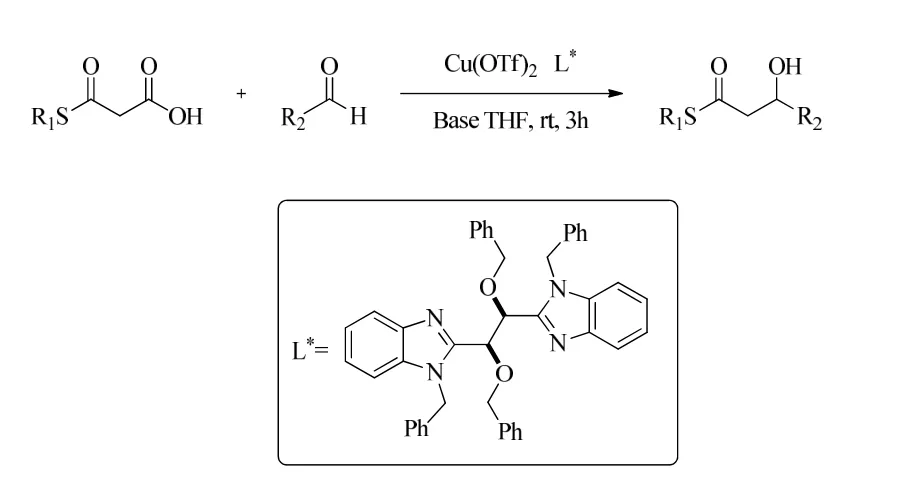
图2 丙二酸单边硫酯的aldol-脱羧反应式
2007年,Matthew D.Shair 课题组报道了铜(II)催化甲基丙二酸单硫酯烯醇化aodol-脱羧反应,更重要的是他们对于醛的加成、脱羧和β-羟基烯酸的质子化作用机理做出了解释,他们通过核磁共振技术监测了该反应的过程,证明了此反应的转化是先加成后脱羧的步骤。通过对金属、配体、溶剂、温度等反应因素的考察,在比较温和的条件下,得到了对映选择性高的β-羟基硫酯产物[9]。图3为
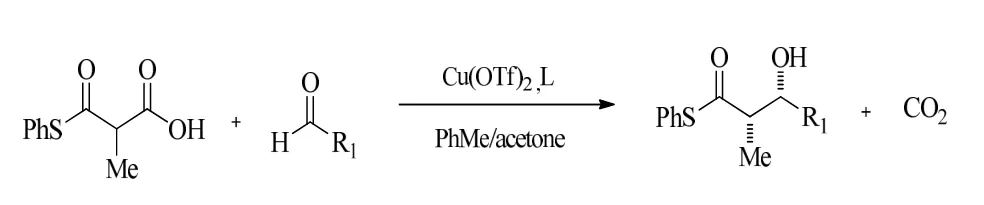
图3 铜(II)催化甲基丙二酸单硫酯烯醇化aodol-脱羧反应
2011年,Norio Shidta 课题组同样报道了丙二酸单硫酯的aldol-脱羧反应,而区别在于将该反应的受体由原来的普通脂肪醛与芳香醛拓宽到靛红及其衍生物。他们利用金鸡纳碱衍生物催化作用下,通过对催化剂、溶剂、温度、添加剂等反应因素的考察,在室温的条件下,实现了丙二酸单硫酯与靛红衍生物的加成-脱羧反应,得到了90%以上的对映选择性和90%以上的收率β-羟基硫酯产物[10]。他们实现了一种单边硫酯高度对映选择性脱羧反应,且所得产物可转化为手性氟氨醇。这是第一个关于对映体选择性合成(−)-氟氨醇B 的报道。图4为丙二酸单硫酯与靛红衍生物的加成-脱羧反应。
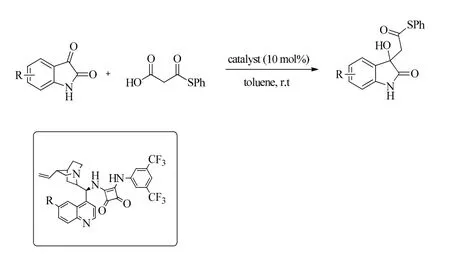
图4 丙二酸单硫酯与靛红衍生物的加成-脱羧反应

图5 镍(II)与唑啉配体配位催化丙二酸与色胺酮和靛红及其衍生物的反应
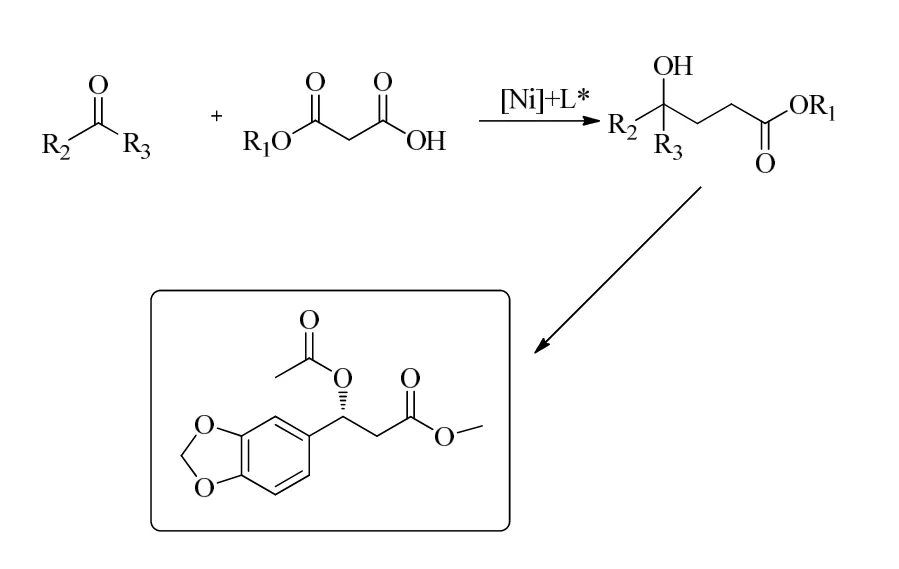
图6 丙二酸单边酯和芳香醛酮与脂肪醛酮的不对称aldol-脱羧反应
2021年,蒋俊课题组报道了利用了五水合醋酸镍(II)与唑啉配体配位催化体系,实现单边内酯与不饱和酮、醛、靛红类底物的不对称aldol-脱羧反应,通过对唑啉配体、溶剂、温度、添加剂等反应因素的考察,在比较温和的条件下,实现了反应收率及立体选择性的良好控制,得到了一系列β-羟基内酯类化合物[13]。此外,利用氮甲基苯胺对产物进行开环反应,可得到多取代1,4-二醇化合物;在钯碳氢化条件下可将α取代的β-羟基内酯转化成为脂肪族的手性叔醇。图7为五水合醋酸镍(II)与唑啉配体配位催化体系下的aldol-脱羧反应。

图7 五水合醋酸镍(II)与唑啉配体配位催化体系下的aldol-脱羧反应
2 结束语
目前已经有大量课题组对不对称加成-脱羧反应进行了研究,已经实现了丙二酸及丙二酸单边酯酯为亲核试剂的不对称aldol-脱羧反应,在相对温和的条件下,实现了一系列合成手性羧酸衍生物方法。如今1,3-二羧酸类化合物给体主要集中在活性较高的丙二酸单硫酯、丙二酸等,相对活性较低的丙二酸单边酯、丙二酸单边内酯的相关研究依然较少。然而手性内酯类结构在药物和天然产物等活性分子广泛存在。虽然可以通过硫酯衍生物进一步脱硫转化为β-羟基氧酯,但是缺乏原子经济性[14-20]。目前合成手性内酯的方法研究却主要局限在烯醇硅醚参与多官能化内酯的官能团转化中。然而,直接利用单边内酯反应存在的问题在于内酯羰基的α-位质子酸性较低,导致其在通常条件下难以烯醇化;此外,内酯在亲核反应条件下存在开环的可能性,给带来了一定的困难;在此基础上,目前已经实现类丙二酸单边内酯的反应,但仍然存在其底物局限性的问题。因此,利用催化不对称方法实现内酯类化合物的α-位直接官能化[20-25],实现反应的普适性仍具挑战性,这也吸引了众多课题组为之不懈努力[25-31]。
