盐度驯化对虹鳟幼鱼鳞片再生过程MMP2和MMP9基因表达的影响
2022-09-28王刘永周启苓杨云生杨二军李政鑫
王刘永,周启苓,马 骞,2,杨云生,杨二军,陈 刚,2,李政鑫
(1.广东海洋大学水产学院,广东 湛江 524025;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025)
基质金属酶蛋白(Matrix metalloproteinases,MMPs)属于Metzincin 蛋白超家族[1],参与调控生物体多种信号通路,对骨组织细胞外基质重塑,器官发育,细胞迁移、增殖和凋亡,先天免疫和创伤修复等各项生命活动均有重要调节作用,在骨再生过程中发挥重要作用。MMP2(Gelatinase A)和MMP9(Gelatinase B)不仅参与调控骨基质的降解,还可介导成骨细胞的迁移及破骨细胞的活化、迁移和贴附等过程,是骨重建和骨吸收的关键调控因子[2-3]。MMP2 和MMP9 可促进骨髓间充质干细胞分化为成骨细胞[4];缺乏两种酶则抑制由破骨细胞介导的骨吸收过程,从而影响骨重建进程[5]。MMP2 和MMP9 在金玛丽鱼(Poecilia latipinna)尾鳍再生初期表达水平增加,提示MMPs 在尾鳍再生前的炎症调节及再生早期细胞外基质重塑中发挥作用[6]。Ando 等[7]研究发现,表达MMP9 的细胞在斑马鱼(Danio rerio)鳍条再生过程中可作为成骨祖细胞(Osteoblast progenitor cells,OPCs)进一步分化为成骨细胞,表明MMP9参与调节鱼类骨骼再生过程。
鳞片是鱼类外骨骼的重要组成部分,也是鱼类特有的皮肤衍生物,其细胞组成和骨化机制与内骨骼十分相似,有保护身体、提供外部支持等功能[8-9]。硬骨鱼类鳞片再生能力极强,一旦去除,可在几周内生长到与正常鳞片相似大小和厚度[10-11]。此外,鳞片直接暴露于水环境且更易于采集,因此可作为骨骼再生研究的优良载体。已有研究表明,MMP2和MMP9在斑马鱼鳞片再生过程的早期阶段大量表达,并在再生完成时恢复至与正常鳞片中相同的表达水平[11]。由此推测,MMP2 和MMP9 参与调节鱼类鳞片再生过程,二基因表达水平可在一定程度上反映鳞片再生进程。
鱼类的生存环境复杂多变,盐度、温度变化等均会对鱼类各项生命活动产生影响。目前,关于盐度变化对鱼类骨骼再生过程的影响少有报道,仅见Guerreiro 等[12]研究的欧洲舌齿鲈(Dicentrarchus labrax)再生鳞生长参数及钙化水平在盐度驯化过程中的变化。虹鳟(Oncorhynchus mykiss)属鲑形目(Salmoniformes)鲑科(Salmonidae)太平洋鲑属(大马哈鱼属)(Oncorhynchus),是目前世界上养殖最为广泛的冷水性经济鱼类之一[13],也是我国养殖产量最高的鲑鳟鱼类[14]。虹鳟对盐度的适应性较强,经盐度驯化后可在海水中正常生长[15],但入海后的存活率、生长速率等与盐度驯化方式密切相关[16]。本研究检测MMP2 和MMP9 基因在虹鳟幼鱼鳞片再生过程中表达水平的变化,探讨MMPs 基因在鳞片再生过程中的作用,进一步分析盐度驯化对鳞片再生过程的影响,为揭示鱼类骨骼再生的分子调节机制提供基础资料,为鲑鳟鱼类的养殖生产实践提供参考。
1 材料方法
1.1 样品采集
虹鳟幼鱼体长(16.33±1.30)cm,体质量(52.21± 7.24)g,采集于山东省潍坊市临朐县淡水虹鳟养殖基地。实验前将虹鳟置于直径1.6 m,高0.6 m 的PE 桶中,水深约0.3 m,流水暂养3 d(盐度3,水温14~16 ℃),光周期条件为12 h:12 h,每天8:00、16:00投喂配合饲料(总投喂量约为鱼体质量的3%)。
设置盐度驯化组(Salinity acclimation,SA)和对照组(Control group,CG),每组设置3个平行。实验前刮除虹鳟幼鱼左侧(背鳍后基部至尾柄处,长约2 cm,宽约1 cm)鳞片。实验用海水晶调节盐度,用盐度计测定盐度。盐度驯化组以4/d 的速率将盐度由3 升至27,对照组盐度为3。分别在驯化1、3、7、14、21 d 时随机取幼鱼3 尾,解剖,分别采集鱼体左侧带皮再生鳞(Regenerated scale,RS)及右侧对应位置的带皮正常鳞片(Ontogenic scale,OS),立即置于液氮中速冻,转移至-80 ℃保存备用。
1.2 MMP2和MMP9基因的系统进化分析
基于基因MMP2(GenBank 登录号:ON249089)和MMP9(GenBank 登录号:ON249090)的序列信息,利用EditSeq 软件预测虹鳟MMP2 和MMP9 基因的开放阅读框,并将其翻译成对应的氨基酸序列,用DNAMAN软件与NCBI其他鱼类及高等脊椎动物的MMP2 和MMP9 氨基酸序列进行多重序列比对,利用MEGA 6.0 软件以邻接法(Neighbour-Joining,NJ)构建系统进化树,针对进化树各分支结点进行1000次重复抽样检验。
1.3 引物设计
基于虹鳟MMP2 和MMP9 的cDNA 序列,利用Primer Premier 5.0 软件设计基因特异性引物MMP2-F/R、MMP9-F/R,内参引物18S-F/R(表1),用于实时荧光定量PCR(qRT-PCR)检测。
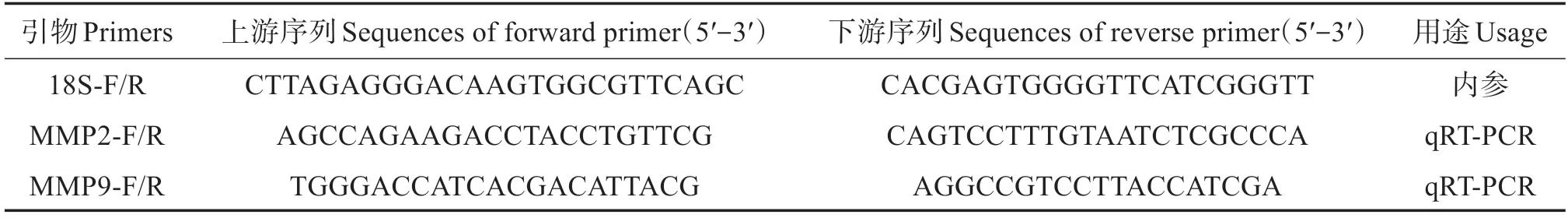
表1 所用引物序列Table 1 Primer sequences
1.4 总RNA提取及cDNA第一链合成
按照Trizol(Invitrogen)法提取虹鳟幼鱼鳞片总RNA。通过琼脂糖凝胶电泳和Nanodrop 2 000核酸蛋白测定仪(Thermo scientific)分别检测总RNA 的完整性及浓度,根据EasyScript®Fist-Strand cDNA Synthesis SuperMix(TransGen)说明书,将1 μg 总RNA 反转录合成第1 链cDNA,保存于-20 ℃冰箱待用。
1.5 实时荧光定量PCR检测
分别用引物MMP2-F/R 及MMP9-F/R,以18S rRNA 基因为内参,检测盐度驯化组及对照组正常鳞和再生鳞中MMP2 和MMP9 基因的相对表达量。qRT-PCR 根据TransStart Top Green qPCR SuperMix试剂盒(TransGen)说明操作,在LightCycler 96 荧光定量PCR 仪(Roche)上进行,各样品设置3 个重复。所有引物均经过扩增效率检测(E>90%;R2>0.990),qRT-PCR产物经测序验证。
根据qRT-PCR 测得的Ct值,采用2-△△Ct法分别计算两个实验组各时间点再生鳞及正常鳞中MMP2和MMP9 基因的相对表达量,以再生鳞与正常鳞中MMPs 基因相对表达量比值表示再生鳞MMPs 基因表达水平。所得数据均以平均值±标准差(n=3)表示,使用SPSS 19.0 中的单因素方差分析(one-way ANOVA)法及Duncan's 多重比较,分析各基因表达水平在鳞片再生过程中不同时间点的差异水平,P<0.05时显著差异,若P<0.01则差异极显著。
2 结果与分析
2.1 MMP2和MMP9基因的系统进化分析
虹鳟MMP2和MMP9基因的开放阅读框分别为1 968、2 028 bp,分别编码655和676个氨基酸(图1)。虹鳟MMP2 和MMP9 与已报道的其他硬骨鱼类及高等脊椎动物相应MMPs氨基酸序列的系统进化树中(图2),虹鳟MMP2 和MMP9 均首先与鲑科的大西洋鲑(Salmo salar)聚为一支,再与鲑形目白斑狗鱼(Esox lucius)的聚为一支;鲑形目MMP2 和MMP9分支均首先与鲈形目、鳉形目、鲽形目及颌针鱼目种类聚为一支,再与鲤形目、鲇形目及电鳗目种类聚类;在硬骨鱼类MMP2 和MMP9 分支中,骨舌鱼目的美丽硬仆舌骨鱼(Scleropages formosus)MMPs均单独形成一分支。

图1 虹鳟MMP2和MMP9基因编码的氨基酸序列Fig.1 Deduced amino acid sequences of MMP2 and MMP9 in Oncorhynchus mykiss
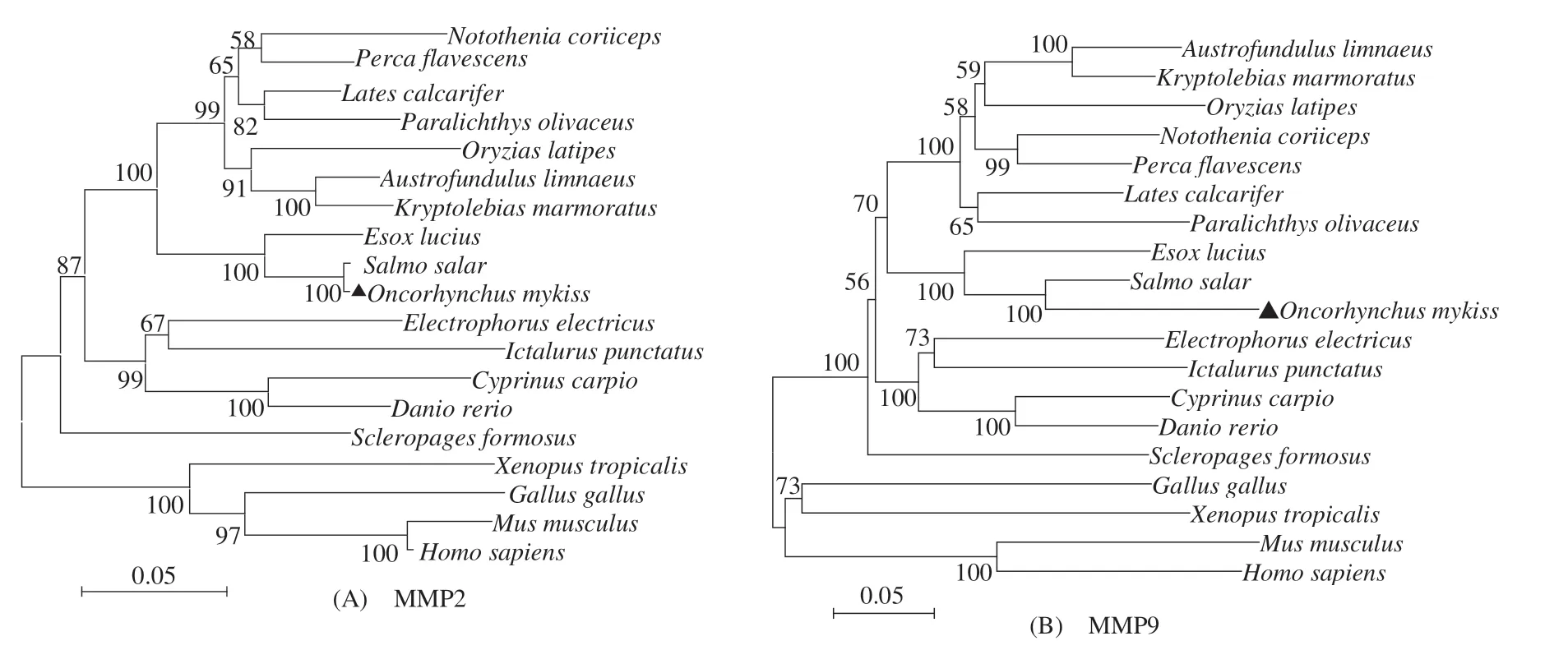
图2 基于MMP2和MMP9氨基酸序列构建的NJ系统进化树Fig.2 Phylogenetic trees of MMP2 and MMP9 amino acid sequences based on Neighbor-Joining method
2.2 MMP2 和MMP9 基因在鳞片再生过程中的表达水平
如图3所示,在虹鳟幼鱼鳞片再生过程中,对照组MMP2 表达水平呈先升后降趋势:7 d 时最高(约为1 d 的8 倍),21 d 时依然显著高于1 d;盐度驯化组中再生鳞片MMP2 基因表达水平变化趋势与对照组相似,总体呈先升后降趋势:3 d 时最高(约为1 d 的2.2 倍),7 d 时显著低于1 d,14 d 时最低(为1 d的17%)。对照组MMP9 表达水平在3 d 时显著降低后,在7 d 时升至最大值,14 d 后始终维持在较低水平;在盐度驯化组中,MMP9表达水平总体呈降低趋势,1、3 d时较高,7、14 d时极显著降至不足1 d的1%。盐度驯化组及对照组再生鳞片的MMP9 基因在21 d时表达水平均有少许回升。
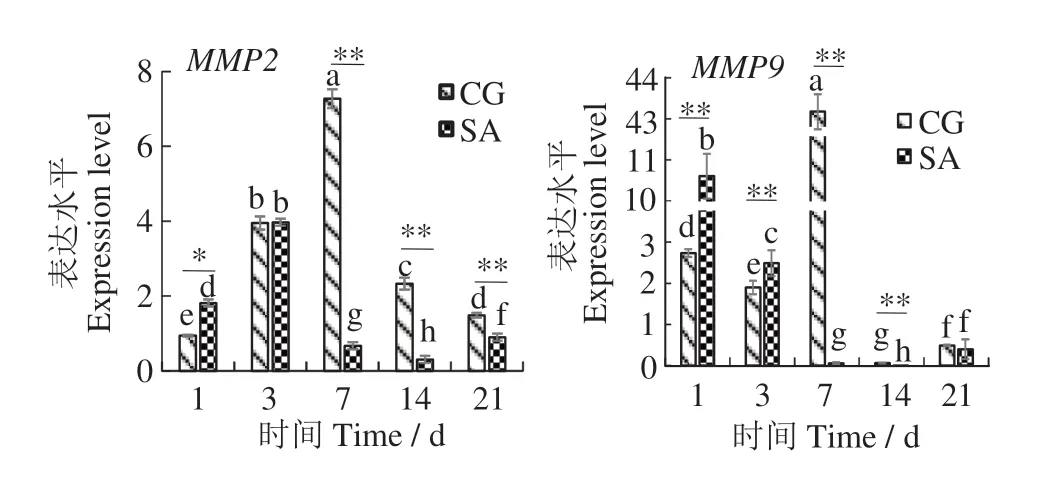
图3 虹鳟幼鱼鳞片再生过程中基因MMP2、MMP9的表达水平Fig.3 expression levels of MMP2 and MMP9 mRNA during scale regeneration in young Oncorhynchus mykiss
3 讨论
基于19 个脊椎动物MMP2 和MMP9 氨基酸序列构建的系统进化树显示,MMP2 和MMP9 的系统进化树结构较为相似;由于鱼类MMPs 与哺乳类、鸟类及两栖类的氨基酸同源性较低,导致进化树在结构上主要分为硬骨鱼类和高等脊椎动物两大分支;硬骨鱼类分支中,虹鳟MMP2 和MMP9 均首先与大西洋鲑聚成一支,与传统形态分类结果一致。
BMP4可诱导软骨细胞、成骨细胞的分化,在骨骼形成过程中有重要作用[17]。在鳜(Siniperca chuatsi)颌骨重塑初期,由间充质细胞分化的成骨细胞数量显著增加,后期骨化趋于完善时成骨细胞数量减少;在这一过程中BMP4 表达水平相应地呈现先升后降趋势[18]。由此可见,与成骨细胞分化、增殖等过程密切相关基因的表达水平可间接反映骨组织中成骨细胞的分化程度。本研究中,MMP2 和MMP9的表达水平在对照组虹鳟幼鱼鳞片再生过程中均呈先升后降趋势,表明两个基因在鳞片再生过程中可能有调节作用。
Filanti等[2]发现,MMP2是成骨细胞分泌的MMPs中数量最高的酶,MMP2 在大鼠(Rattus norvegicus)成熟成骨细胞中显著表达。MMP2在正常骨组织中表达量通常较低;但在骨修复早期阶段会高表达,而后随着骨修复完成表达量逐渐降低[19]。由此推测,MMP2 表达水平变化趋势可作为鳞片再生过程中成骨细胞分化、增殖的标志特征之一,反映鱼类骨骼再生的进程。MMP9 是破骨细胞分泌的主要蛋白之一,可能在激活破骨细胞从而启动骨吸收的过程中发挥作用[20]。在斑马鱼鳞片再生的早期阶段,破骨细胞与成骨细胞同时被活化,而在骨基质重塑后期二者细胞活性受到抑制[11];MMP9 表达水平变化可能与骨骼前体细胞的成熟和分化,以及成骨、破骨细胞活性等有关[21]。本研究中,MMP9在虹鳟幼鱼鳞片再生过程早期表达水平较高,验证了MMP9 对骨骼再生的调节作用,在鳞片再生过程中MMP9表达水平变化趋势可能与破骨细胞的分化增殖及细胞活性的发挥有关。
本研究表明,在盐度驯化初期(1~3 d),再生鳞MMP2 表达水平显著高于或接近于对照组,随着盐度驯化的进行,驯化组MMP2 基因表达水平极显著降低。此外,盐度驯化组MMP9 表达水平呈显著下降趋势,表明盐度驯化可能抑制了破骨细胞活性。已有研究表明,盐度驯化对欧洲舌齿鲈再生鳞中成骨细胞标志性酶——碱性磷酸酶(alkaline phosphatase,ALP)的活性具有抑制作用,由此推测高盐水体可能抑制成骨细胞分化,减缓骨矿化速度,从而抑制鳞片再生[12]。由此可见,盐度驯化对虹鳟幼鱼鳞片再生过程可能产生一定抑制作用。然而,盐度驯化组MMP2和MMP9基因的表达水平在21 d均显著回升至与对照组相近的水平,表明在盐度驯化后期鱼体已逐渐适应盐度变化,再生过程不再受到抑制。
4 结论
1)MMP2和MMP9的表达水平在对照组虹鳟幼鱼鳞片再生过程中均呈现先升高后降低的趋势,两个基因表达水平的变化可分别作为鳞片再生过程中成骨细胞与破骨细胞分化增殖的标志特征之一。
2)盐度驯化抑制了鳞片再生过程中MMP2 和MMP9 表达水平,鱼体骨代谢水平在盐度适应过程中会发生变化,但在后期MMPs 基因表达水平恢复至与对照组相近水平,表明本研究采用4/d 的盐度驯化模式较为合理,可为鲑鳟鱼类养殖生产实践提供重要参考。
