急性胰腺炎患者血浆内皮细胞微粒水平的改变及其形成机制
2022-09-19王迪迪刘秋圆王兵兵韦亚蓉刘晓昌
王迪迪, 刘秋圆, 胡 翠, 王兵兵, 韦亚蓉, 丁 浩, 刘晓昌, 梅 俏
安徽医科大学第一附属医院 消化内科, 合肥 230022
急性胰腺炎(acute pancreatitis,AP)是消化内科常见的急腹症,约20%的患者可发展为重症急性胰腺炎(severe acute pancreatitis,SAP),引起严重的全身炎症反应综合征,SAP病死率高达30%,但其发病机制尚未完全阐明[1-2]。大量研究将AP的发病机制归因于胰酶激活和胰腺自身消化,继发免疫介导损伤和胰腺微循环障碍[3]。研究[4]表明,血管内皮细胞功能损伤可能是AP微循环障碍的核心机制之一。近年来,高脂血症导致的AP发病率逐年增加,其中三酰甘油代谢产生的游离脂肪酸和乳糜微粒引起胰腺毛细血管阻塞并诱发胰腺微循环障碍,游离脂肪酸通过刺激炎症介质合成,抑制线粒体功能,损伤胰腺血管内皮细胞和腺泡细胞,导致胰腺炎的发生[5]。因此,内皮细胞功能改变在AP发病过程中具有重要作用。
内皮细胞微粒(endothelial microparticles,EMP)是内皮细胞受到各种刺激时释放直径为0.1~1 μm的微囊泡,内含大量mRNA、microRNA、脂质和蛋白质等,作为细胞间转移炎症信号物质的载体,是近年来内皮细胞功能研究的热点[6]。研究[7-10]表明系统性红斑狼疮、慢性肾脏病、急性冠状动脉综合征、糖尿病等患者中EMP水平均明显升高,同时EMP通过加重机体的血管内皮细胞损伤,促进组织炎症反应过程。但是在胰腺炎的发病过程中机体EMP的水平变化尚不清楚。因此,本研究通过检测不同严重程度AP患者血浆中EMP水平,以及通过体外实验观察AP患者血浆刺激EMP形成的初步机制,探讨EMP在AP患者发病机制中的可能作用。
1 资料与方法
1.1 研究对象 收集本院2020年8月—2021年6月60例AP住院患者的血液标本,分为轻症急性胰腺炎(mild acute pancreatitis,MAP)组(n=23)、中度重症急性胰腺炎(moderately severe acute pancreatitis,MSAP)组(n=23)和重症急性胰腺炎(SAP)组(n=14)。AP诊断标准参考2012亚特兰大分类新标准共识[11],并选取20例健康体检者作为对照组。
1.2 材料与仪器 人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVEC)购自美国ScienCell公司;BI血清购自以色列生物科技公司; PBS、RPMI-1640培养基购自美国 Hyclone公司; 青霉素-链霉素混合液、0.25% 胰蛋白酶购自北京索莱宝生物科技有限公司;LPS购自美国sigma公司(B5-L2880);内皮素(endothelin 1,ET-1)、血管性血友病因子(von willebrand factor,vWF)、一氧化氮(nitric oxide,NO)、血管内皮细胞黏附分子1(VCAM-1)ELISA 试剂盒均购自武汉新启迪生物科技有限公司;CCK-8试剂盒购自biosharp公司;RT-PCR 反转录试剂盒、荧光定量PCR试剂盒购自日本 Takara 公司;GAPDH引物、内皮型一氧化氮合酶(eNOS)、诱导型一氧化氮合酶(iNOS)、细胞间黏附分子-1(ICAM-1)、VCAM-1、NADPH氧化酶及P-选择素引物由上海生工生物工程股份有限公司设计与合成;ABI QuantStudio6 Flex qRT-PCR 仪(赛默飞世尔科技有限公司)。Transwell inserts(型号3413,美国康宁公司); CD31 APC、CD41PE(美国eBioscience 公司);Flow-Count Fluorspheres(美国Beckman公司);CytoFLEX 分析流式细胞仪(美国Beckman Coulter公司);多功能酶标仪(美国PE公司)。
1.3 研究方法
1.3.1 EMP分离 收集患者入院后(24 h内)次日晨血5 mL于柠檬酸钠抗凝管中,采用差速离心法,以1500 r/min离心10 min获取富血小板血浆,再以4000 r/min离心30 min,获取贫血小板血浆(PPP),于-80 ℃保存[6]。
1.3.2 EMP检测 将PPP解冻,取50 μL PPP,加入5 μL CD31-APC、5 μL CD41-PE充分混合,室温下避光孵育30 min,再加入400 μL Bindbuffer、40 μL Flow-CountTM荧光计数微球充分混合,采用流式细胞仪检测 EMP,使用5 μL兔抗人PE-IgG1及5 μL PE-IgG1作为对照。CD31-APC阳性及CD41-PE阴性为 EMP,根据荧光计数微球计算 EMP 水平。
1.3.3 内皮细胞功能相关因子检测 AP患者血浆中ET-1、vWF、NO、VCAM-1水平,按照ELISA试剂盒说明书进行检测。
1.3.4 HUVEC细胞培养和实验分组 HUVEC细胞复苏,培养于37 ℃、5% CO2的细胞培养箱中,使用 10% BI血清、1% 青霉素-链霉素溶液进行培养,根据细胞生长状况2~3 d更换1次培养基,显微镜下观察细胞汇合程度达到 80% 时,用0.25% 的胰蛋白酶消化细胞,重悬细胞并计数,以5×104个/孔的密度接种于24孔(0.4 μm)的 Transwell inserts中。将接种于Transwell inserts中的HUVEC细胞,培养24 h,饥饿处理12 h后,另各取MAP、MSAP、SAP患者的PPP,采用超速离心法(100 000×g)4 ℃离心2 h以去除AP患者血浆中的EMP[12],取上清,分别加入到Transwell的下室,与上室的HUVEC共培养6 h,10 μg/mL的LPS作为阳性对照组,CCK-8法检测HUVEC细胞活力。
1.3.5 HUVEC上清液中EMP检测 收集Transwell inserts中上室的细胞培养液,再以4000 r/min离心30 min,流式细胞仪检测方法同AP患者血浆中EMP的检测。
1.3.6 HUVEC中eNOS、iNOS、ICAM-1、VCAM-1、NADPH氧化酶及P-选择素的mRNA表达水平 用Trizol提取Transwell inserts中HUVEC细胞的总RNA,用Takara公司的逆转录试剂盒将RNA逆转录为 cDNA,采用 QuantiNova SYBR Green PCR 试剂盒进行定量 PCR 反应,反应条件为 95 ℃、2 min 1个循环; 95 ℃、5 s,60 ℃、15 s,72 ℃、20 s 共 40 个循环。所用qRT-PCR引物序列见表1。用 2-ΔΔCt方法计算eNOS、iNOS、ICAM-1、VCAM -1、NADPH氧化酶及P-选择素的mRNA的相对表达量。
1.3.7 DCFH-DA法检测HUVEC中的细胞活性氧(ROS)含量 收集Transwell inserts中HUVEC,500×g离心5 min,加入1 mL无血清培养液稀释的终浓度为10 μmol/L的DCFH-DA,37 ℃孵育20 min;用无血清培养液洗涤细胞3次,500×g离心5 min,重悬于400 μL无血清培养液,立即采用流式细胞仪检测。
1.3.8 JC-1染色法检测HUVEC的线粒体膜电位 收集Transwell inserts中HUVEC,PBS洗涤细胞,500×g离心5 min,分别加入1 mL 细胞培养液和1 mL JC-1染色工作液,混匀,37 ℃孵育20 min;用JC-1染色缓冲液(1×)洗涤2次,500×g离心5 min,重悬于400 μL细胞培养液,立即采用流式细胞仪检测。

表1 qRT-PCR引物序列Table 1 Primers of qRT-PCR

2 结果
2.1 一般资料 60例AP患者中胆源性28例,高脂血症型20例,混合型3例,酒精性1例,其他8例。各组WBC、中性粒细胞、CRP、Alb、ALT、AST、ALP、LDH、BUN、CRE、钾、钠、钙、血糖水平比较差异均有统计学意义(P值均<0.05);与MAP组比较,MSAP和SAP组的APACHEⅡ评分、BISAP评分、Ranson评分、CT评分均有统计学差异(P值均<0.05)(表2)。
2.2 AP患者血浆中EMP水平的检测 与对照组相比[(188.09±17.20)个/μL],MAP组[(369.41±156.78)个/μL]、MSAP组[(997.29±186.24) 个/μL]、SAP组[(1 769.00±274.62)个/μL]EMP水平明显升高(P值均<0.05)。与MAP组、MSAP组比较,SAP组EMP水平明显升高(P值均<0.05)(图1)。
2.3 不同严重程度的AP患者血浆中EMP水平与临床特征的关联分析 AP患者EMP水平与APACHEⅡ、BISAP评分、Ranson评分、CT评分、CRP均呈正相关(r值分别为0.686 2、0.777 3、0.713 8、0.771 8、0.473 9,P值均<0.01)。
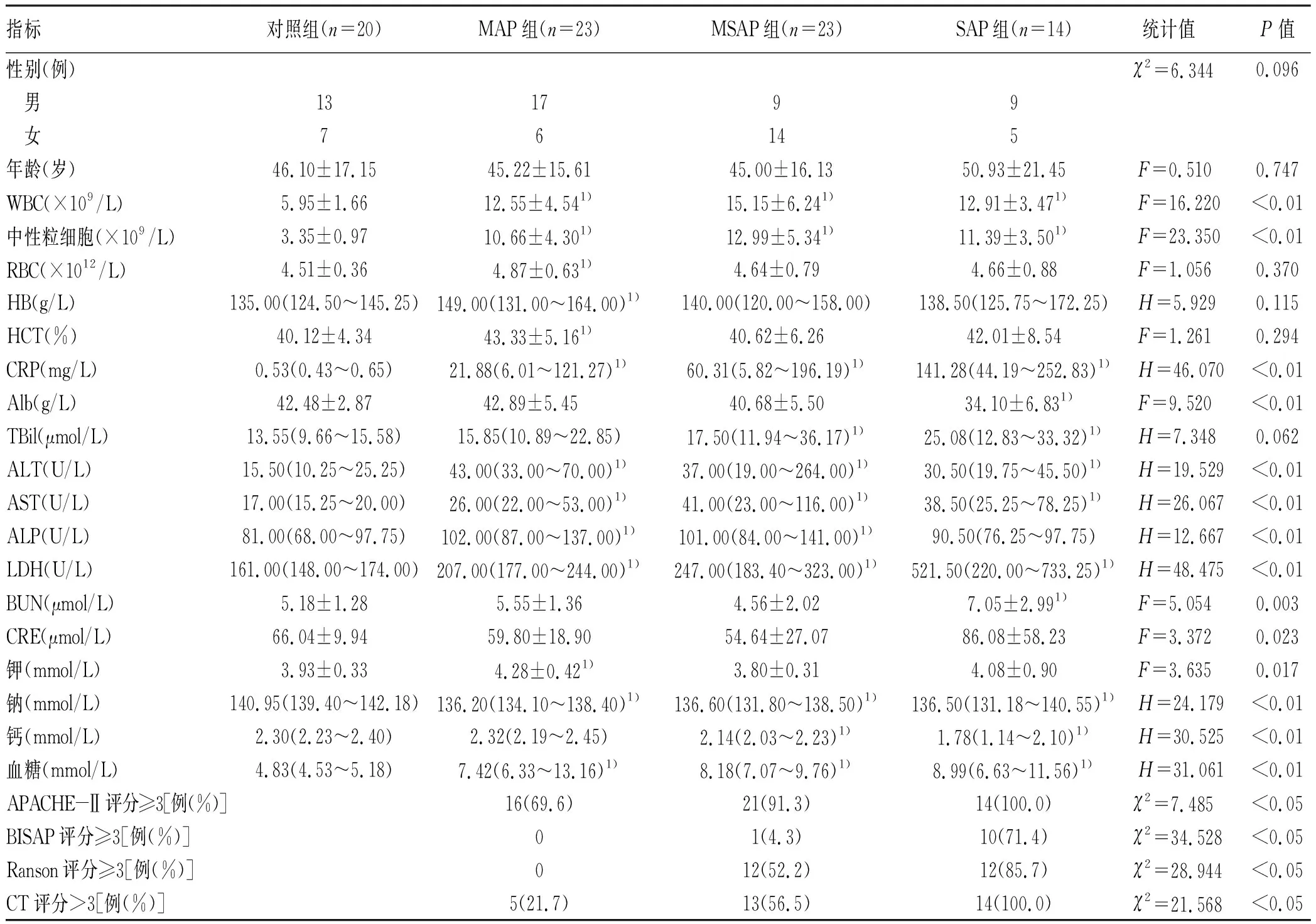
表2 AP患者临床资料Table 2 Clinical data of acute pancreatitis patients
2.4 AP患者血浆中ET-1、vWF、NO、VCAM-1水平的检测 与对照组相比,MAP组、MSAP组、SAP组的ET-1、vWF、VCAM-1水平明显升高,NO水平明显降低(P值均<0.05)(图2)。
2.5 AP患者血浆对HUVEC中EMP合成水平的影响 与对照组相比,MAP组患者血浆对HUVEC中EMP水平影响不大(P>0.05),MSAP和SAP组血浆可促进HUVEC中EMP大量释放(P值均<0.05),提示AP患者血浆中含有致内皮细胞损伤炎性介质,加重HUVEC损伤和EMP生成(图3)。
2.6 AP患者血浆对HUVEC中eNOS、iNOS、ICAM-1、P-选择素、VCAM -1、NADPH氧化酶的mRNA表达水平的影响 用10 μg/mL的LPS作阳性对照,分别用正常人的血浆和不同严重程度AP患者的血浆刺激HUVEC 6 h,CCK-8检测提示HUVEC活力为76.90%。eNOS、iNOS、ICAM-1、VCAM -1、NADPH氧化酶及P-选择素的mRNA表达水平均增加,与对照组比较,除MAP组的VCAM-1和eNOS外,其余各组的eNOS、iNOS、ICAM-1、P-选择素、VCAM -1、NADPH氧化酶的mRNA表达水平均显著升高(P值均<0.05)(图4)。

注:P1,EMP所在区域;P2,藻红蛋白(PE)和别藻蓝蛋白(APC)双阳性区域;P3,阴性颗粒所在区域;P4,藻红蛋白(PE)阳性区域。图1 不同严重程度AP患者的EMP水平检测Figure 1 EMP level of AP patients with different severity
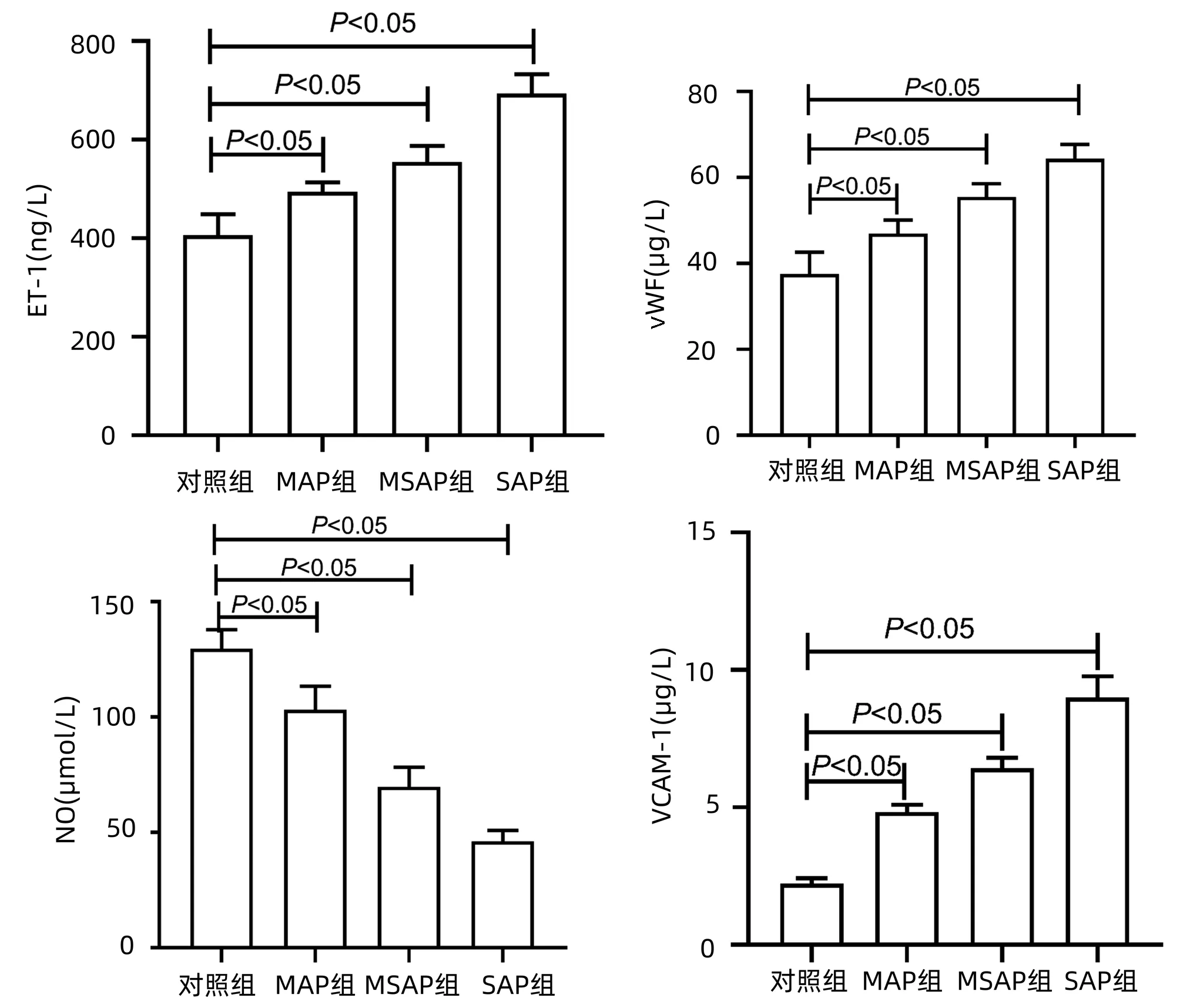
图2 AP患者血浆中ET-1、vWF、NO、VCAM-1水平改变
2.7 AP患者血浆对HUVEC中ROS水平的影响 与对照组ROS水平(4.57%±0.19%)相比,MAP组(5.70%±0.38%)、MSAP组(7.40%±0.10%)、SAP组(12.95%±0.26%)、LPS组(63.00%±0.55%)患者HUVEC中的ROS水平均升高明显(P值均<0.05)。
2.8 AP患者血浆对HUVEC中线粒体膜电位的影响 与对照组线粒体膜电位下降率(0.54%±0.39%)相比,MAP组(2.24%±0.30%)、MSAP组(7.48%±2.49%)、SAP组(12.90%±1.61%)、LPS组(63.17%±1.65%)HUVEC中的线粒体膜电位下降更明显(P值均<0.05)。
3 讨论
AP发生过程中,胰腺微血管在组胺、白三烯、缓激肽等炎症介质的作用下促进血管内皮细胞收缩,同时IL-1β、IL-6、IL-18、TNFα等细胞因子通过内皮细胞骨架的重构,导致血管内皮通透性增加,胰腺微循环血管屏障受到破坏[13]。另一方面血管内皮细胞活化或受到刺激时EMP释放增加。EMP是一种内皮功能障碍的血浆标志物,由内皮细胞在激活、损伤或凋亡时释放,可将大量的生物活性分子,如生长因子、蛋白酶、黏附分子、DNA和microRNA转移到受体细胞,加重炎症损伤[14]。因此胰腺微血管内皮细胞结构及功能受损是AP过程中的重要发病机制。
EMP水平升高是炎症性疾病的临床特征,Parker等[7]研究表明系统性红斑狼疮(SLE)与内皮细胞损伤和功能障碍有关,活动性SLE患者EMP水平明显升高,降低EMP水平有助于改善SLE患者的心血管风险,改善炎症疾病活动度同时可改善EMP水平,表明抑制炎症是影响EMP变化的关键因素。Pernomian等[15]研究表明糖尿病患者高血糖通过氧化应激反应,促使EMP释放增加,诱导促炎途径并发心血管功能障碍,导致心血管事件的发生,表明EMP在糖尿病疾病发展过程中起到关键作用。本研究采用CD31、CD41检测EMP[定义CD31(+)CD41(-)为EMP],结果发现,AP患者EMP水平升高,且SAP组患者的EMP水平明显高于MAP组和MSAP组,EMP水平与疾病的严重程度呈正相关,表明EMP可作为评估AP炎症程度的生物学指标。

注:Q2-UL,EMP所在区域;Q2-UR,藻红蛋白(PE)和别藻蓝蛋白(APC)双阳性区域; Q2-LL,阴性颗粒所在区域; Q2-LR,藻红蛋白(PE)阳性区域。

图4 AP患者血浆对HUVEC中eNOS、iNOS、ICAM-1、VCAM -1、NADPH氧化酶及P-选择素 mRNA表达的影响
内皮细胞损伤和功能障碍在炎症反应中的作用逐渐被认识,是近年来内皮细胞功能研究的热点[14]。TNFα作为炎症反应过程中最早出现的炎症因子,可激活中性粒细胞释放弹性蛋白酶,增加血管内皮细胞的通透性[16]。内皮细胞以TLR4依赖的方式响应LPS,导致随后促炎细胞因子的释放和黏附分子的表达增强,进一步刺激炎症级联反应[17]。因此,在AP的病理生理过程中,以TNFα为主要代表的炎症细胞因子和LPS等均具有损伤血管内皮细胞的作用。在AP的发病过程中,研究表明炎症反应与内皮损伤之间存在一定的相互作用关系,且同时伴随着EMP水平的改变。本研究发现与健康对照组相比,MAP组、MSAP组、SAP组的内皮细胞功能标志物ET-1、vWF、VCAM-1水平明显升高,表明AP中存在内皮细胞损伤及功能障碍,同时与EMP水平改变呈现同步趋势。
氧化损伤机制在EMP的形成中具有重要作用。线粒体功能障碍在诱导ROS合成和内皮功能障碍等方面起促进作用。研究[18]表明,高葡萄糖刺激可以增加EMP的形成,ROS水平增加,促氧化活性提高,EMP形成又可导致糖尿病患者更严重的血管功能障碍。有研究[3,19]表明在L-精氨酸诱导的SAP实验模型中血管内皮细胞受损,细胞内储存的Ca2+瞬间释放,Ca2+与钙调蛋白结合激活一氧化氮合酶,一氧化氮合酶和NADPH氧化酶是细胞内产生ROS的主要来源,引起氧化应激,降低线粒体膜电位,引起内皮细胞氧化损伤和促进内皮功能障碍。铁超载可引起内皮细胞ROS和Ca2+内流增加,线粒体功能损伤,膜电位丧失,导致EMP水平显著增加[20]。糖尿病患者通过增强肾素-血管紧张素系统,引起血管氧化应激和NADPH氧化酶活性,产生的ROS激活EMP生成[15]。Chen等[21]研究表明糖尿病患者晚期糖基化终末产物(AGE)加速形成,AGE通过NADPH氧化酶激活ROS途径释放EMP。上述研究表明,ROS增加和线粒体功能障碍是EMP形成的重要机制之一。因此,在体外实验中,使用含有炎症介质的AP患者的血浆刺激HUVEC,结果发现EMP水平明显升高,eNOS、iNOS、ICAM-1、VCAM -1、NADPH氧化酶及P-选择素的mRNA表达增加,细胞中ROS的水平升高,线粒体膜电位下降明显,从细胞水平证明AP患者血浆中含有致内皮损伤炎性介质,通过ROS增加和线粒体功能障碍,加重内皮细胞损伤和EMP形成,是AP发病机制的重要环节。
综上所述,AP发病过程中炎症介质通过氧化机制和线粒体功能障碍损伤血管内皮细胞,形成大量 EMP并与AP严重程度相关,表明 EMP可作为 AP 疾病严重程度评估的指标。但EMP在AP发病过程中的具体作用机制和EMP形成的精确机制尚不明确,均需要进一步的临床和基础研究加以探讨。
伦理学声明:本研究于2019年10月15日经安徽医科大学第一附属医院伦理委员会批准,批号:PJ2018-12-17,所有研究对象均签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:王迪迪、刘秋圆负责课题设计,资料分析,撰写论文;胡翠、王兵兵、韦亚蓉、丁浩参与收集数据,修改论文;刘晓昌、梅俏负责拟定写作思路,指导撰写文章并最后定稿。
