自噬相关基因与膀胱癌预后生存分析
2022-09-16韩文凯许晓燕李丹霞车铠焦伟牛海涛
韩文凯,许晓燕,李丹霞,车铠,焦伟,牛海涛
(1 青岛大学医学部,山东 青岛 266071; 2 青岛大学附属医院泌尿外科)
膀胱癌是泌尿系统中最常见的肿瘤之一,也是我国老年人群中高致死率的癌症[1-2]。膀胱癌最常见的病理类型是尿路上皮癌,其具有耐药性强、转移率高、复发率高、预后差等特点[3-4]。虽然手术、放疗和辅助化疗的应用大大改善了膀胱癌病人的预后,但膀胱癌致死率仍居高不下[5]。因此,需要寻找新的方法来提高膀胱癌病人的诊断和预后。近年来,分子标志物已经被证实有助于膀胱癌的诊断和治疗[6]。已有研究表明,膀胱癌病人的晚期无进展生存与某些分子标志物高表达相关[7-8]。然而,由于研究缺乏更大的临床研究队列,这些潜在生物标志物的功能以及临床意义无法得到充分验证。自噬在细胞的代谢过程中具有平衡作用,正常情况下自噬可以清除功能受损的细胞器以及表达错误的蛋白质[9]。人类发展过程中的多种疾病与自噬相关,并且自噬与肿瘤的发生也存在密切关系[10]。自噬对于肿瘤是一把双刃剑,早期可以抑制肿瘤的形成,晚期可以促进肿瘤的生长和转移[11]。近年来有研究表明,自噬基因可以通过信号通路诱导膀胱癌浸润和转移[12-13]。因此,自噬基因可能作为膀胱癌诊断以及预后的分子标志物。本研究从肿瘤基因组图谱(TCGA)数据库中获取膀胱癌转录组数据进行分析,并且构建自噬相关基因(DEARGs)的预后模型,评估该模型的预后预测能力。
1 资料与方法
1.1 数据来源
从TCGA数据库中获取了430例样本的转录组数据(HTSeq-FPKM),其中癌旁组织19例,膀胱癌组织411例。GSE31684数据集从基因表达综合数据库(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE31684)中下载获得[14-15]。DEARGs来源于人类自噬数据库(HADb,http://www.autophagy.lu/),从该数据库中获得了232个自噬基因,其中194个基因在TCGA数据库中表达。
1.2 DEARGs差异表达分析
对瘤旁组织和膀胱癌组织的转录组数据进行分析,筛选差异表达的DEARGs。在R语言(版本3.6.2)环境下进行操作,首先使用“limma”包对数据进行校正归一化处理,筛选标准为|logFC|>1(实验组/对照组>2),错误发现率(FDR)<0.05。采用Wilcoxon检验进行差异分析,最后使用“pheatmap”和“ggpubr”包对DEARGs进行可视化处理。
1.3 DEARGs在膀胱癌中的生物学功能分析
对DEARGs进行基因本体(GO)及京都基因与基因组百科全书(KEGG)信号通路富集分析。在R语言环境下,使用“colorspace”“stringi”“ggplot2”“DOSE”“clusterProfiler”和“enrichplot”等软件包对数据进行可视化处理(P<0.05,Q<0.05,Q值为校正后的P值)。
1.4 DEARGs预后风险模型的构建
首先,在R语言环境下使用“survival”软件包对DEARGs进行单因素Cox回归分析,筛选与预后生存相关的自噬基因,以P<0.05为差异有显著意义。随后,将以上筛选到的与生存相关的自噬基因进行多因素Cox回归分析。最后,构建自噬基因的风险预测模型,根据风险模型计算每一样本的风险评分,以风险评分中位值为界将样本分为高风险组和低风险组,观察两组病人生存状态。风险评分=expRNA1×βRNA1+expRNA2×βRNA2+…+expRNAn×βRNAn,其中exp是差异表达基因的表达量,RNA1~RNAn代表每一基因的名称,β是Cox回归模型的多元回归系数。
1.5 预后风险模型的评估
在R语言环境下使用“survival”包对高低风险组的病人进行预后分析,利用Kaplan-Meier(K-M)检验方法和log-rank检验评估高低风险组病人的生存预后。使用“survival ROC”包绘制受试者工作特征(ROC)曲线评估该模型的准确性。
1.6 外部数据集对于模型的验证
使用GSE31684数据集验证风险模型的预测性能,根据模型风险评分的中位值将样本分为高风险组和低风险组,观察两组病人总体生存状态,绘制ROC曲线评估结果准确性。
1.7 独立预后分析
将样本的风险评分和临床指标进行单因素和多因素Cox回归分析,综合评估风险评分与膀胱癌病人预后的关系。以P<0.05为差异有统计学意义。
2 结 果
2.1 DEARGs的筛选
根据筛选标准(|logFC|>1、FDR<0.05)获得DEARGs 37个,其中19个基因表达下调,18个基因表达上调(图1A)。依据|logFC|排序,表达上调的前10个基因为:CDKN2A、SERPINA1、BIRC5、TP73、ATG9B、EIF4EBP1、SPHK1、ERBB2、BID和ITGA3;表达下调的前10个基因为:FOS、CCL2、HSPB8、PRKN、ITPR1、TP53INP2、NRG2、MYC、DLC1和BCL2。
2.2 DEARGs的生物学功能分析
GO富集分析的结果显示,生物过程(BP)主要包含内在凋亡信号通路、神经元死亡、内质网应激反应、自噬和自噬信号通路等,细胞组成(CC)主要包含自噬体、内质网腔体、外膜、线粒体外膜和细胞器外膜等,分子功能(MF)主要涉及泛素蛋白连接酶的结合、磷酸酶结合、死亡结构域结合、BH结构域结合及蛋白酶结合等。见图1B。KEGG分析的结果则显示,DEARGs主要与肌萎缩性侧索硬化症(ALS)、细胞凋亡、凋亡-多物种、膀胱癌、慢性骨髓性白血病、EGFR酪氨酸激酶抑制剂抗性、内分泌的阻力、ErbB信号通路、p53信号通路、PI3K-Akt信号通路和铂耐药等通路相关(图1C)。

A为DEARGs火山图:图中每一点代表一个自噬基因,其中黑色点代表无差异表达基因,红色点代表表达上调基因,绿色点则代表表达下调基因。B为GO富集分析:图中形状的大小代表富集基因的数量,形状越大代表富集的基因越多;颜色代表P值的大小,P值越小颜色越红,反之越蓝(P<0.05)。C为KEGG通路富集分析:图中每行代表一个生物功能通路,其中方格代表富集于该通路的基因,颜色则代表基因表达差异的倍数,颜色越红代表表达差异倍数越大。
2.3 自噬风险模型的构建与评估
对37个DEARGs进行单因素Cox回归分析,结果发现共有7个基因(SPNS1、APOL1、P4HB、DIRAS3、ITGA3、MYC、SPHK1)与膀胱癌病人的预后显著相关(P<0.05)。将其纳入多因素Cox回归分析,最终得到了包含6个自噬基因(SPNS1、APOL1、P4HB、DIRAS3、ITGA3、MYC)的风险模型。热图分析结果显示,与低风险组比较,高风险组DIRAS3、MYC、P4HB基因表达上调,APOL1、ITGA3则表达下调,而SPNS1的表达在两组中并无明显差异(图2A)。低风险组的总体生存优于高风险组(图2B、C)。根据风险模型计算了每例膀胱癌病人的风险评分,高风险组201例,低风险组202例。K-M分析结果显示,高风险组3年生存率为41.4%(95%CI=0.334~0.513),低风险组为57.7%(95%CI=0.490~0.679),高风险组的预后生存率低于低风险组(图3A)。ROC曲线分析结果显示,膀胱癌病人3年生存期的AUC为0.789(图3B)。
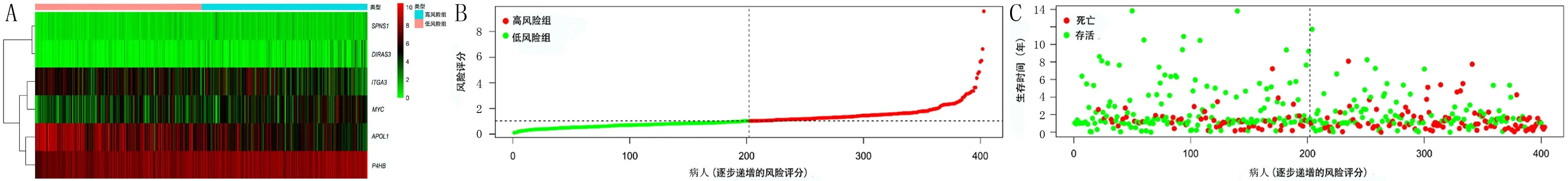
A:模型中6个风险基因的差异表达图;B:样本中风险模型评分分布图;C:风险模型评分与膀胱癌病人生存状态分布图。
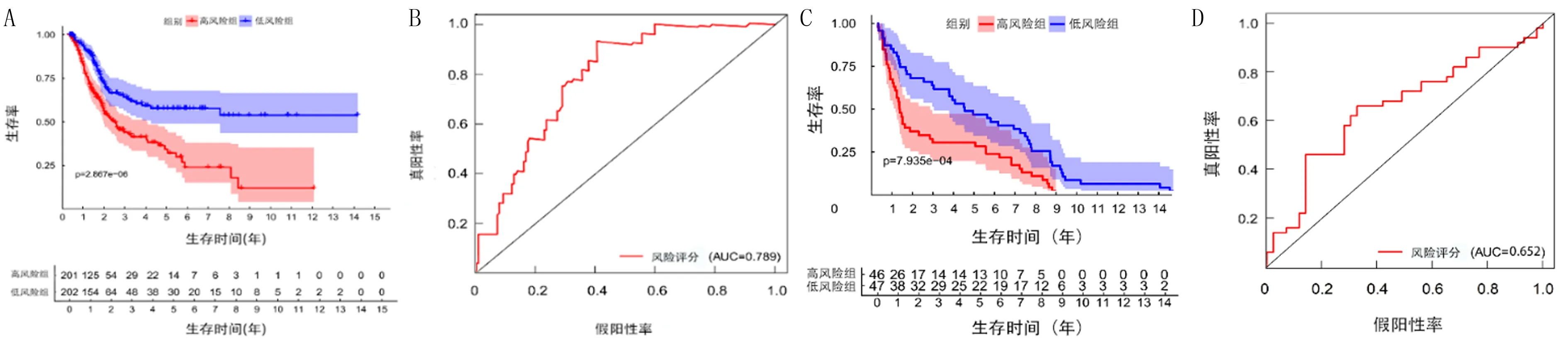
A:风险模型对于高风险组和低风险组的生存预后分析;B:ROC曲线对风险模型预测准确性的分析结果;C:风险模型对于GEO数据集中高低风险组的生存预后分析;D:风险模型对于GEO数据集分析结果准确性分析。
2.4 外部数据集对于模型的验证
使用GEO数据集中的GSE31684数据集对模型的预测能力进行验证,根据风险模型的风险评分,将病人分为高风险组(46例)、低风险组(47例)。K-M生存分析结果显示,高风险组的预后差于低风险组,高风险组的3年生存率为31.6%(95%CI=0.3167~0.499),低风险组3年生存率为64.6%(95%CI=0.436~0.665)。ROC曲线分析结果显示,膀胱癌病人3年生存期的AUC为0.652(图3C、D)。
2.5 独立预后验证
单因素Cox回归分析结果显示,病人肿瘤分期(HR=1.763,95%CI=1.236~2.515,P<0.01)、肿瘤浸润深度(HR=1.695,95%CI=1.152~2.495,P<0.01)、淋巴结转移(HR=1.531,95%CI=1.165~2.013,P<0.01)和模型风险评分(HR=1.828,95%CI=1.438~2.324,P<0.001)与膀胱癌病人预后相关。多因素Cox回归分析结果显示,风险评分(HR=1.933,95%CI=1.457~2.563,P<0.001)可以作为膀胱癌病人预后的独立影响因素。见图4。
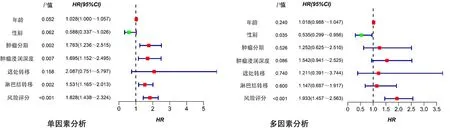
图4 Cox回归分析评估风险模型评分及临床特征对于膀胱癌病人的预后价值
3 讨 论
一般情况下,体内的自噬水平一直处于相对平衡的生理状态,自噬在肿瘤的发生、形成和转移的过程中具有重要作用[16]。在肿瘤形成的初期,自噬可以抑制肿瘤的形成。但是在肿瘤形成后,自噬则会促进肿瘤生长和侵袭,此时的自噬就会成为肿瘤的促进因素[17]。目前,对膀胱癌自噬研究比较局限、单一。本文研究筛选膀胱癌癌旁组织和膀胱癌组织中DEARGs,并探讨其生物学功能。GO富集分析结果显示,DEARGs主要与BP(主要包含内在凋亡信号通路、神经元死亡、内质网应激反应、自噬和自噬信号通路)、CC(主要包含自噬体、内质网腔体、外膜、线粒体外膜和细胞器外膜)和MF(主要涉及泛素蛋白连接酶的结合、磷酸酶结合、死亡结构域结合、BH结构域结合及蛋白酶结合)相关;KEGG分析结果显示,DEARGs主要与ALS、细胞凋亡、凋亡-多物种、膀胱癌、慢性骨髓性白血病、EGFR酪氨酸激酶抑制剂抗性、内分泌的阻力、ErbB信号通路、P53信号通路、PI3K-Akt信号通路和铂耐药等通路相关,这说明膀胱癌DEARGs与癌症相关通路及肿瘤耐药相关。目前研究认为,PI3K-Akt信号通路和铂耐药通路相关,RrbB2可以诱导血管生长并促进膀胱癌的转移[18];在膀胱癌中,3-BrPA可以通过抑制P53通路从而有效抑制膀胱癌的发生和转移[19];PI3K-Akt信号通路可以调节上皮间质化和侵袭,在浸润性膀胱癌中已发现了类似的FGFR3突变[20];DEARGs还与铂类药物耐药相关,有些膀胱癌病人应用此类药物治疗效果不佳,可能与膀胱癌的耐药机制相关[7]。其机制是否与DEARGs相关,有待进一步研究。
本文研究构建了含有6个自噬基因(SPNS1、APOL1、P4HB、DIRAS3、ITGA3、MYC)的风险模型,其中DIRAS3和ITGA3可以作为膀胱癌预后的生物标志物[7-8],MYC可以通过各种机制促进膀胱癌的转移和浸润[21]。关于SPNS1、APOL1和P4HB基因在膀胱癌中的作用尚不明确,需进一步的研究和探索。但已有研究显示,SPNS1与P53信号通路相关[22]。APOL1可以作为胰腺癌的肿瘤标志物[23]。在肾透明细胞癌中P4HB可以作为预后不良的肿瘤标志物[24]。本研究建立的模型可以有效划分高、低风险的病人,预测结果也准确有效,并且该结果在外部数据集中也得到了验证。该模型的风险评分也可作为预测膀胱癌病人预后的独立因素。因此,本文构建的自噬基因相关模型可以筛查高风险的膀胱癌病人,提前干预、治疗从而改善病人的预后。
综上所述,本文筛选并构建了含有以下6个基因SPNS1、APOL1、P4HB、DIRAS3、ITGA3和MYC的风险模型,该模型可以很好地筛选高风险的膀胱癌病人,其风险评分还可以作为预测膀胱癌病人预后的一个独立因素。本研究结果为后期膀胱癌的早期诊断及前期干预治疗,改善病人预后提供了可靠的理论基础依据。
