右美托咪定减轻妊娠合并脓毒症大鼠炎症反应的作用及对TLR-3/sFlt-1的调控机制探讨*
2022-09-13金华峰曾维福江丽赵燕峰李志强
金华峰 曾维福 江丽 赵燕峰 李志强
脓毒症是由细菌等病原微生物感染引起的全身炎症反应综合征,病情凶险,病死率高[1],多发生于严重烧伤、创伤、外科手术等严重疾病后[2]。妊娠合并脓毒症是产科最严重也是导致孕产妇死亡的主要病症。据估计,全球因脓毒症死亡的孕产妇占孕产妇总死亡数的11%[3]。该病由多种因素导致,失控的炎症反应是病情进展的关键[4]。目前临床妊娠合并脓毒症患者的治疗方案主要是早期抗菌抗感染药物的应用、液体治疗及后期重要器官的保护,对于脓毒症发展中期机体炎症反应失控、免疫功能低下,目前还缺乏系统有效的治疗手段[5]。右美托咪定(Dexmedetomidine,Dex)是一种具有高选择性的肾上腺素能α2受体激动剂,具有抗炎、镇静、稳定血流动力学的功效[6]。研究表明,Dex 能通过调控Toll 样受体素4(Toll-like receptor 4,TLR-4)的表达抑制炎症反应,起到保护心肌组织、减轻肺泡内水肿及减少炎性细胞浸润的作用[7]。Toll 样受体素3(Toll-like receptor 3,TLR-3)激活后会增强与炎症强度呈正相关的可溶性血管内皮生长因子受体-1(soluble fms-like tyrosine kinase 1,sFlt-1)的表达并可调控炎症反应[8]。有研究发现,内源性大麻素通过与G 蛋白耦联的大麻素受体结合并发挥抗炎作用,而肾上腺素能α2受体也是G 蛋白耦联受体,且内源性大麻素的抗炎机制与TLR-3 的抗炎机制类似[9],因此推测Dex 通过结合G 蛋白耦联α2肾上腺素受体,促进TLR-3 与配体结合产生抗炎因子。本研究通过构建妊娠合并脓毒症大鼠模型,利用体外实验探究Dex 调控TLR-3/sFlt-1 信号通路对妊娠合并脓毒症大鼠心肺组织损伤和炎症反应的作用及机制,为深入研究Dex 对器官损伤和炎症反应的作用及其机制奠定基础。现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 80 只2~3 月龄无特定病原体(specific pathogen free,SPF)清洁级Sprague-Dawley(SD)孕鼠,体重(212.00±33.27)g[购于南昌大学实验动物科学部,许可证号:SCXK(赣)2019-0001]。
1.1.2 药物与试剂 Dex 和聚肌胞苷酸(polycytidylinic acid,Poly I︰C)(均购自江苏恒瑞医药股份有限公司);脂多糖(lipopolysaccharide,LPS)(购自上海吉至生化科技有限公司);苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(购自上海沪震实业有限公司);脱氧核糖核酸(deoxyribonucleic acid,DNA)断裂的原位末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒(购自上海弗元生物科技有限公司);C 反应蛋白(C reaction protein,CRP)、白细胞介素-6(interleukin-6,IL-6)和白细胞介素-10(interleukin-10,IL-10)化学发光免疫定量试剂盒(均购自美国GENMED SCIENTIFICS INC公司);兔抗鼠TLR-3、sFlt-1、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)单克隆抗体(均购自美国Santa 公司);羊抗兔TLR-3、sFlt-1、TNF-α 多克隆抗体(均购自美国Santa 公司);化学发光试剂(efficient chemiluminescence,ECL,购自美国Thermo Fisher 公司)。
1.1.3 实验仪器 CryoCube F440 型超低温冰箱(购自德国Eppendorf 公司);ICW190 型CO2恒温培养箱(购自德国IRM Tek 公司);BC-11H 型超净工作台(购自韩国Lab Companion 公司);H2050R 型高速冷冻离心机(购自湖南湘仪实验室仪器开发有限公司);IX51-A21PH 型光学显微镜(购自日本Olympus 公司);Revolve FL 型荧光显微镜(购自美国ECHO 公司);MSMINIONE 型电泳仪(购自英国Cleaver 公司);Azure c600 型凝胶成像系统(购自美国Azure Biosystems 公司)。
1.2 方法
1.2.1 构建SD 大鼠妊娠合并脓毒症模型并分组
1.2.1.1 SD 大鼠妊娠合并脓毒症模型构建 取70 只SD 孕鼠作为建模组,另取10 只SD 孕鼠作为对照组。建模组将尾部远端硬毛除去,固定好大鼠并选择合适的静脉,用75%酒精棉球擦拭使血管充盈,使用1 mL 注射器沿静脉血管进针,回抽针栓有回血说明进针成功,按5 mg/kg 缓慢注入浓度为0.1%LPS,注射完毕后用棉签局部按压止血,完成SD 孕鼠脓毒症模型得构建。建模24 h 后大鼠出现呼吸急促、反应迟钝、抱团取暖、尿液浑浊等状态,表示建模成功[10]。
1.2.1.2 实验分组 将妊娠合并脓毒症模型构建成功的大鼠随机分为模型组、Dex 低、中、高剂量组和Poly I︰C 低、中、高剂量组。其中Dex 低、中、高剂量组分别按5、10、20 μg/kg 注射Dex;Poly I︰C低、中、高剂量组分别按2.5、5、10 μg/kg 注射Poly I︰C,给药体积按1 mL/kg,对照组和模型组均按1 mL/kg 行静脉注射生理盐水。
1.2.1.3 材料采集 给药后12 h,分别将各组大鼠断颈处死,沿胸骨正中线剪开并取出心脏和右侧肺组织,保存于-80 ℃超低温冰箱备用。
1.2.2 各组孕鼠的心肌、肺组织形态学观察 取各组大鼠的心肌组织和肺组织固定于4%多聚甲醛24 h,常规行石蜡包埋、病理学切片(5 μm),依照HE 染色试剂盒的操作步骤进行染色。在倒置光学显微镜下观察各组大鼠心肌组织和肺组织的形态学变化。
1.2.3 TUNEL 法检测孕鼠心肌细胞和肺组织细胞凋亡率 将大鼠心肌组织和肺组织切片后分别用二甲苯和梯度乙醇各清洗1 次,滴加20 μg/mL 不含脱氧核糖核酸酶的蛋白酶K,于37 ℃条件下孵育20 min 后PBS 冲洗3 次将蛋白酶K 冲洗干净,加入50 μL TUNEL 检测液于标本上,在37 ℃条件下避光孵育60 min,PBS 冲洗3 次,二甲苯中浸泡5 min 使标本透明,用中性树胶封片,于光学显微镜下观察,细胞核可见棕黄色颗粒为阳性细胞。凋亡率=阳性细胞数/总细胞数×100%。
1.2.4 化学发光免疫法检测心肌、肺组织CRP、IL-6 和IL-10 的含量 采用双抗体夹心化学发光免疫法测定各组心肌、肺组织CRP、IL-6 和IL-10 含量。操作步骤均严格按照化学发光免疫定量试剂盒产品说明书进行:将各组大鼠心肌组织和肺组织分别制成组织匀浆,保存于-80 ℃超低温冰箱。分别取50 μL 大鼠心肌组织和肺组织组织匀浆和50 μL 碱性磷酸酶标记的单克隆抗体加入发光板,37 ℃条件下孵育60 min。洗液清洗5 遍后将洗液全部吸出,加入100 μL 化学发光底物液,37 ℃避光温育10 min,生成发光信号,测定其发光强度。
1.2.5 蛋白质免疫印迹法(western blot,WB)检测心肌、肺组织TLR-3、sFlt-1、TNF-α 表达 将冻存的大鼠心肌组织和肺组织分别用1 mL 裂解液于冰上裂解30 min,室温下静置30 min,收集上清液。等体积加入2×的蛋白上样缓冲液Loading buffer 混合均匀,100 ℃加热5 min 使蛋白质充分变性得各组样品液。每个点样孔加20 μL 样品液,在10%十二烷基硫酸(sodium dodecyl sulfate,SDS)聚丙烯酰胺凝胶中以30 V 电压电泳20 min 将样液压入加样孔底部,以80 V 电压电泳约1 h 使目的蛋白清晰分离。通过分离蛋白转移法将凝胶转移到聚偏氟乙烯[Poly(vinylidene fluoride),PVDF]膜上,室温条件下用5%脱脂牛奶在PBS 中封闭1 h。加入稀释比为1︰2 000 的一抗,4 ℃摇床上孵育过夜。次日取出PVDF 膜,用含有0.1% Tween-20 的PBS 冲洗3 次,5 min/次,加入稀释比为1︰500 的二抗,室温孵育2 h 后加入ECL 显影液显影。以GAPDH为内参,使用Image Pro Plus 6.0 图像分析系统分析检测计算各目标蛋白的灰度值。
1.3 统计学处理 采用SPSS 26.0 软件对所得数据进行统计分析,计量资料用()表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组孕鼠心肌、肺组织形态学 70 只大鼠建模成功66 只,分组情况如下,模型组和Dex 低剂量组各8 只,其余各组均10 只。其中模型组在治疗过程中因脓毒性休克死亡1 只,Dex 低剂量组因急性肺损伤死亡1 只,模型组和Dex 低剂量组各剩7 只。
2.1.1 各组孕鼠心肌组织形态学观察 对照组大鼠心肌组织细胞形态正常,心肌纤维排列整齐,间隙正常,无炎细胞浸润、细胞间质无充血水肿;模型组大鼠心肌组织细胞严重变形、心肌纤维排列紊乱,间隙明显增宽,细胞间质出现明显充血水肿,水肿部分有炎细胞聚集、浸润,明显可见有心肌细胞坏死;Dex 低、中、高剂量组给药后对心肌细胞变形、炎细胞聚集浸润、细胞间质水肿等现象均有明显改善,且以上现象均随Dex 浓度的升高而减轻;Poly I︰C 低、中、高剂量组给药后对均有一定的改善,且以上现象均随Poly I︰C 浓度的升高而减轻;Dex低、中、高剂量组心肌细胞变形、炎细胞聚集浸润、细胞间质水肿等现象分别较Poly I︰C 低、中、高剂量组有明显减轻。见图1。

图1 HE染色观察各组孕鼠心肌组织形态学(×400)
2.1.2 各组孕鼠肺组织形态学观察 对照组大鼠肺组织结构完整,肺泡腔轮廓光滑清晰,肺泡间隔无典型性水肿,无炎症细胞聚集浸润;模型组大鼠肺组织有明显的病理性损伤出现,肺泡结构严重破坏,肺泡壁有明显水肿,肺间质增厚明显并伴随大量炎症细胞聚集浸润;与模型组相比,Dex 低、中、高剂量组给药后肺组织损伤、肺泡结构破坏和间质内炎症细胞聚集浸润现象均有明显改善,且以上现象均随Dex 浓度的升高而减轻,Poly I︰C 低、中、高剂量组给药后肺组织损伤、肺泡结构破坏和间质内炎症细胞聚集浸润现象均有一定的改善,且以上现象均随Poly I︰C 浓度的升高而减轻;Dex 低、中、高剂量组肺组织损伤、肺泡结构破坏和间质内炎症细胞聚集浸润现象分别较Poly I︰C 低、中、高剂量组有明显减轻。见图2。

图2 HE染色观察各组孕鼠肺组织形态学(×200)
2.2 TUNEL 法检测心肌细胞和肺组织细胞凋亡 模型组心肌细胞和肺组织细胞凋亡率均明显高于对照组,差异均有统计学意义(P<0.05);与模型组相比,Dex 低、中、高剂量组和Poly I︰C 低、中、高剂量组的心肌细胞和肺组织细胞凋亡率均降低,差异均有统计学意义(P<0.05),且分别随Dex、Poly I︰C 浓度的增加而降低,差异均有统计学意义(P<0.05);Poly I︰C 低、中、高剂量组心肌细胞和肺组织细胞凋亡率分别高于Dex 低、中、高剂量组,差异均有统计学意义(P<0.05),见表1。TUNEL法检测各组心肌细胞凋亡,见图3;TUNEL 法检测各组肺组织细胞凋亡,见图4。

图3 TUNEL法检测各组心肌细胞凋亡(×400)

图4 TUNEL法检测各组肺组织细胞凋亡(×400)
表1 各组大鼠心肌细胞、肺组织细胞凋亡率比较[%,()]

表1 各组大鼠心肌细胞、肺组织细胞凋亡率比较[%,()]
*与对照组比较,P<0.05;#与模型组比较,P<0.05;&与Dex低剂量组比较,P<0.05;△与Dex 中剂量组比较,P<0.05;▲与Dex 高剂量组比较,P<0.05;▽与Poly I∶C 低剂量组比较,P<0.05;▼与Poly I∶C 中剂量组比较,P<0.05。
2.3 化学发光免疫法检测心肌、肺组织CRP、IL-6和IL-10 的含量 模型组心肌和肺组织CRP、IL-6、IL-10 的含量明显高于对照组,差异均有统计学意义(P<0.05);与模型组相比,Dex 低、中、高剂量组和Poly I︰C 低、中、高剂量组的心肌和肺组织CRP、IL-6 和IL-10 的含量均降低,差异均有统计学意义(P<0.05),且分别随Dex、Poly I︰C 浓度的增加而降低,差异均有统计学意义(P<0.05);Poly I︰C 低、中、高剂量组心肌和肺组织CRP、IL-6 和IL-10 的含量分别高于Dex 低、中、高剂量组,差异均有统计学意义(P<0.05)。见表2、3。
表2 各组大鼠心肌组织CRP、IL-6、IL-10的含量()

表2 各组大鼠心肌组织CRP、IL-6、IL-10的含量()
*与对照组比较,P<0.05;#与模型组比较,P<0.05;&与Dex 低剂量组比较,P<0.05;△与Dex 中剂量组比较,P<0.05;▲与Dex 高剂量组比较,P<0.05;▽与Poly I∶C 低剂量组比较,P<0.05;▼与Poly I∶C 中剂量组比较,P<0.05。
表3 各组大鼠肺组织CRP、IL-6、IL-10的含量()
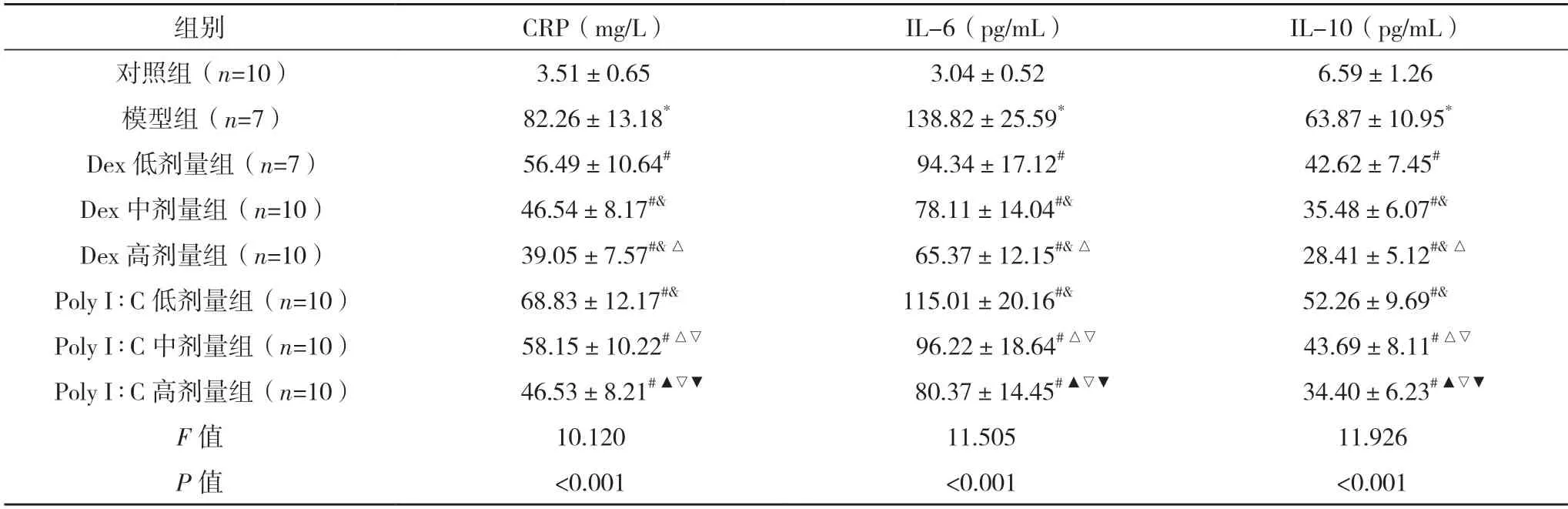
表3 各组大鼠肺组织CRP、IL-6、IL-10的含量()
*与对照组比较,P<0.05;#与模型组比较,P<0.05;&与Dex 低剂量组比较,P<0.05;△与Dex 中剂量组比较,P<0.05;▲与Dex 高剂量组比较,P<0.05;▽与Poly I∶C 低剂量组比较,P<0.05;▼与Poly I∶C 中剂量组比较,P<0.05。
2.4 WB检测心肌、肺组织TLR-3、sFlt-1、TNF-α 的表达 模型组心肌和肺组织TLR-3、sFlt-1、TNF-α 的相对表达量均明显高于对照组,差异均有统计学意义(P<0.05);与模型组相比,Dex 低、中、高剂量组和Poly I︰C 低、中、高剂量组的心肌和肺组织TLR-3、sFlt-1、TNF-α 的相对表达量均降低,差异均有统计学意义(P<0.05),且分别随Dex、Poly I︰C 浓度的增加而降低,差异均有统计学意义(P<0.05);Poly I︰C 低、中、高剂量组心肌和肺组织TLR-3、sFlt-1、TNF-α 的相对表达量分别高于Dex 低、中、高剂量组,差异均有统计学意义(P<0.05)。见表4、5。
表4 各组大鼠心肌组织TLR-3、sFlt-1、TNF-α的相对表达()

表4 各组大鼠心肌组织TLR-3、sFlt-1、TNF-α的相对表达()
*与对照组比较,P<0.05;#与模型组比较,P<0.05;&与Dex 低剂量组比较,P<0.05;△与Dex 中剂量组比较,P<0.05;▲与Dex 高剂量组比较,P<0.05;▽与Poly I∶C 低剂量组比较,P<0.05;▼与Poly I∶C 中剂量组比较,P<0.05。
表5 各组大鼠肺组织TLR-3、sFlt-1、TNF-α的相对表达()

表5 各组大鼠肺组织TLR-3、sFlt-1、TNF-α的相对表达()
*与对照组比较,P<0.05;#与模型组比较,P<0.05;&与Dex 低剂量组比较,P<0.05;△与Dex 中剂量组比较,P<0.05;▲与Dex 高剂量组比较,P<0.05;▽与Poly I∶C 低剂量组比较,P<0.05;▼与Poly I∶C 中剂量组比较,P<0.05。
3 讨论
脓毒症的发病机制是机体受到各感染因素的刺激激活体内炎症细胞,这些炎症细胞释放多种炎性介质,这些炎性介质之间产生级联放大反应使炎症反应失控,最终导致脓毒症的发生[11]。妊娠合并脓毒症的危险因素主要包括孕产妇肥胖、免疫力低下、侵入性操作和无菌条件差等[12]。妊娠合并脓毒症有可能发生于妊娠期的任一阶段,会致使孕妇流产、早产甚至死胎,大大增加了孕产妇的死亡率,是全球孕产妇死亡的主要原因之一[13]。临床治疗妊娠合并脓毒症的方法主要是液体复苏、支持治疗和抗感染治疗[14]。Dex 作为近期研究较多的新型治疗脓毒症的药物,其作用机制依然不甚清晰。本研究通过构建妊娠合并脓毒症大鼠模型,探究Dex 对妊娠合并脓毒症大鼠心肺组织损伤和炎症反应的作用及机制。
本研究中各组大鼠心肺组织形态学和细胞凋亡率比对结果均显示,Dex 和Poly I︰C 均对减少妊娠合并脓毒症大鼠心肺组织损伤和细胞凋亡有明显效果,其作用效果对Dex、Poly I︰C 呈剂量依赖性,随Dex、Poly I︰C 浓度的增加各组大鼠心肺组织损伤和细胞凋亡率呈减少趋势。有研究发现,在大鼠缺血再灌注损伤模型中,Dex 通过降低TLR-4 和核因子κB(nuclear factor kappa-B,NF-κB)的表达调控TLR/NF-κB 信号通路,减轻肺泡间隔水肿及炎细胞聚集浸润,保护心肌和肺器官[15]。Poly I︰C 是一种合成型的双链核糖核酸类似物,有抗病毒和免疫调节功能,是TLR-3 的激动剂,可被TLR-3 识别,诱导IL-10、IL-6、TNF-α 等细胞因子的产生和NF-κB的活化,实现协同激活机体免疫的功能[16]。
本研究中,模型组心肌和肺组织的CRP、IL-6、IL-10含量及TLR-3、sFlt-1、TNF-α 的蛋白相对表达量均高于对照组;与模型组比,Dex和Poly I︰C 各浓度组心肌和肺组织的CRP、IL-6、IL-10 含量及TLR-3、sFlt-1、TNF-α 的蛋白相对表达量均降低,其中Dex 和Poly I︰C 的作用均呈剂量依赖性,且Poly I︰C 低、中、高剂量组的作用效果分别低于Dex 低、中、高剂量组。说明Dex 和Poly I︰C 均有下调妊娠合并脓毒症大鼠模型心肌和肺组织的CRP、IL-6、IL-10 含量和TLR-3、sFlt-1、TNF-α 的蛋白相对表达的效果,且Dex 的作用效果优于Poly I︰C,推测Dex 可通过同时调控TLR-4、TLR-3 的表达实现抗炎效果。CRP 是炎症反应的标志物,在机体发生炎症反应时,在IL-6、干扰素、肿瘤坏死因子等细胞因子的调控下,由肝细胞生成CRP 并迅速升高[17]。IL-10 作为抗炎因子能抑制促炎性细胞因子包括TNF-α、IL-1 和IL-6 等的产生[18]。TLR-3 作为病毒双链核糖核酸(ribonucleic acid,RNA)识别受体,不仅在机体免疫调控中扮演着重要的角色,而且在机体重要脏器的缺血再灌注损伤中起关键作用。TLR-3 通过介导含Toll-IL-1 受体(Toll-interleukin-1 receptor,TIR)结构的转接蛋白(TIR-domain-containing adaptor inducing interferon,TRIF)途径发出信号,TRIF 途径被激活后活化干扰素调节因子3(interferon regulatory factor 3,IRF-3),诱导产生Ⅰ型干扰素,使NF-κB 表达增多和T 细胞趋化,其中γT 细胞释放的血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子(epidermal growth factor,EGF)和转化生长因子(transforming growth factor,TGF)等炎性因子,促使机体产生抗炎抗感染等天然免疫反应[19]。sFlt-1 是血管内皮生长因子受体家族成员,sFlt-1 与VEGF 结合并作为其竞争性抑制剂抑制VEGF 的促炎症作用,sFlt-1 水平的升高是抗炎反应启动的重要标志,可作为脓毒症的重要预后指标[20]。有研究发现,TLR-3 可上调sFlt-1 的表达,而TLR-3 在与配体结合后可诱导IL-10 的产生和发挥抗炎作用[21],进一步证实了本研究的猜想。
综上所述,右美托咪定很可能是通过降低TLR-3、TNF-α的表达水平,抑制CRP、IL-6和IL-10 的产生,下调代表机体炎症反应强度的sFlt-1 的水平,实现减轻妊娠合并脓毒症大鼠心肺组织损伤的作用。但是本实验仅作为初步的体外研究,其结果有待进一步的体内实验验证。
