miR-615-5p 在高血压患者血清中表达及其调控Akt/eNOS信号通路的机制
2022-09-13娄满高春燕王宏业
娄满 高春燕 王宏业
(哈励逊国际和平医院 1老年病一科,河北 衡水 053000;2中医科)
高血压与心血管不良事件的风险增加有关。一份流行病学报告显示,2010年全世界31.1%(13.9亿人)的成年人患有高血压。高血压增加了相关器官损害的风险,如高血压性心脏病(HHD)、高血压性脑病和肾硬化〔1〕。根据弗雷明翰心脏研究,收缩压增加20 mmHg导致56%的心力衰竭风险增加〔2〕。此外,高血压引起以心肌纤维化为特征的心脏重塑,导致心力衰竭进展〔3〕。
MicroRNAs(miRs)是一种小的(约22个核苷酸长)非编码RNA,在转录后水平负调控基因表达〔4〕。研究表明,由细胞释放的miRs在外体(直径40~100 nm的小膜囊泡)中可被吸收并调节邻近器官和组织中的受体细胞反应〔5〕。在人类和动物中已经证实了几种miR的失调参与高血压,但是选择哪种miR作为高血压靶点是重要研究挑战〔6〕。
内皮型一氧化氮合酶(eNOS)是NOS的一种同功酶,可合成纳米量的一氧化氮(NO);其他NOS同功酶包括神经元型(n)NOS、诱导型(i)NOS和细菌型(b)NOS〔7〕。eNOS磷酸化通过过氧化物酶体增殖物激活受体(PPAR)-γ-eNOS、氧化应激和乌苷酸结合蛋白(Rho)激酶途径、血管生成素相关生长因子、血管内皮生长因子介导的缺氧局灶黏附激酶(FAK)磷酸化或磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(PKB,Akt)信号途径调节NO合成〔7〕。NO是由L-精氨酸通过eNOS磷酸化形成的,在调节血压方面起重要作用〔8〕。合成的NO刺激平滑肌细胞(SMC)中NO的受体可溶性鸟苷环化酶(sGC),从而将鸟苷三磷酸(GTP)转化为环鸟苷一磷酸(cGMP)〔9〕。sGC的激活通过NO-cGMP信号导致血管舒张。PI3K/Akt/eNOS信号途径对内皮细胞NO生成的内皮功能影响是众所周知的〔8〕。然而,目前还没有研究报道miR-615-5p通过eNOS磷酸化对NO合成的影响。本研究探讨miR-615-5p在高血压患者血清中表达及其潜在的调控机制。
1 资料与方法
1.1一般资料 选取100例原发性高血压患者为高血压组,入选标准:收缩压≥140 mmHg和(或)舒张压≥90 mmHg,最近4 w未服用降压药。另外选取收缩压<140 mmHg和舒张压<90 mmHg的患者(骨质疏松18例、前列腺增生10例、慢性肠炎15例、胃食管反流12例、甲状腺结节23例、轻度贫血8例、胃炎胃溃疡14例)100例为正常组。排除标准:继发性高血压,肝、肾等功能损伤者;合并患有糖尿病、妇科病、肿瘤、脑血管疾病、严重感染者;半年内有重大手术或者重大创伤者;冠心病者(对左冠状动脉主干、前降支、回旋支及右冠状动脉狭窄程度进行评价,以任何冠脉狭窄≥50%为诊断标准)。患者均签署知情同意书,并经医院伦理委员会批准。
1.2细胞培养 血管内皮细胞HMEC-1,在37℃、5%CO2环境下被培养,在添加2%胎牛血清(FBS)的DMEM中培养,实验采用活性条件下的第三代至第六代细胞。miR-615-5p、simiR-615-5p和Negative质粒用Lipofectamine3000 转染细胞。48 h后用于实验。
1.3荧光素酶检测 将含miR-615-5p结合位点的Akt序列的3′非翻译区(UTR)插入pmiR-RB报告载体(ribbio)的XhoI和NotI限制位点。使用Lipofectamine3000将荧光素酶报告载体与miR-615-5p和Negative共转染293T细胞。转染后48 h,Synergy H4酶标仪(BioTek,Winooski,VT,USA)被用于检测荧光素酶活性。
1.4CCK8检测和Edu染色 用CCK8检测细胞活力。HMEC-1 细胞(1×104个/ml加入96孔板中)使用Lipofectamine 3000转染相关质粒转染48 h后,CCK8(终浓度10-5mol/L)被加入细胞再培养30 min。转染48 h后,50 μmol/L Edu〔0.5% TritonX-100的磷酸盐缓冲液(PBS)〕孵育30 min,PBS 清洗1次,5 min。用荧光显微镜观察。
1.5定量实时逆转录聚合酶链反应(qRT-PCR)检测mRNA表达 RNAiso PLUS(TAKARA-Korea Biomedical Co.)用于分离总RNA,用LeGene Premium Express(TAKARA-Korea Biomedical Co.)合成cDNA。SYBR Green(TAKARA-Korea Biomedical Co.)被用于qRT-PCR,循环条件如下:95℃下3 min,然后在95℃下孵育30 s,61℃下孵育50 s,72℃下孵育1 min。
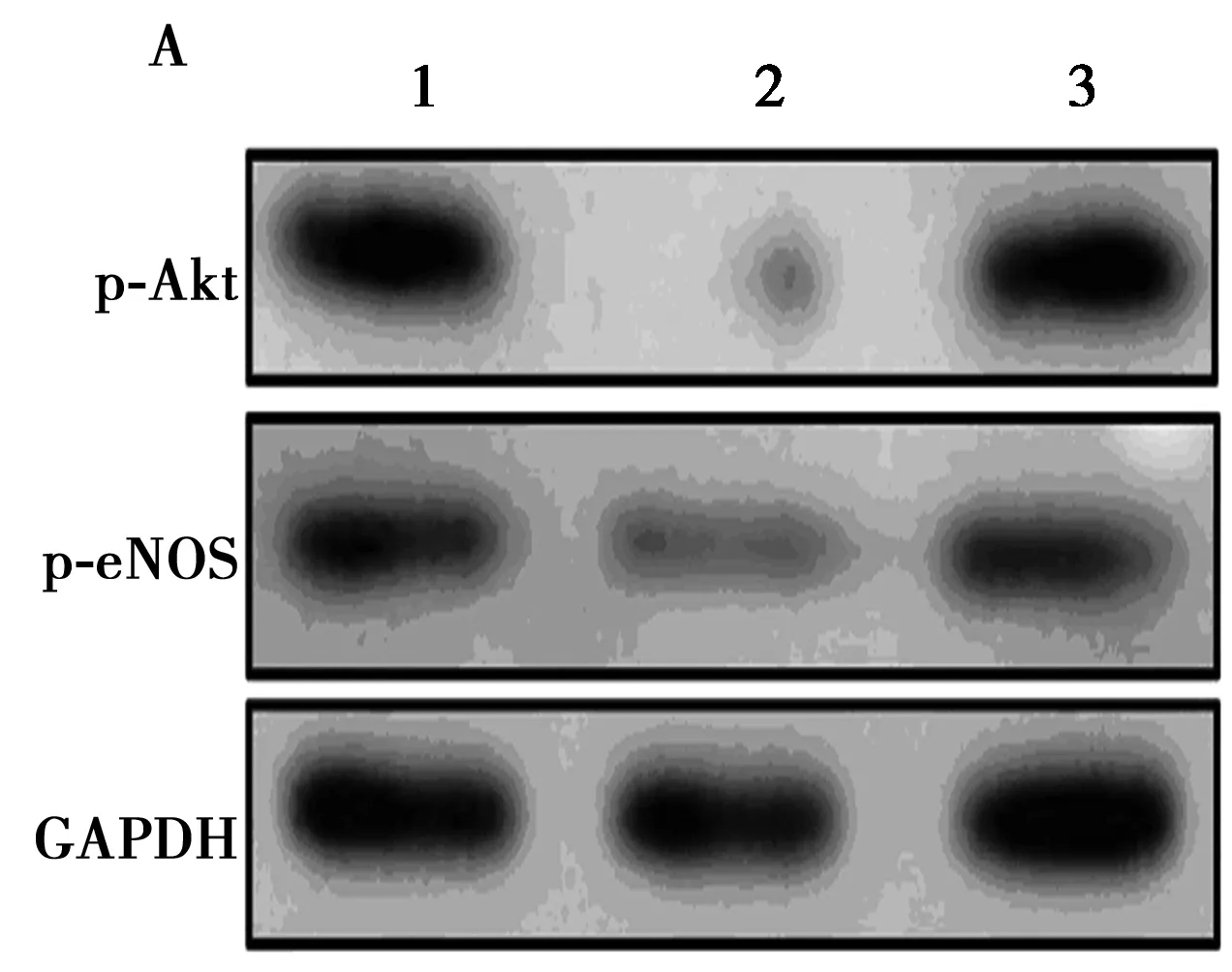
1.6Western印迹 HMEC-1 细胞用RIPA裂解缓冲液裂解,细胞裂解物在4℃下以13 000 r/min离心20 min后,上清液用作细胞蛋白样品。蛋白质样品(50 μg/条带)经10%凝胶电泳分离,转移到聚偏氟乙烯(PVDF)膜上。在室温下,用5%脱脂干脱脂乳在TBST中封闭1 h。然后,在4℃条件下,用一抗体:p-Akt,p-eNOS和GAPDH孵育过夜。用TBST冲洗5次,30 min后,用辣根过氧化物酶(HRP)结合的二级抗体(稀释液:1∶2 000)室温60 min,用TBST冲洗5次30 min。用电化学发光(ECL)试剂观察免疫反应蛋白-抗体复合物,并用发光图像分析仪(LAS-4000;富士胶片,日本东京)扫描。
1.7统计学分析 采用SAS9.4软件进行t检验、Pearson相关性分析。
2 结 果
2.1两组一般资料比较 两组治疗前24 h平均收缩压及24 h平均舒张压差异有统计学意义(P<0.05),其余资料差异均无统计学意义(P>0.05),见表1。
2.2miR-615-5p 在高血压患者血清中表达 miR-615-5p 在高血压组血清中的表达(7.65±1.46)显著高于正常组(1.00±0.12,P<0.05)。miR-615-5p与右心室收缩压(RVSP)及右心室肥厚指数〔RV/(LV+S)〕呈正相关(r=9.35,P=0.012;r=9.568,P=0.021),见图1。
表1 两组一般资料比较
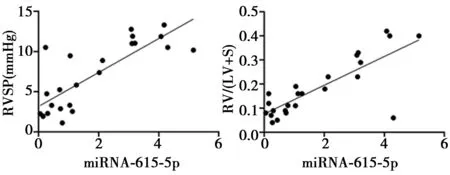
图1 miR-615-5p与RVSP及RV/(LV+S)的相关性
2.3miR-615-5p 调节血管内皮细胞增殖 在体外模型中,过表达miR-615-5p质粒明显上调miR-615-5p血管内皮细胞表达(P<0.05),见表2。上调miR-615-5p明显抑制血管内皮细胞增殖,明显增加Edu细胞比例(均P<0.05),见表2、图2。在体外模型中,simiR-615-5p质粒明显下调miR-615-5p血管内皮细胞表达(P<0.05),见表3。下调miR-615-5p明显促进血管内皮细胞增殖,明显减少Edu细胞比例(均P<0.05),见图2、表3。
表2 miR-615-5p 调节血管内皮细胞增殖、caspase-3、caspase-9活性表达及p-Akt和p-eNOS蛋白表达

表3 simiR-615-5p调节血管内皮细胞增殖和caspase-3/9活性表达及p-Akt和p-eNOS蛋白表达
2.4miR-615-5p 调节血管内皮细胞caspase-3/9活性表达 在体外模型中,上调miR-615-5p明显激活caspase-3/9活性表达水平;下调miR-615-5p明显抑制caspase-3/9活性表达水平(均P<0.05),见表2、3。
2.5Akt是miR-615-5p 调节血管内皮细胞的靶点 与Negative组(1.02±0.05)对比,miR-615-5p荧光素酶表达量(0.48±0.03)明显减少(P<0.05);Akt 是miR-615-5p 调节血管内皮细胞的靶点,见图3A。上调miR-615-5p明显抑制p-Akt和p-eNOS蛋白表达量(P<0.05),见表2,图3B。下调miR-615-5p明显激活p-Akt和p-eNOS蛋白表达量(P<0.05),见表3、图3C。
2.6Akt激动剂调控miR-615-5p 调节血管内皮细胞 Akt激动剂,20 μmol/L Recilisib Sodium明显激活体外模型中miR-615-5p的p-Akt和p-eNOS蛋白表达量(P<0.05),见图4A、表4。Akt激动剂明显增加血管内皮细胞活性,明显减少Edu细胞比例和caspase-3/9活性表达(均P<0.05),见图4B、表4。

图3 Akt是miR-615-5p 调节血管内皮细胞的靶点
1~3:Negative组,miR-615-5p组,miR-615-5p+Akt激动剂组
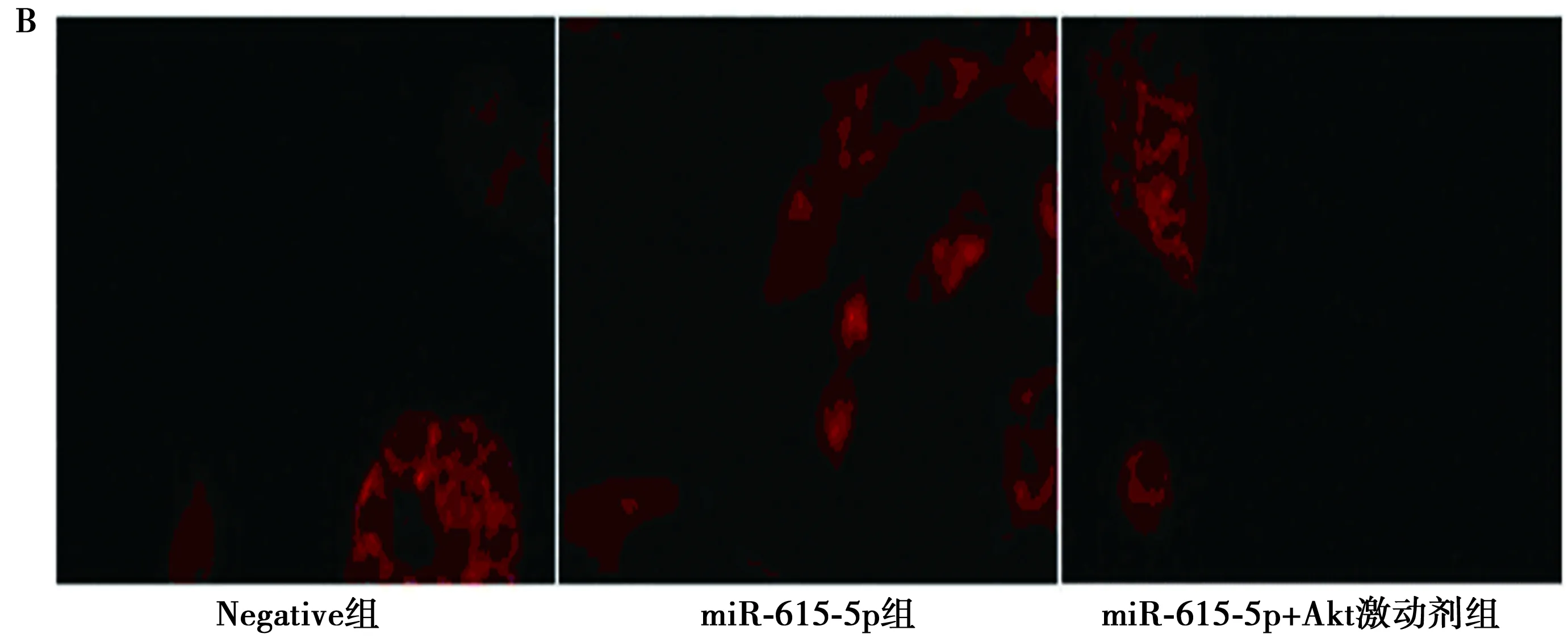
图4 Akt激动剂调控microRNA-615-5p调节血管内皮细胞(Edu染色,×400)
表4 Akt激动剂调控miR-615-5p 调节血管内皮细胞
3 讨 论
原发性高血压的发病机制非常复杂,目前认为炎症、免疫反应可能是其发生发展的重要机制之 一〔10,11〕。miRs是20~26个核苷酸长的单链非编码RNA分子,主要通过与下游靶点mrna的3′-UTR相互作用参与转录后基因表达的抑制。研究表明miRs参与多种关键的生物学过程,包括癌症、炎症反应和细胞功能〔12〕。近年来,miRs与高血压的发生、发展及其病理生理功能的调节密切相关。Li 等〔13〕研究发现,miR-615-3p在脾功能亢进中显著上调。本研究结果提示,miR-615-5p可能参与高血压疾病进程。
目前,导致高血压升高的机制尚无统一的认识,典型的理论认为与激素、神经、血管、胰岛素抵抗等机制有关〔14〕。血管机制认为,高血压的发生、发展与微血管改变的关系密切,高血压的重要病理生理特点是外周血管阻力增高〔15〕。研究显示血管内皮细胞功能障碍会影响血管的舒张功能,是高血压发病的重要危险因素〔16〕。考虑到合并冠心病可能影响到研究结论,本研究未纳入合并冠心病患者。Jiang等〔17〕研究发现,miR-615-5P的过度表达影响了内皮细胞从高血糖和低氧应激诱导的细胞凋亡,可抑制病理性血管生成,并增加了内皮细胞的生存能力、细胞迁移和血管形成,并改善血管功能障碍和病理性血管生成及毛细胞血管变性、通透性和炎症等。说明miR-615-5p可能在高血压中抑制血管内皮细胞增殖,促进高血压的发展。
eNOS活性降低和NO分泌减少是内皮功能紊乱导致血管舒缩功能障碍形成高血压的关键环节〔18〕。NO是调节内皮细胞功能的重要体液因子,NO与血管内皮生长因子存在相互作用,能使血管内皮生长因子mRNA上调,有利于修复受损的内皮细胞,抑制损伤内膜增厚,改善血管重构〔19,20〕。细胞中的磷酸化eNOS积极诱导NO生成,从而调节血管张力和细胞增殖〔21〕。此外,PKB(Akt)被认为可提高eNOS的磷酸化水平〔22〕。Icli等〔23〕研究发现,miR-615-5p通过靶向调控内皮细胞中Akt/eNOS信号,来调控血管生成和组织修复。这些结果说明,miR-615-5p通过抑制Akt/eNOS信号,减少内皮细胞的增殖,促进高血压发展。
综上,miR-615-5p在高血压患者血清中的表达被上调。上调miR-615-5p抑制血管内皮细胞增殖,激活caspase-3/9活性表达水平,抑制p-Akt和p-eNOS蛋白表达量。提示miR-615-5p可能是一种潜在的高血压的治疗靶点。
