鼠李糖乳杆菌和乳双歧杆菌的复合益生菌粉对小鼠免疫功能的影响及其食用安全性的研究
2022-09-13赵文婷陈智仙张海波
赵文婷,陈智仙,张海波
(安琪纽特股份有限公司,湖北宜昌 443000)
免疫力简言之就是身体抵抗病原微生物入侵的能力。但现在人们的很多生活习惯都使免疫力降低,如生活压力变大使得人们过度紧张焦虑、长期熬夜导致睡眠不足、营养不均衡、吸烟酗酒、长期缺乏健身运动、太爱干净、滥用药物等。由此可见,提升免疫力对保持身体健康至关重要。
益生菌一词最初源于希腊语,是“有益于生命”的意思,与抗生素定义恰恰相反,抗生素的字面意思是“不利于生命”。专家将益生菌定义为“活的微生物,当摄入足够的数量时,对宿主能带来健康益处”。与免疫系统的相互作用是益生菌的一个重要机制。人体免疫细胞的70%~80%位于胃肠道,肠道微生物在机体形成免疫能力的过程中发挥重要作用。益生菌与免疫细胞相互作用的能力,可能增强机体对感染的抵抗力并增加耐受性,降低潜在过敏症状。研究证明,鼠李糖乳杆菌LGG 的纯化菌毛可以与树突细胞上的特定基序(DC-SIGN)相互作用,以增加细胞因子如IL-12 的表达;LGG 还能够通过减少单核细胞上炎症标志物的表达,并通过增加巨噬细胞中白细胞介素10、白细胞介素12 和肿瘤坏死因子-的产生来增强免疫应答。此外,鼠李糖乳杆菌LGG 基因组含有一个特定的CpG 基序,命名为ID35,它可以在体外以及卵白蛋白致敏小鼠过敏模型中刺激Th 1 应答。乳双歧杆菌Bi-07 也被证实能够增强免疫力。有研究发现,乳双歧杆菌Bi-07 可以通过改善单核细胞和粒细胞的吞噬活性提升老年人的免疫力,Bi-07 还可以减少肠道细菌易位的发生、降低炎症因子的表达,从而增强机体免疫力。但目前对鼠李糖乳杆菌和乳双歧杆菌复合益生菌粉对小鼠免疫功能的影响及食用安全性方面的研究还较为罕见。
本文研究了鼠李糖乳杆菌和乳双歧杆菌复合益生菌粉对免疫功能的影响及食用安全性,观测脏器/体重比值、细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK 细胞活性以及急性毒性、遗传毒性和亚急性毒性等指标,为进一步开发、应用鼠李糖乳杆菌和乳双歧杆菌复合益生菌粉提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
SPF 级昆明种雄性小白鼠、SPF 级SD 大鼠、昆明种小鼠 西安交通大学医学院试验动物中心,SPF 级昆明种雄性小白鼠(质量合格证号:6100 1700003079、61001700003097、61001700003603、61 001700003577、61001700003636)用于改善免疫力相关试验。SPF 级SD 大鼠(质量合格证号:6100 1700003129、61001700003149)和昆明种小鼠(质量合格证号:61001700003144、61001700003146)用于食用安全性相关试验,许可证号为SYXK(陕)2018-009,温度20~25 ℃,相对湿度45%~65%;鼠李糖乳杆菌、乳双歧杆菌复合益生菌粉 安琪酵母股份有限公司;绵羊红细胞(SRBC)、鸡红细胞、YAC-1 细胞、鼠伤寒沙门氏菌突变型(TA97、TA98、TA100、TA102)Molecular Toxicology 公 司;甲醇、丙酮、酸性异丙醇、甲醛、乳酸锂、硝基氯化四氮唑(INT)、吩嗪二甲酯硫酸盐 分析纯,国药集团;青霉素、链霉素、氧化型辅酶 I 上海一基实业有限公司;印度墨汁、Hank’s 液、MTT、ConA、RPMI1640 培养液、2-ME、台酚蓝、补体(豚鼠血清)、Gimsa 染液 北京索莱宝科技有限公司;敌克松、1,8-二羟基蒽醌、叠氮化钠、2-氨基芴、大鼠肝微粒体酶(S-9)、小牛血清Sigma 公司;环磷酰胺分析纯,上海华联制药有限公司。
酶标仪(Epoch)美国BioTek 公司;BS-420 生化分析仪 深圳迈瑞有限公司;DR-6000 紫外分光光度计 Sigma 公司;BC-2800vet 血细胞分析仪、生物显微镜 上海精密仪器仪表有限公司;BSA 124S电子天平 德国赛多利斯公司;BPN-150CRH(UV)细胞培养箱 上海一恒科学仪器有限公司;SW-CJ-2D 超净工作台 苏州净化公司。
1.2 实验方法
1.2.1 复合益生菌粉的制备 向经过冷冻干燥的鼠李糖乳杆菌LGG 和乳双歧杆菌Bi-07 菌粉中,添加一定量的烘干后的食品级辅料(5%果糖、2%低聚果糖、10%麦芽糊精)后混合,得到该复合益生菌粉。1 g益生菌粉含鼠李糖乳杆菌LGG 和乳双歧杆菌Bi-07 菌分别为4.0×10、2.0×10CFU。
1.2.2 免疫功能实验
1.2.2.1 动物分组及处理 将200 只雄性小鼠随机分为五大组(分8 项试验),每组40 只,并将每大组随机分为4 小组,每小组10 只。设置高、中、低剂量组,即1.00、0.67、0.34 g/kg BW 三个组,并设溶剂对照组(蒸馏水)。各组小鼠按剂量设计每天灌胃复合益生菌粉一次,灌胃容量均为20 mL/kg BW,连续灌胃30 d 后进行各项免疫指标测定,期间自由进食进水,本次实验严格遵守动物试验相关国标。
1.2.2.2 淋巴器官比重测定 10 只小鼠称重,取小鼠胸腺以及脾脏称重。计算胸腺/体重比值及脾脏/体重比值。
1.2.2.3 DTH 测定 给复合益生菌粉第26 d,10 只小鼠腹腔注射0.2 mL 体积分数为2%的绵阳红细胞(SRBC)溶液,致敏动物,致敏后第4 d,每只鼠左后足跖皮下注射20 μL 体积分数为20%的SRBC 溶液进行攻击。并于攻击前和攻击后24 h 分别测量每只鼠左后足跖同一部位厚度,同一部位测三次,取平均值。计算攻击前、后的足跖厚度差值来表示DTH值。
1.2.2.4 ConA 诱导的小鼠脾淋巴细胞转化试验(MTT法)无菌摘取小鼠脾脏制备成单细胞悬液,按照MTT 法测定OD 值。
1.2.2.5 抗体生成细胞检测(Jerne 改良玻片法)10 只小鼠腹腔注射0.2 mL 体积分数为2%的SRBC溶液,免疫4 d 后取出小鼠脾脏制成单细胞悬液,用200 目筛网过滤。将细胞浓度调整为5×10个/mL,与等量2 倍浓度的Hank’s 液(pH7.2)混合,分装小试管,每管体积0.5 mL,再向管内加50 μL 10% SRBC、20 μL 脾细胞悬液,迅速混匀,倾倒于己刷琼脂糖薄层的玻片上,待琼脂凝固后,将玻片水平扣放在片架上,放入二氧化碳培养箱中培养1.5 h,然后用SA 缓冲液稀释的补体(1:8)加入玻片架凹槽内,继续培养1.5 h 后,计数溶血空斑数。
1.2.2.6 血清溶血素的测定 给复合益生菌粉第26 d,10 只小鼠腹腔注射0.2 mL 体积分数为2%的SRBC溶液,免疫后第4 d 摘眼球采血,分离血清。用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝板内,每孔100 μL,再加入100 μL 0.5%(v/v)的SRBC 悬液,混匀,装入湿润的平盘内加盖,37 ℃培养3 h 后进行血清溶血素测定。记录血球凝集度,计算相应抗体积数。
1.2.2.7 小鼠碳廓清试验 各组小鼠尾静脉注射用生理盐水4 倍稀释的印度墨汁10 mL/kg BW。每只小鼠在注射墨汁后2 和10 min 分别通过眼内眦静脉丛各取血20 μL,并迅速加入到2 mL 浓度为0.1%的NaCO溶液中摇匀。以NaCO溶液作空白对照。紫外可见分光光度计测试600 nm 波长处光密度值(OD)。将小鼠处死后取肝脏和脾脏,用滤纸吸干脏器表面血污,分别称重计算吞噬指数(a)。
1.2.2.8 小鼠腹腔巨噬细胞吞噬鸡红细胞试验 各组小鼠均腹腔注射1 mL 体积分数为20%的鸡红细胞悬液,间隔30 min 乙醚麻醉后颈椎脱臼处死小鼠,经腹腔注入2 mL 生理盐水。转动鼠板1 min 后吸出腹腔洗液1 mL 平均分滴于2 片载玻片上,放入搪瓷盒内,37 ℃温育30 min。后再用生理盐水洗涤,以1:1 的丙酮甲醇溶液固定,4%(v/v)Giemsa-磷酸缓冲液染色,再用蒸馏水漂洗、晾干。显微镜下观察100 个巨噬细胞,计数吞噬鸡红细胞的巨噬细胞数和巨噬细胞吞噬的鸡红细胞总数及其被消化的程度,按公式求出吞噬率、吞噬指数:
吞噬率(%)=吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞数×100
吞噬指数=被吞噬的鸡红细胞总数/计数的巨噬细胞数
1.2.2.9 NK 细胞活性测定(乳酸脱氢酶LDH 法)将YAC-1(靶细胞)进行传代培养,调整细胞浓度为4×10个/mL。小鼠无菌取脾,制成单细胞悬液(效应细胞),裂解红细胞后调整细胞浓度为2×10个/mL。按照靶细胞和效应细胞比为50:1 将YAC-1 细胞和脾细胞各100 μL、靶细胞自然释放孔加靶细胞和培养液各100 μL、靶细胞最大释放孔加靶细胞和1%NP40 各100 μL 加入U 型96 孔培养板,上述各项均设三个平行孔,放置培养箱中37 ℃培养4 h。1500 r/min,5 min 离心,每孔吸取上清100 μL 置平底96 孔培养板中,同时加入LDH 基质液100 μL,根据室温反应8 min,每孔加入l mol/L 的盐酸30 μL,在酶标仪490 nm 处测定光密度值(OD)。
1.2.3 急性毒性实验 选用SD 大鼠20 只,体重180~220 g,雌、雄各半。按最大耐受剂量法设20.0 g/kg BW 为灌胃剂量(相当于人体推荐用量的600 倍)。称取100.0 g 复合益生菌粉加蒸馏水至100 mL,混合均匀,配制成100%的混悬液备用。动物禁食16 h,不禁水,灌胃体积按20 mL/kg BW,一次经口灌胃给予混悬液。灌胃后连续观察14 d 内大鼠的中毒症状及死亡情况,试验开始、7 及14 d 称量大鼠体重,试验结束后乙醚麻醉并颈椎脱臼处死大鼠,作大体解剖。
1.2.4 遗传毒性试验
1.2.4.1 动物分组及处理 选取昆明种小鼠50 只,体重25~30 g,雌雄各半。将小鼠随机分为5 组,每组10 只,雌雄各半。设10.0、5.0、2.5 g/kg BW 三个剂量组,另设溶剂对照组(蒸馏水)及环磷酰胺阳性对照组(CP,40 mg/kg BW)。分别称取10.0、5.0、2.5 g复合益生菌粉加蒸馏水至20 mL,混合均匀,分别配制成50.0%、25.0%、12.5%的混悬液。另取CP 0.04 g 加蒸馏水至20 mL,溶解均匀备用。灌胃体积按20 mL/kg BW,试验采用30 h 灌胃法,两次间隔24 h,于第二次给样品后6 h 乙醚麻醉后颈椎脱臼处死动物,取股骨骨髓涂片,固定,Giemsa 染色后,在油镜下每只小鼠计数1000 个嗜多染红细胞(PCE)中的微核细胞数,计算微核的千分率。观察200 个嗜多染红细胞中成熟红细胞数,并计算嗜多染红细胞与成熟红细胞的比值(PCE/NCE)。
选取雄性昆明种小鼠50 只,体重25~35 g,将小鼠随机分为5 组,每组10 只动物。设10.0、5.0、2.5 g/kg BW 三个剂量组,另设溶剂对照组(蒸馏水)及环磷酰胺阳性对照组(CP,40 mg/kg BW)。分别称取10.0、5.0、2.5 g 复合益生菌粉加蒸馏水至20 mL,混合均匀,分别配制成50.0%、25.0%、12.5%的混悬液。另取CP 0.04 g 加蒸馏水至20 mL,溶解均匀,备用。灌胃体积按20 mL/kg BW,每日一次,连续5 d,首次给样品后35 d,乙醚麻醉后颈椎脱臼处死动物,取双侧附睾进行制片,甲醇固定,1%伊红染色后,在高倍镜下每只动物计数1000 条完整精子,记录精子畸形数、畸形类型并计算精子畸形率。
1.2.4.2 Ames 试验(平板掺入法)用多氯联苯诱导的大鼠肝微粒体酶(S-9)作为体外代谢活化系统,用间接致突变物(10 μg/皿2-氨基芴用于TA97、TA98、TA100,50 μg/皿1,8-二羟基蒽醌用于TA102 菌)测定S-9 活性。试验采用TA97、TA98、TA100、TA102四种菌株,样品设5000、1000、200、40、8 μg/皿五个剂量组及溶剂对照组、自发回变组和阳性对照组。称取1.00 g 复合益生菌粉,加蒸馏水至20 mL,混合均匀即为最高工作浓度为5%的混悬液,稀释即得其余所需浓度混悬液。试验时分别取各浓度混悬液100 μL 加入平皿即为样品各剂量。高压蒸汽灭菌(0.103 MPa,20 min)。在加+S-9 和不加-S-9 的试验条件下进行平板掺入法试验。每组作三个平行皿,重复试验一次。-S-9 阳性对照物(不加S-9):TA100用1.5 μg/皿的叠氮化钠,其余的三个菌株均采用50.0 μg 皿的敌克松;+S-9 阳性对照物(加S-9):TA102 用50.0 μg/皿的1,8-二羟基蒽醌,其余三个菌株均采用10.0 μg/皿的2-氨基芴。每皿加入阳性对照的体积为0.1 mL。
1.2.4.3 小鼠骨髓细胞微核试验 取小鼠股骨骨髓涂片,Giemsa 染色后,在显微镜下每只小鼠计数1000个嗜多染红细胞(PCE)中的微核细胞数,计算微核的千分率。观察200 个嗜多染红细胞中成熟红细胞数,并计算嗜多染红细胞与成熟红细胞的比值(PCE/NCE)。
1.2.4.4 小鼠精子畸形试验 取小鼠双侧附睾进行制片,甲醇固定,1%伊红染色后,在显微镜下每只动物计数1000 条完整精子,记录精子畸形数、畸形类型并计算精子畸形率。
1.2.5 30 d 喂养试验 选用离乳SD 大鼠80 只,雌雄各半,体重为65~92 g。将大鼠随机分为4 组,每组20 只,雌雄各半。设3.34、1.67、0.84 g/kg BW 三个剂量组(分别相当于人体推荐用量100、50、25倍),另设溶剂对照组(蒸馏水)。分别称取33.4、16.7、8.4 g 样品加蒸馏水至100 mL,混合均匀,分别配制成33.4%、16.7%、8.4%的混悬液备用。各组按10 mL/kg BW 每日经口灌胃一次,连续灌胃30 d。每天观察SD 大鼠的一般表现、行为、中毒症状及死亡,每周称一次体重和二次食物摄入量,根据食物摄入量,计算每周及总的食物利用率。试验结束称量禁食16 h 后的大鼠空腹体重,乙醚麻醉后采血并处死动物。测定血液学指标(血红蛋白、红细胞计数、白细胞计数及分类记数等)以及血液生化学指标(谷草转氨酶、谷丙转氨酶、血清尿素、总蛋白、白蛋白、白/球、总胆固醇、肌酐、甘油三酯、血糖),解剖动物观察内脏改变,称肝、肾、脾、睾丸湿重值。
1.3 数据处理
小鼠骨髓细胞微核试验采用卡方检验,小鼠精子畸形试验采用秩和检验,其余试验数据应用SPSS统计软件进行单因素方差分析。上述统计均用SPSS 17.0 for Windows 软件处理。
2 结果与分析
2.1 复合益生菌粉对小鼠淋巴器官指数的影响
胸腺和脾脏指数反映了免疫器官的发育和免疫细胞的功能状况,各剂量组的测试结果与阴性对照组并无显著差异(>0.05),如表1 所示。说明复合益生菌粉对小鼠免疫器官的重量无明显影响。这可能是因为测试时间不够且小鼠本身具有一定的调节能力导致。

表1 复合益生菌粉对小鼠淋巴器官/体重比值的影响Table 1 Effect of compound probiotic powder on mouse lymphatic organ/body weight ratio
2.2 复合益生菌粉对DTH 反应的影响
DTH 反应是细胞免疫的体内检测方法,小鼠足趾肿胀度可反应小鼠细胞免疫功能的强弱。结果表明高剂量组能显著增强小鼠对SRBC 诱发的DTH反应,与阴性对照组比较,差异有显著性(=0.014<0.05),但中低剂量组与阴性对照组差异不显著(>0.05),如图1 所示。这说明高剂量组的复合益生菌粉(1.00 g/kg BW)能增强小鼠细胞免疫。
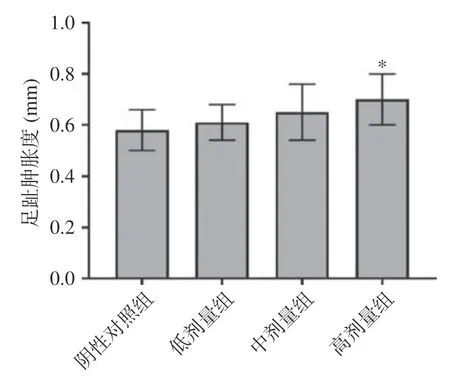
图1 复合益生菌粉对DTH 反应的影响Fig.1 Effect of compound probiotic powder on DTH reaction
2.3 复合益生菌粉脾淋巴细胞转化试验结果
T 淋巴细胞受到Con A 刺激后会转化为母细胞持续增殖。通过MTT 法检测其细胞增殖能力可以反应细胞免疫功能的强弱。各剂量组测试的ConA 诱导的小鼠脾淋巴细胞增殖能力与阴性对照组并无显著性差异(>0.05),如表2 所示。说明复合益生菌粉对小鼠淋巴细胞的增殖无明显影响。
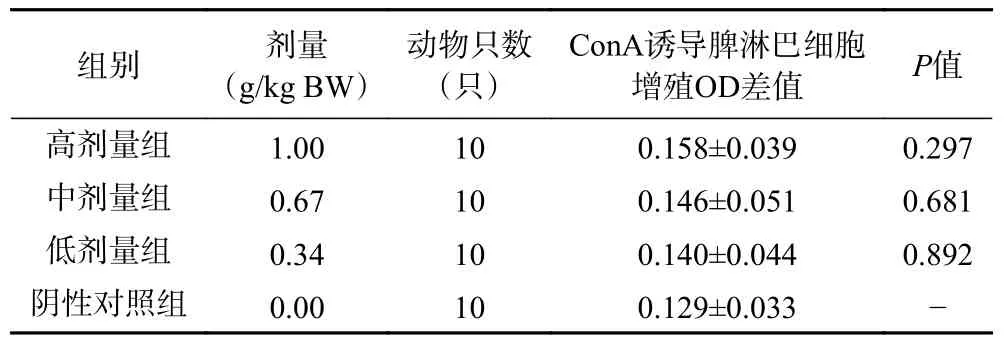
表2 复合益生菌粉对脾淋巴细胞转化功能的影响Table 2 Effect of compound probiotic powder on the transformation function of splenic lymphocytes
2.4 复合益生菌粉抗体生成细胞检测试验结果
溶血空斑试验是体外检测抗体生成细胞数目的方法,空斑的数量是反映机体的体液免疫功能的重要指标。高剂量组的空斑数与阴性对照组具有显著差异(=0.036<0.05),中低剂量组与阴性对照组的差异不显著(>0.05),如图2 所示。这说明给予高剂量的复合益生菌粉可以提升小鼠体液免疫功能。
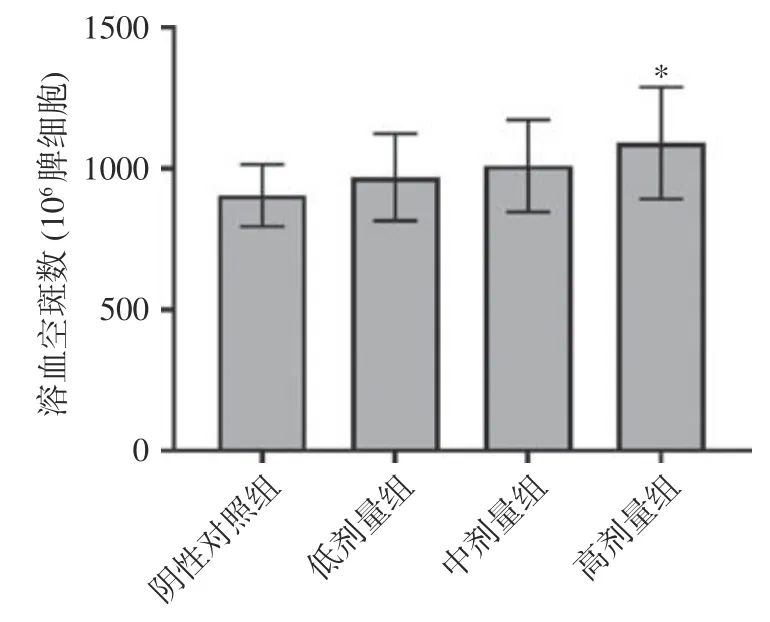
图2 复合益生菌粉对抗体生成细胞功能的影响Fig.2 Effect of compound probiotic powder on the function of antibody-producing cells
2.5 复合益生菌粉对小鼠血清溶血素水平的影响
小鼠体内产生的抗体溶血素在补体的参与下,与SRBC 共同孵育发生溶血反应,释放血红蛋白,而通过测定血红蛋白含量能反应动物产生溶血素的能力。高剂量组的小鼠溶血素水平与阴性对照组具有显著差异(=0.015<0.05),中低剂量组与阴性对照组差异不具有显著性(>0.05),如图3 所示。这也说明给予高剂量的复合益生菌粉可以提升小鼠体液免疫功能。

图3 复合益生菌粉对小鼠溶血素水平(抗体积数)的影响Fig.3 Effect of compound probiotic powder on mouse hemolysin level(anti-volume number)
2.6 复合益生菌粉碳廓清试验结果
巨噬细胞的碳廓清指数的大小可以反映巨噬细胞吞噬功能的强弱。巨噬细胞是具有免疫调节作用的免疫细胞,反映了机体非特异性免疫的强弱。实验结果显示高、中剂量组均能提高小鼠碳廓清吞噬指数,与阴性对照组比较,差异均有显著性(=0.012、0.047<0.05),低剂量组与阴性对照组差异不具有显著性(>0.05),如图4 所示。这说明高、中剂量组复合益生菌粉能增强巨噬细胞的吞噬功能,提升小鼠非特异性免疫。

图4 复合益生菌粉对小鼠碳廓清功能的影响Fig.4 Effect of compound probiotic powder on the carbon scavenging function of mice
2.7 大鼠急性毒性试验
以最大耐受剂量(MTD)20.0 g/kg BW 的剂量给予大鼠灌胃后,动物生长良好、行为正常、反应敏捷、体重增加,未见动物有明显中毒症状,14 d 内动物无死亡。试验结束解剖动物,大体观察肝、心、肾、肺、脾、胃、肠等主要脏器均未见明显异常。结果表明,该复合益生菌粉对雌、雄大鼠急性经口毒性MTD 均大于20.0 g/kg BW,如表3 所示。这说明复合益生菌粉无急性毒性。

表3 复合益生菌粉对大鼠急性毒性试验结果Table 3 Acute toxicity test results of compound probiotic powder on rats
2.8 遗传毒性试验
2.8.1 Ames 试验 经过两次实验,无论在加和不加S-9 条件下,复合益生菌粉各剂量组的回变菌落数均未超过自发回变菌落数的两倍,亦无剂量-反应关系,表明该样品诱变试验结果为阴性,如表4 和表5所示。
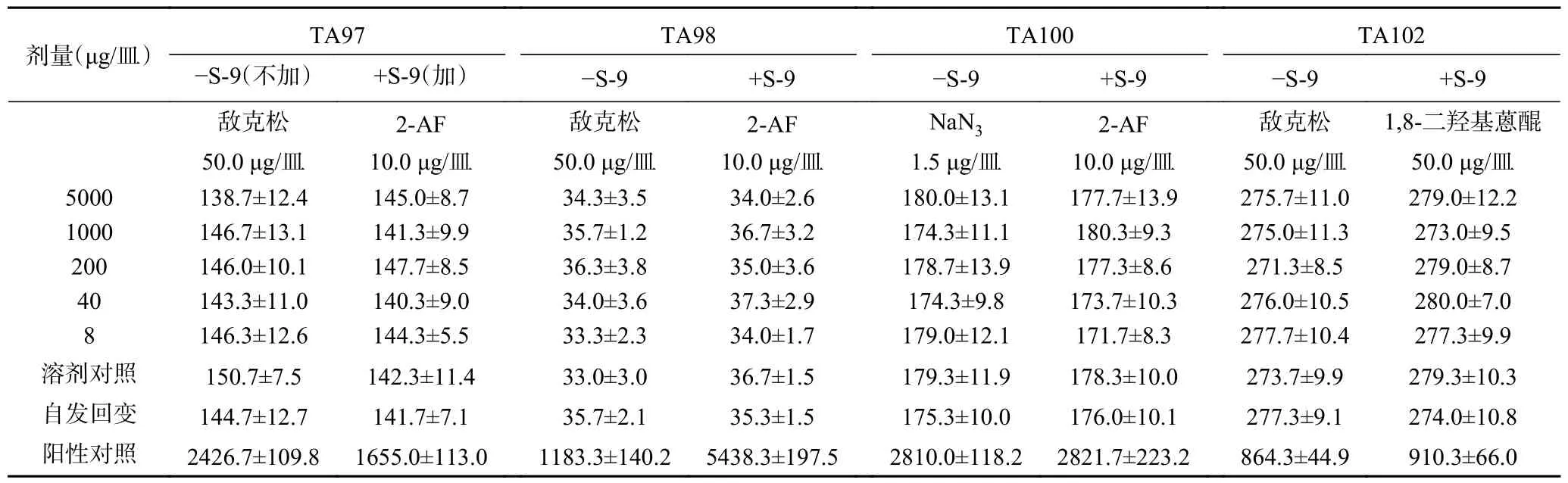
表4 复合益生菌粉Ames 试验结果(第1 次)Table 4 Ames test results of compound probiotic powder (first time)
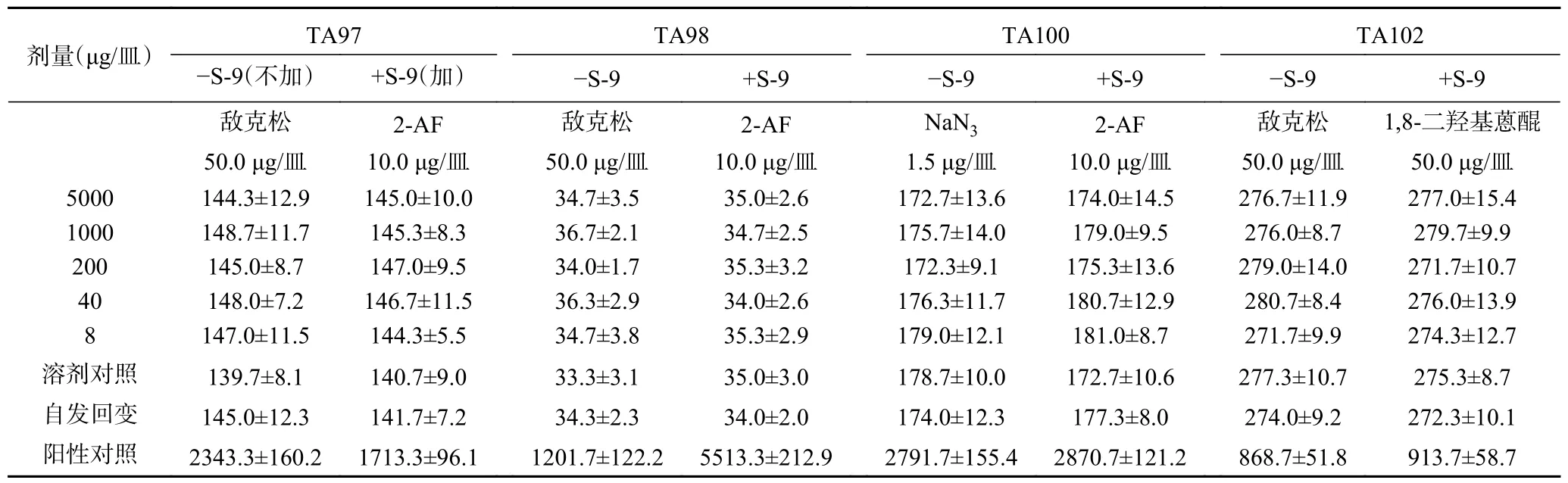
表5 复合益生菌粉Ames 试验结果(第2 次)Table 5 Ames test results of compound probiotic powder (second time)
2.8.2 小鼠骨髓细胞微核试验 复合益生菌粉各剂量组小鼠的骨髓细胞微核率与溶剂对照组比较,均无显著性差异(>0.05),而环磷酰胺阳性对照组的微核率与溶剂对照组比较,差异有极显著性(<0.01)。各剂量组的PCE/NCE 值均在正常值范围内,且各剂量组PCE 占细胞总数的比例均不少于溶剂对照组的20%,上述结果表明复合益生菌粉对小鼠骨髓细胞微核试验结果为阴性,如表6 所示。
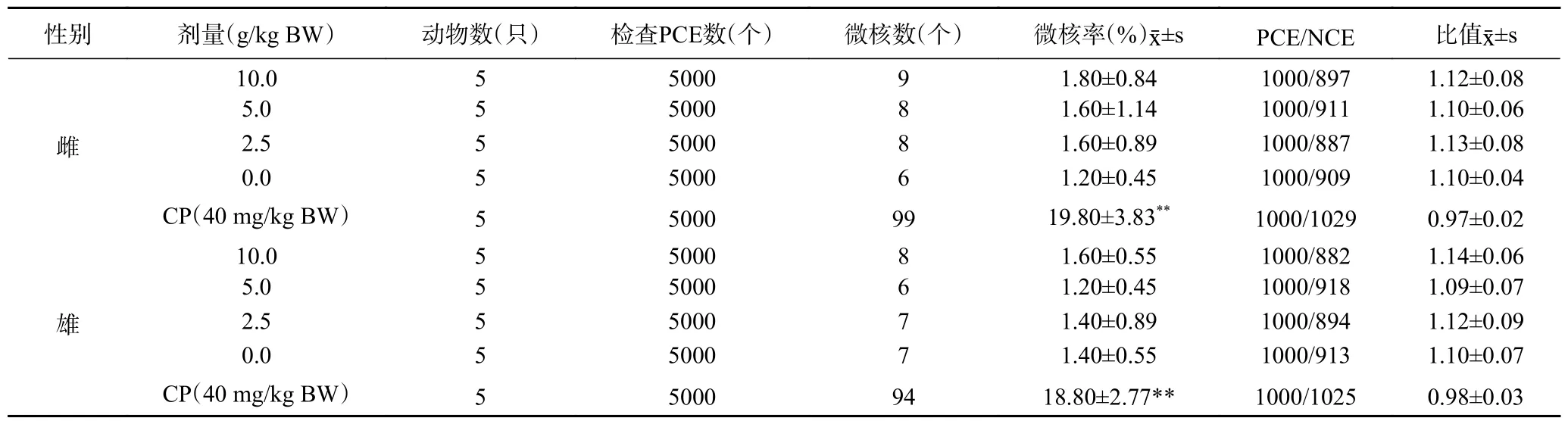
表6 复合益生菌粉对小鼠骨髓细胞微核试验结果Table 6 Results of the micronucleus test of compound probiotic powder on mouse bone marrow cells
2.8.3 小鼠精子畸形试验 由表7 可见,复合益生菌粉对小鼠精子畸形发生率未产生明显改变,各剂量组精子畸形率与溶剂对照组比较,差异均无显著性(>0.05),而环磷酰胺阳性对照组与溶剂对照组比较,差异有极显著性(<0.01)。精子畸形类型主要表现以无钩、香蕉形、无定形、胖头为主。上述结果表明该样品小鼠精子畸形试验结果为阴性。

表7 复合益生菌粉对小鼠精子畸形试验结果Table 7 Test results of compound probiotic powder on mouse sperm deformity
2.9 大鼠30 d 喂养试验
2.9.1 复合益生菌粉对大鼠体重的影响 由表8 可见,各剂量组雌雄大鼠的初始体重、每周末体重、总增重及空腹重分别与溶剂对照组比较,差异均无显著性(>0.05),说明实验浓度内,复合益生菌粉对大鼠体重无显著影响。

表8 复合益生菌粉对大鼠1~4 周体重及空腹重的影响Table 8 Effect of compound probiotic powder on the body weight and fasting weight of rats at 1~4 weeks
2.9.2 复合益生菌粉对大鼠每周进食量的影响 由表9 可见,各剂量组雌雄大鼠的每周进食量及总进食量分别与溶剂对照组比较,差异均无显著性(>0.05),说明实验浓度内,复合益生菌粉对大鼠进食量无显著影响。
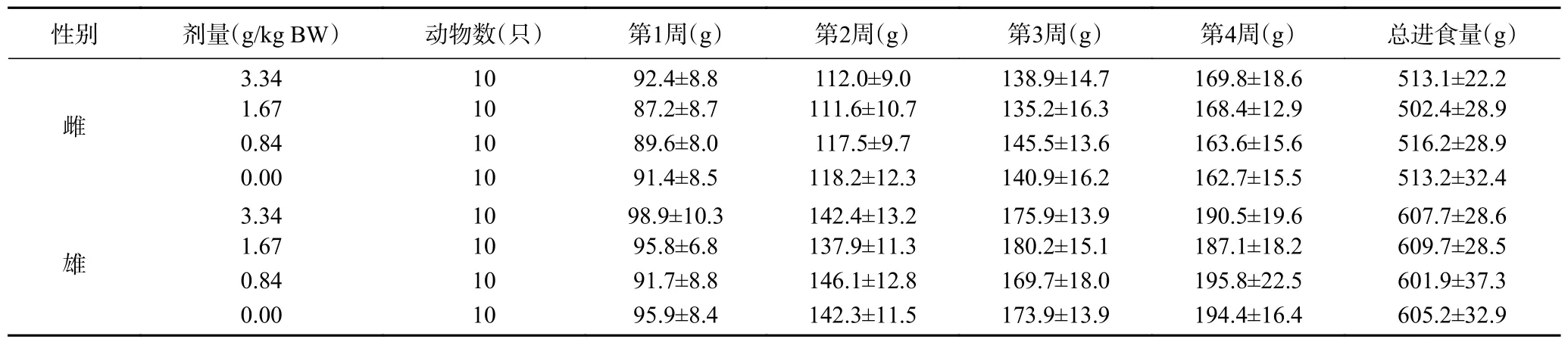
表9 复合益生菌粉对大鼠1~4 周总进食量的影响Table 9 Effect of compound probiotic powder on rats’ total food intake during 1~4 weeks
2.9.3 复合益生菌粉对大鼠食物利用率的影响 由表10 可见,各剂量组雌雄大鼠的每周食物利用率以及总食物利用率分别与溶剂对照组比较,差异均无显著性(>0.05),说明实验浓度内,复合益生菌粉对大鼠食物利用率无显著影响。

表10 复合益生菌粉对大鼠1~4 周食物利用率的影响Table 10 Effect of compound probiotic powder on the food utilization rate of rats in 1~4 weeks
2.9.4 复合益生菌粉对大鼠血常规指标的影响 由表11可见,各剂量组的末期血常规指标检测结果分别与溶剂对照组比较,差异均无显著性(>0.05),说明实验浓度内,复合益生菌粉对大鼠血常规指标无显著影响。

表11 复合益生菌粉对大鼠血常规指标的影响Table 11 Effect of compound probiotic powder on blood routine indexes of rats
2.9.5 复合益生菌粉对大鼠血液生化指标的影响由表12~表13 可见,各剂量组末期血液生化指标检测结果分别与溶剂对照组比较,差异均无显著性(>0.05),说明实验浓度内,复合益生菌粉对大鼠血液生化指标无显著影响。

表12 复合益生菌粉对大鼠血液生化指标的影响Table 12 Effect of compound probiotic powder on the blood biochemical indexes of rats
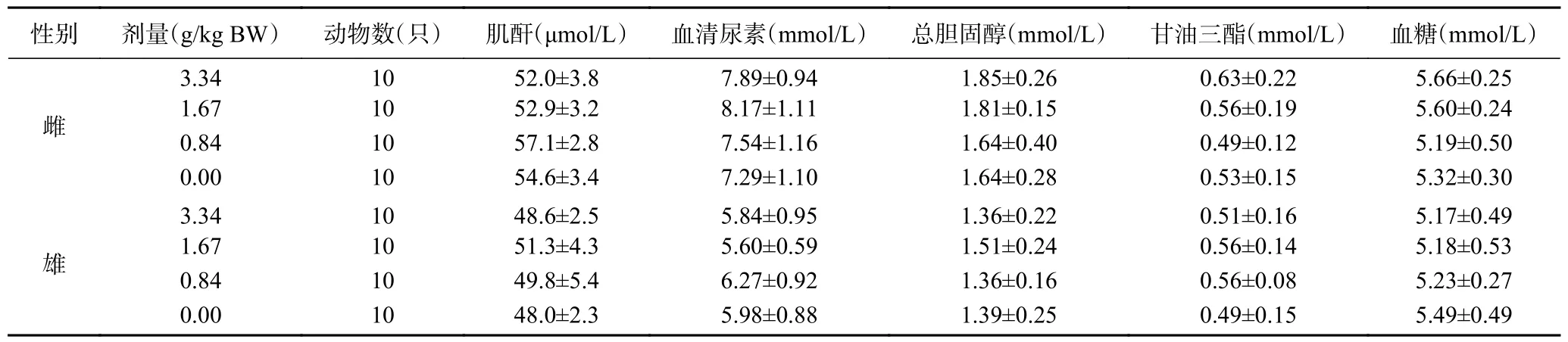
表13 复合益生菌粉对大鼠血液生化学指标的影响Table 13 Effect of compound probiotic powder on blood biochemical indexes of rats
2.9.6 复合益生菌粉对大鼠脏体比的影响 由表14可见,各剂量组雌雄大鼠的肝/体比值、脾/体比值、肾/体比值以及雄鼠的睾/体比值分别与溶剂对照组比较,差异均无显著性(>0.05),说明实验浓度内,复合益生菌粉对大鼠脏体比值无显著影响。
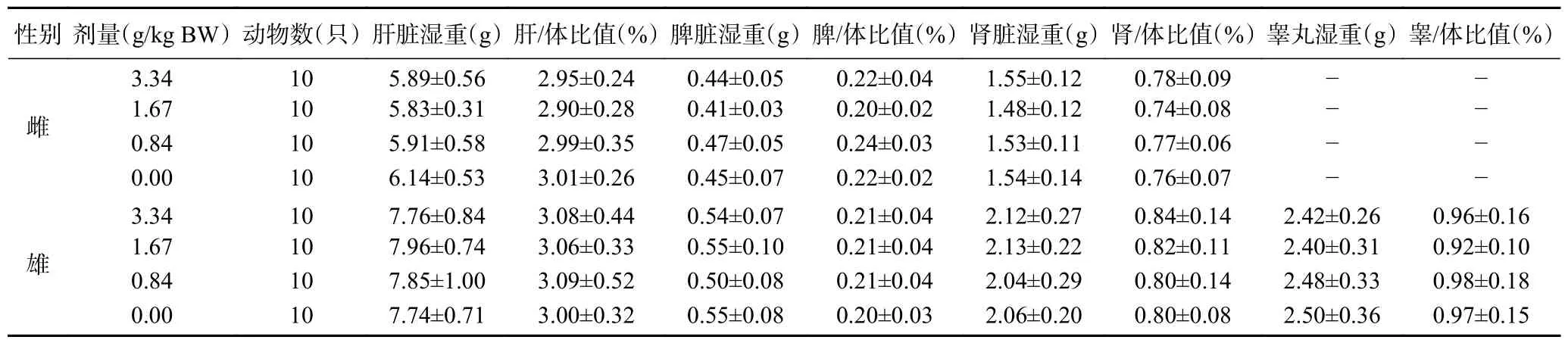
表14 复合益生菌粉对大鼠脏体比的影响Table 14 Effect of compound probiotic powder on rat’s viscera-to-body ratio
2.9.7 病理学 实验结束后乙醚麻醉,颈椎脱臼处死大鼠,检查包括肝脏、肾脏、脾脏、胃肠以睾丸和卵巢等组织。病理学检查结果显示:溶剂对照组雄性大鼠有2 例轻度肝小叶空泡变,其余组织均未见异常。以上组织病变属动物的自发轻型病变,未见样品高剂量组引起动物中毒性损伤改变。这进一步说明了复合益生菌的食用安全性。
3 结论
喂食高剂量以鼠李糖乳杆菌粉LGG、乳双歧杆菌Bi-07 以及低聚果糖等复配所制得的复合益生菌粉时可显著提高DTH、PFC、血清溶血素水平、小鼠碳廓清吞噬指数等指标(<0.05),证明复合益生菌粉可有效改善小鼠免疫能力。此外,雌雄大鼠对益生菌粉的最大耐受剂量(MTD)均大于20.0 g/kg BW,说明该菌粉属无毒级;小鼠骨髓细胞微核试验、小鼠精子畸形试验、Ames 试验三项结果均为阴性,说明该菌粉无遗传毒性;试验剂量在0.84~3.34 g/kg BW 范围内,大鼠的生长发育良好,各剂量组的动物体重、进食量、食物利用率、血液学指标、血液生化学指标、脏器湿重及脏器/体重比值与溶剂对照组比较,均无显著性差异(>0.05),证明复合益生菌具有很高的食用安全性。
喂食鼠李糖乳杆菌粉LGG、乳双歧杆菌Bi-07 的复合益生菌粉可以较好地增强小鼠机体免疫的能力,且食用安全性良好。因此,以鼠李糖乳杆菌粉LGG、乳双歧杆菌Bi-07 及低聚果糖等复配所制得的复合益生菌粉在保健食品方向具有良好的应用前景。
