高压酶解法提取硫酸皮肤素工艺优化及其抗氧化活性分析
2022-09-13王钰堡王语聪谢智鑫张俊杰李春雨谢宜桐王宇晴陈晓伟刘丹怡韩建春
王钰堡,王语聪,谢智鑫,张俊杰,李春雨,谢宜桐,王宇晴,陈晓伟,刘丹怡,韩建春,
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150028)
硫酸皮肤素(Dermatan sulfate,DS),又称硫酸肤质、硫酸软骨素B,是一种线状阴离子多糖,具有抗凝血、抗血栓、抗氧化、抗炎和抗肿瘤等生物活性,被广泛应用于医药行业中。传统方法常以动物皮层,特别是水生生物(如鮟鱇鱼皮)为提取原料,目前工业上主要从猪皮和猪小肠中提取。
DS 以蛋白聚糖形式存在于哺乳动物细胞基质和结缔组织中,在生物体内通过共价键与蛋白质结合,因此需选取适当的酶切断共价键以达成提取DS 目的。常使用木瓜蛋白酶、胰蛋白酶和Protamex复合蛋白酶等酶进行单酶或双酶复合水解,但均存在效率不高的问题,因此采用超高压技术通过施加一定压力使蛋白适当变性能够有效改善酶解效率。朱文慧等以鳕鱼骨为原料采用超高压耦合酶解工艺使酶解液氨基酸态氮含量提升1.68 倍。原料酶解后仍含有较多杂质,离子交换树脂法能有效对DS 分离纯化。大孔树脂是一种兼具筛选和吸附能力的高分子材料,具备操作简便、不改变多糖原有结构和生物活性等优点,是理想DS 吸附材料。付莹采用D208 大孔吸附树脂以从鸡软骨中提取到纯度达72.03%的DS。
在猪肠粘膜提取肝素过程中,吸附透过液常作为废弃物被丢弃,经检测每毫升透过液中仍含有较高浓度DS(4.62 ng/mL),从中提取纯化DS 既可以提高原料的利用率、降低污染,亦可增加产业价值。本文以猪肠粘膜提取肝素透过弃液为原料,采用高压酶解结合树脂吸附技术,通过单因素和响应面试验优化酶解工艺和树脂吸附纯化条件,对DS 与抗坏血酸(V)进行抗氧化活性比较,为DS 的提取及进一步研究应用提供实验基础。
1 材料与方法
1.1 材料与仪器
猪肠粘膜肝素提取透过液 江西时通实业有限公司;醋酸纤维素薄膜(8 cm×12 cm)腾辉化玻仪器;硫酸皮肤素标准品 北京普天同创生物科技公司;碱性蛋白酶(200 U/mg)、Protamex 复合蛋白酶(100 U/mg)、木瓜蛋白酶(100 U/mg)、透析袋(1000 D)北京索莱宝生物科技有限公司;D312 树脂、D208树脂、D958 树脂 新乡赛普瑞特有限公司;ELISA硫酸皮肤素酶联免疫试剂盒 上海梵态生物科技有限公司;无水乙醇、过氧化氢、1-二苯基-2-三硝基苯肼(DPPH 自由基)、醋酸、抗坏血酸、甲苯胺蓝 分析纯,Sigma 公司。
HL-300B 恒流泵 兰格恒流泵有限公司;HZSH 水浴振荡器 哈尔滨东联电子技术开发有限公司;层析柱(直连通用B 型,70 mL)无锡天演生物;XQ-FD-10N 冻干机 北京博医康实验仪器有限公司;TG-600 酶标仪 Thermo Fisher 科技公司;R-100 旋转蒸发仪 瑞士Buchi 有限公司;Power Pac HC 电泳仪 Bio-rad 生命医学有限公司;L-539 超微分子压缩仪 沈阳人和机电工程设备有限公司。
1.2 实验方法
1.2.1 原料处理 猪肠粘膜肝素提取透过液经冻干、粉碎,过60 目筛后得到冻干粉,−20 ℃保存。
1.2.2 蛋白酶的筛选 将碱性蛋白酶、Protamex 复合蛋白酶、木瓜蛋白酶在最适pH 和温度(表1)下向10 g 样品中以18000 U/g 酶底物比加酶水解8 h,结束后离心(8000 r/min,15 min)取上清以DS 浓度为标准选择最适酶。DS 浓度用试剂盒测定,DS 抗体在经过标准品、样品、检测抗体温育洗涤后,使底物显蓝色,再经酸的作用转化黄色。颜色深浅与样品中DS 浓度呈正相关,450 nm 测定吸光度并计算浓度。根据标准曲线计算多糖浓度,标准曲线回归方程为y=0.1613x+0.0259,y 代表吸光度值,x 代表DS 浓度(ng/mL),R=0.9977。
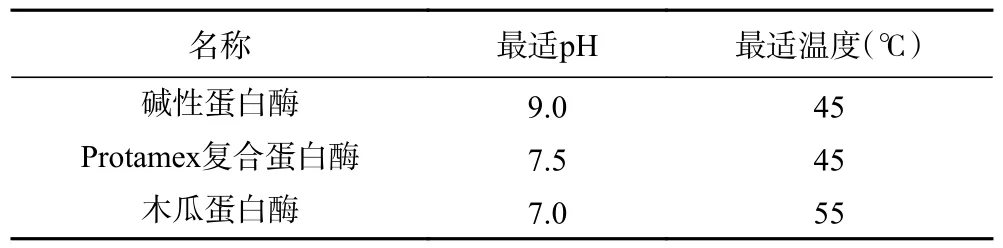
表1 不同蛋白酶最适pH 和温度Table 1 Optimal pH and temperature for different proteases
1.2.3 高压酶解工艺的单因素实验 参考徐俊涛的方法略作改动,进行温度、时间、pH 和压力单因素实验。
1.2.3.1 酶解时间的选择 以酶解液DS 浓度为指标,酶解温度45 ℃,pH9.0,酶添加量18000 U/g,压力100 MPa 为基本条件,探究不同时间(1、2、3、4、5、6、7、8、9 h)条件下酶解效果。
1.2.3.2 酶解温度的选择 以酶解液DS 浓度为指标,时间7 h,pH9.0,酶添加量18000 U/g,压力100 MPa为基本条件,设置不同温度(45、50、55、60 ℃)条件,探究酶解效果。
1.2.3.3 pH 的选择 以酶解液DS 浓度为指标,时间7 h,温度45 ℃,酶添加量18000 U/g,压力100 MPa为基本条件,探究不同pH(7.0、7.5、8.0、8.5、9.0、9.5)条件下酶解效果。
1.2.3.4 酶解压力的选择 以酶解液DS 浓度为指标,时间7 h,温度45 ℃,pH9.0,酶添加量18000 U/g为基本条件,使用超微分子压缩仪设置不同压力(0、50、100、150、200 MPa)条件,探究酶解效果。
1.2.4 响应面试验 综合单因素的实验结果,选择软件Design-Expert 利用Box-Behnken 法设计四因素三水平实验,因素水平见表2。响应面结束后以所得最佳条件进行酶解,升温至85 ℃灭活后,过100 目筛除杂后4000 r/min 离心20 min,取上清即粗多糖溶液。
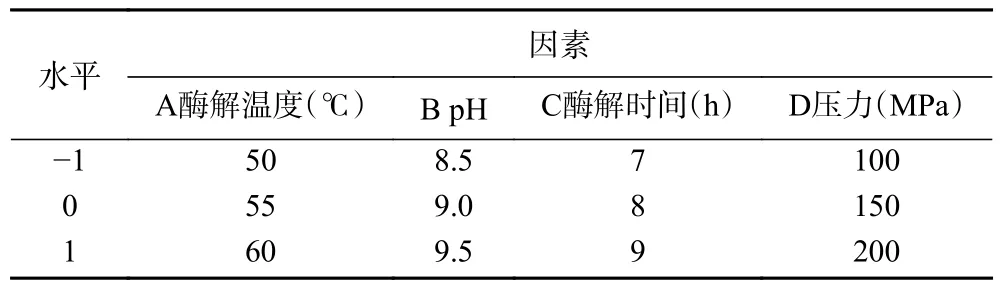
表2 响应面设计因素及水平Table 2 Response surface design factors and levels
1.2.5 大孔树脂筛选 树脂预处理:以去离子水充分浸泡树脂,依次用4% HCl、4% NaOH 溶液交替搅拌3 h,去离子水冲洗至中性后浸泡4 ℃保存备用。
称取15 g 经预处理的D208、D312、D958 树脂,分别装入具塞三角瓶中,每瓶加入125 mL 粗多糖溶液,置于55 ℃恒温振荡器中100 r/min 振荡吸附过夜,以吸附量为标准选择最佳树脂。根据式(1)计算DS 吸附量。

注:t:吸附前溶液DS 浓度(ng/mL);t:吸附后溶液DS 浓度(ng/mL);V:溶液体积(mL)。
1.2.6 树脂吸附纯化工艺优化
1.2.6.1 吸附流速优化 称取30 g 经预处理树脂以湿法装柱,去离子水平衡。粗多糖溶液在55 ℃条件下分别以1.0、1.5、2.0、2.5 BV/h 上样,20 mL/管取样并测定DS 浓度,吸附量达到饱和值时停止吸附,绘制吸附曲线并确定最优流速。
1.2.6.2 洗脱流速优化 树脂处理同1.2.6.1,粗多糖溶液以1.2.6.1 所得最优流速上样至树脂饱和,用4% NaOH 分别以1.0、1.5、2.0、2.5 BV/h 进行洗脱,20 mL/管取样并测定DS 浓度,当浓度稳定后停止洗脱,绘制洗脱曲线。
1.2.6.3 透析脱盐 参考薛发刚的方法,洗脱液透析4 d,每隔6 h 换一次水,透析后加入3 倍体积的无水乙醇,4 ℃过夜后离心,将沉淀冻干后得到DS 称重。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH 自由基清除能力测定 试验参考Nevin 等方法。将DS 配制成浓度分别为0.4、0.8、1.2、1.6、2.0、2.4 mg/mL 的溶液,依次加入DPPH 试剂,混匀后室温避光反应30 min,于517 nm 处测得OD 值为A;以蒸馏水代替样品测得OD 值为A;无水乙醇代替DPPH 测得OD 值为A。根据式(2)计算DPPH 清除率。
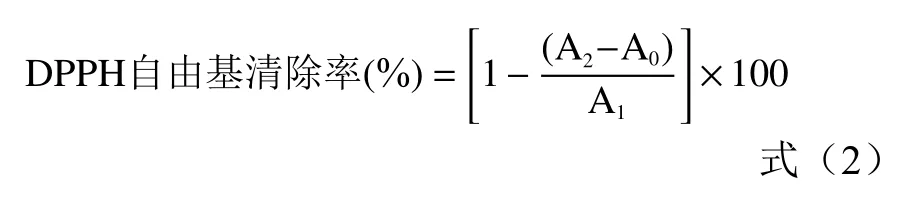
1.2.7.2 羟基自由基清除率测定 参考李珊珊等方法,将DS 配制成浓度为0.4、0.8、1.2、1.6、2.0、2.4 mg/mL 的溶液,分别加入6 mmol/L FeSO溶液、10%双氧水,摇匀后加入6 mmol/L 水杨酸乙醇,37 ℃反应30 min,于510 nm 测定OD 值为A;以蒸馏水代替双氧水OD 值为A;以蒸馏水代替样品OD 值为A。根据式(3)计算羟基自由基清除率。

1.2.7.3 还原力测定 参考Oyaizu方法,将DS 配制成浓度分别为0.4、0.8、1.2、1.6、2.0、2.4 mg/mL的溶液。取样品溶液0.5 mL 加入磷酸缓冲液0.5 mL及KFe(CN)2.5 mL 混匀,50 ℃水浴20 min,加入0.5 mL 三氯乙酸,混匀后4000 r/min离心20 min取上清,加入蒸馏水和0.1% FeCl溶液,静置10 min于700 nm 测OD 值为A;以蒸馏水代替上清OD值为A,根据式(4)计算还原力。

1.2.8 醋酸纤维素薄膜电泳分析 采用醋酸纤维薄膜电泳对得到DS 进行分析,使用0.1 mol/L 醋酸钡缓冲液,在100 V、4 mA 的条件下电泳3 h 后用0.1%甲苯胺蓝溶液染色0.5 h,2%醋酸溶液脱色 0.5 h。
1.2.9 纯度测定 DS 纯度测定采用高效凝胶渗透色谱法。以DS 标品为对照,色谱柱为Ultrahydrogel Linear(7.8 mm×300 mm),流动相为超纯水,柱温30 ℃,流速1.2 mL/min,进样量20 μL。
1.3 数据处理
实验均平行重复三次,数据统计采用Origin 2019 进行数据处理拟合绘图,SPSS 20 进行显著性分析,<0.05 和<0.01 分别指差异显著及极显著,响应曲面试验用Design-Expert 软件进行设计和结果统计分析。
2 结果与分析
2.1 蛋白酶的筛选
由表3 可知,碱性蛋白酶酶解后溶液中的DS 浓度显著高于Protamex 复合蛋白酶和木瓜蛋白酶(<0.05),效果最佳,后续实验采用碱性蛋白酶。蛋白酶具有专一性,不同酶的酶切位点不同,对酶解效果具有重要影响,选择合适作用位点的酶进行酶解至关重要。

表3 三种酶酶解效果的影响Table 3 Effects of different enzymes on enzymatic hydrolysis
2.2 酶解条件实验
由图1a 可知,溶液DS 浓度在1~6 h 时平缓上升,7~8 h 之间显著(<0.05)上升,8 h 后浓度趋于稳定。可能是超高压酶解时,机器封闭,原料自然沉积底部接触面积较小导致前期酶解效率不高,故选择8 h 为响应面0 水平。
由图1b 可知,溶液中DS 浓度随温度升高先上升后下降,55 ℃时浓度达到最大值(7.61±0.31)ng/mL,当温度继续升高,可能影响了蛋白酶活性导致水解能力下降,DS 浓度反而下降。故选择55 ℃为响应面0 水平。
由图1c 可知,溶液中DS 浓度随pH 升高逐渐增加,pH9.0 时达到最大值,随后呈下降趋势,原因可能是过酸或过碱条件导致酶催化能力降低。故选择pH9.0 为响应面0 水平。
由图1d 可知,压力从0.1~200 MPa 的过程中,DS 浓度先增后减,在150 MPa 时浓度最高,为(8.17±0.23)ng/mL,说明适度的压力可以激活酶活力中心。故选择150 MPa 为响应面0 水平。

图1 不同因素对酶解效果的影响Fig.1 Influence of different factors on the effect of enzymolysis
2.3 响应面试验结果
2.3.1 试验设计与结果 响应面试验设计及结果如表4 所示。对结果进行方差分析,对数据进行回归拟合,得到响应曲面回归方程如下:

表4 响应曲面试验设计及结果Table 4 Design and experimental results of response surface methodology
Y=12.71+0.6233A−0.9892B+1.01C−0.8242D−0.1AB+0.34AC+0.045AD−0.795BC−0.7575BD−0.34CD−1.69A−3.69B−1.87C−1.31D
如表5 可见:该模型整体(<0.0001)极显著,失拟项(=0.1589>0.05)不显著,说明模型可以真实反应试验,残差来源于随机误差。根据回归方程均方可知,各因素对响应值的影响力排序为:酶解时间(C)>pH(B)>压力(D)>酶解温度(A)。复相关系数R=0.90,表明响应值(DS 浓度)变化有90%来自于试验因素(温度、pH、时间、压力),可以较好解释各因素与响应值之间关系。因此,该模型拟合度良好,利用该回归方程可以对高压酶解效果进行分析预测。

表5 方差分析结果Table 5 ANOVA results
图2 可直观表示出当某因素被固定为中心点水平时,其他因素交互作用对响应值影响,曲面弯曲程度越大,因素交互作用越强,因素之间相关影响程度也就越大。

图2 模型中显著相关因素交互响应面图Fig.2 Interaction response surface plot of significant correlation factors in the model
2.3.2 工艺优化与结果验证 结合响应面进行优化分析,以响应值最大为评价指标,得到最佳工艺条件为温度56.1℃,pH8.9,时间8.35 h,压力134.3 MPa,在此条件下DS 浓度预测值为13.15 ng/mL。考虑实际可行性,调整工艺条件为温度56 ℃,pH9.0,时间8.4 h,压力135 MPa。经平行实验验证,DS 浓度实际值为13.05 ng/mL,误差为0.1 ng/mL,与预测值接近,说明本模型具有可行性。
2.4 大孔树脂筛选
表6 对比三种不同型号树脂吸附前后溶液中DS 浓度变化,D312 树脂吸附效果显著高于其余两种树脂(<0.05)。树脂的吸附性能取决于树脂功能基与空间结构,一般非极性化合物易被非极性树脂吸附,极性树脂可以吸附极性物质。DS 作为具有一定极性的聚阴离子化合物,阴离子交换树脂D312 是其纯化最佳树脂。本实验选用D312 树脂进行后续实验。
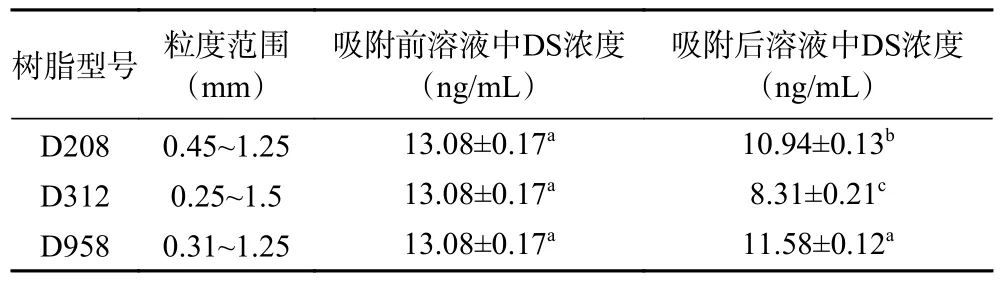
表6 树脂静态吸附结果Table 6 Result of resin static adsorption
2.5 动态吸附实验
2.5.1 上样流速优化 图3 为D312 树脂在不同上样流速下穿透液中DS 浓度变化曲线。随着体积的增加,不同流速的DS 浓度均升高,表明树脂的吸附能力下降。由图可见,2.5 BV/h 相比于其他三种流速DS 浓度上升最快,于120 mL 最先到达平衡点,与横坐标所截面积最大,说明穿透溶液中DS 浓度高;1.0 BV/h 流速最晚到达稳定点,穿透溶液中DS 浓度低。原因是流速快,导致DS 与树脂接触不充分,吸附效果差;相反,流速越慢吸附效果越好,但时间成本高。考虑到吸附量与所需时间,1.5 BV/h与横坐标截面较2.0 BV/h 更小,即吸附量较大,效果更优,故采用1.5 BV/h 流速进行树脂吸附。

图3 不同上样流速动态吸附曲线Fig.3 Dynamic adsorption curves for different sample flow rates
2.5.2 洗脱流速优化 图4 为4% NaOH 洗脱时不同流速穿透液中DS 浓度变化曲线。解吸流速为2.0 和2.5 BV/h 时,于20 mL 时出现峰值,而后洗脱液中DS 浓度持续下降,100 mL 后趋于稳定,但拖尾较长;解析流速为1.0 和1.5 BV/h,峰值出现早,洗脱液中DS 浓度随解析进行持续下降,于120 和160 mL时趋于稳定,无拖尾。这是因为流速过快,树脂与洗脱液的接触不充分,DS 还未被完全解吸下来,导致拖尾现象严重,造成材料的浪费;反之,流速过慢所需时间长,不利于生产。综合考虑时间成本,以1.5 BV/h洗脱流速最为合适。

图4 不同流速洗脱液的动态洗脱曲线Fig.4 Dynamic elution curves of eluents at different flow rates
2.6 抗氧化能力的测定
2.6.1 DPPH 自由基清除能力 由图5 可知,在测定浓度范围内,DS 对DPPH 自由基清除能力随浓度增长而加强,呈浓度依赖性。在2.0 mg/mL 时DPPH自由基清除率为35.17%,当浓度达2.4 mg/mL 时清除率为36.29%,DPPH 自由基清除率增加趋势变缓,与阳性对照V相比,清除能力可达V的43.5%。可见DS 具有一定的抑制DPPH 自由基能力。

图5 DPPH 自由基清除率Fig.5 DPPH·scavenging activity
2.6.2 羟自由基清除能力 通过清除氧自由基中最活跃的·OH,从而减少有色物质的生成,以510 nm处OD 值为评价标准定量样品对·OH 的清除能力。图6 表明,不同浓度DS 与V对羟自由基均具有较好抑制率,且随浓度增加而增大。当浓度在1.5、2.0 mg/mL 时,DS 的羟自由基清除率达63.7%、67.13%,均高于V,可见DS 具有抑制羟自由基的能力。

图6 DS 对羟自由基的清除能力Fig.6 Hydroxy free radical scavenging activity of DS
2.6.3 还原力测定 抗氧化剂的还原力是通过自身氧化给出电子清除自由基实现,DS 还原力分析如图7 所示,不同浓度DS 还原力不同,随浓度升高还原力逐渐增加呈缓慢递增趋势,在DS 浓度由0.4 mg/mL 升至2.5 mg/mL 时,还原力由0.11 升至0.22,低浓度DS 还原力较低,随浓度升高仍明显弱于阳性对照V,说明其还原力较弱。

图7 DS 的还原能力Fig.7 Reducing power of DS
2.7 醋酸纤维薄膜电泳结果
纯化后得到DS 多糖,进行醋酸纤维素薄膜电泳实验分析结果如图8 所示,样品电泳后得到单一条带,且两者迁移距离和形状类似,说明纯化后DS 多糖样品与标准品组分接近,达到了电泳纯,但无法测定具体纯度。

图8 DS 样品和标准品的醋酸纤维薄膜电泳结果Fig.8 Cellulose acetate membrane electrophoresis results of dermatan sulfate samples and standards
2.8 色谱分析
通过高效凝胶渗透色谱分析纯化后DS 纯度为73.32%,相较付莹采用D218 树脂提取纯度提升1.29%。由图9 可知,在时间为3.7 和5.725 min时出现杂质峰,表明样品中含有其他分子量物质,这可能是硫酸软骨素和透明质酸钠。

图9 DS 高效液相色谱图Fig.9 HPLC chromatogram of DS
3 结论
本实验采用高压酶解结合树脂吸附技术提取DS,通过单因素和响应面试验优化最佳酶解工艺和树脂吸附条件,探讨了抗氧化活性。结果表明:在温度56 ℃,pH9.0,压力135 MPa 处理8.4 h 最优条件下,DS 浓度达到13.05 ng/mL;使用D312 树脂以1.5 BV/h 流速上样,4% NaOH 以1.5 BV/h 流速洗脱条件下得到DS 纯度可达73.32%;此外抗氧化试验表明,DS 多糖还原力较弱,对DPPH 自由基、羟基自由基具有清除能力,具备一定抗氧化活性。高压酶解结合树脂吸附工艺不仅提高了酶解效果,还提升了纯度。纯化后DS 色谱存在杂质峰,电泳方法不能鉴定,后续需进一步探究高纯度DS 纯化方法和其他成分结构鉴定方法,为DS 产品开发利用提供理论参考与数据支撑。
