油茶粕膳食纤维的超声辅助酶法提取工艺优化及理化性质分析
2022-09-13宋伟闫建英薛红洋
张 智,宋伟,闫建英,薛红洋
(东北林业大学林学院,黑龙江哈尔滨 150040)
膳食纤维(Dietary Fiber,DF)作为第七大营养素,有着突出的应用前景。IDF 在自然界中的占比为90%以上,而SDF 的生理特性要优于IDF,SDF含量在10%以上更好。油茶()广泛分布于亚洲热带和亚热带地区,是世界四大木本油料树种之一。油茶粕(meal)为油茶籽制油后的副产物,营养价值高,然而由于开发强度不足而造成了资源浪费。从油茶粕中提取膳食纤维,不仅提高了油茶粕的附加价值,带来经济效益,还可以避免资源浪费和环境污染。
目前提高SDF 含量的方法主要有物理法、化学法和生物法。李怡杰等使用微波法提取油茶粕SDF 的得率为12.55%,低于卢忠英等用微波辅助酶法提取SDF 的得率,陈晓媛用突变菌株发酵提取油茶粕SDF 得率为3.81%,持水力和膨胀力分别为2.50 g/g 和0.88 mL/g,均低于李怡杰等提取得到的IDF。马力等提取得到的油茶粕膳食纤维溶胀性与持水力最高,但都未对提取的油茶粕膳食纤维理化性质及结构表征进行综合分析。
酶法提取DF 条件温和环保,纤维素酶可降低DF 分子量,增加SDF 含量。超声波处理操作简单,可破坏多糖的化学键,影响聚合物的形态和结构,使组织疏松,活性成分更好的溶解。在适当的条件下使用超声波处理可提高酶的活性,研究发现在17.33 W/cm的超声条件下处理30 min 后,纤维素酶活性比原来提高约25%。本实验采用超声辅助酶法对油茶粕进行处理来提高SDF 得率,并对其提取工艺进行优化,获得高品质膳食纤维,之后对TDF 的理化性质及结构表征进行综合分析。本实验酶用量少,提取时间较短,可减少经济与时间成本,为油茶粕的综合利用提供理论依据。
1 材料与方法
1.1 材料与仪器
油茶粕 重庆秀山提供(由实验室经脱茶皂素处理);纤维素酶(1×10U/g)和氏璧生物科技有限公司;碱性蛋白酶(200 U/mg)、葡萄糖、胆固醇标准品、-淀粉酶(150 U/mg)上海源叶生物科技有限公司;其它试剂均为国产分析纯;石油醚(沸程为30~60 ℃)天津市富宇精细化工有限公司。
KQ-300DE 型数控超声波清洗器 昆山市超声仪器有限公司;JSM-7500F 扫描电镜 日本JEOL公司;Spectrum 400 傅里叶红外光谱 美国Thermo Nicolet 公司;Zetapals 激光粒度仪 美国布鲁克海文仪器有限公司;UV-5500PC 型紫外可见分光光度计 上海元析仪器有限公司;SJ-3F 型pH 计 上海圣科仪器设备有限公司;HY-200 标准筛(60 目)北京祥宇伟业仪器设备有限公司;JA2003 分析天平上海良平仪器仪表有限公司;RE-52 旋转蒸发器 上海亚荣生化仪器公司;RT-6000 型酶标仪 深圳雷杜生命科学有限公司。
1.2 实验方法
1.2.1 原料预处理 将油茶籽粕脱脂(浸泡于石油醚中24 h)并蒸干溶剂,脱蛋白(料液比1:10 g/mL;碱性蛋白酶1.0 %;pH9;1.5 h;60 ℃)脱淀粉(-淀粉酶1.0%;pH6;1.5 h;60 ℃),浓缩后加入四倍95%乙醇醇沉2 h 抽滤,将预处理后得到的固体烘干粉碎并过60 目筛,储存在干燥器中备用。
1.2.2 膳食纤维制备工艺 将一定比例的纤维素酶加入经过预处理后的油茶粕粉,用蒸馏水调节超声酶解料液比,选择适宜的酶解条件进行超声酶解处理。处理一段时间后高温灭酶并离心,上清液加入4 倍体积的乙醇醇沉2 h 过滤干燥可得SDF,沉淀用乙醇和丙酮洗涤并干燥可得IDF,两者混合则为TDF。
1.2.3 单因素实验
1.2.3.1 酶添加量的影响 在pH5.5、温度55 ℃、超声时间30 min、超声功率240 W、料液比1∶25 g/mL的条件下探究不同酶添加量(0.1%、0.2%、0.3%、0.4%、0.5%)对SDF 得率的影响。
1.2.3.2 超声时间的影响 确定酶添加量为0.2%,其他条件同上,探究不同超声时间(10、20、30、40、50 min)对SDF 得率的影响。
1.2.3.3 超声功率的影响 确定酶添加量为0.2%,超声时间为30 min,其他条件同上,探究不同超声功率(150、180、210、240、270 W)对SDF 得率的影响。
1.2.3.4 料液比的影响 确定酶添加量为0.2%,超声时间为30 min,超声功率为210 W,其他条件同上,探究不同料液比(1:15、1:20、1:25、1:30、1:35 g/mL)对SDF 得率的影响。
1.2.4 响应面试验 以酶添加量(A)、超声时间(B)、超声功率(C)、料液比(D)四个因素,SDF 得率为响应值进行响应面试验,采用 Design Expert 2018 软件建立四因素三水平试验,因素水平如表1所示。
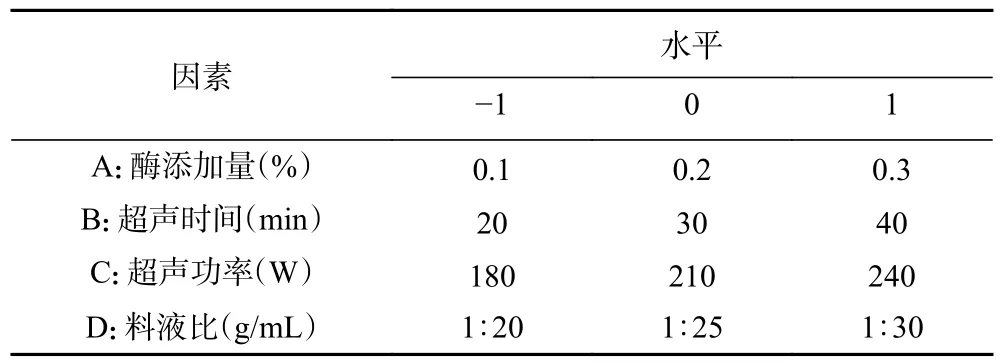
表1 响应面条件优化试验因素水平Table 1 Response surface condition optimization test factor level
1.2.5 得率测定
1.2.5.1 SDF 得率计算
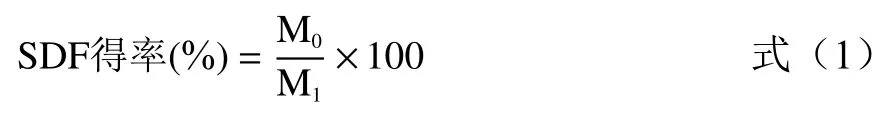
式中:M表示SDF 干重,g;M表示样品干重,g。
1.2.5.2 IDF 得率计算
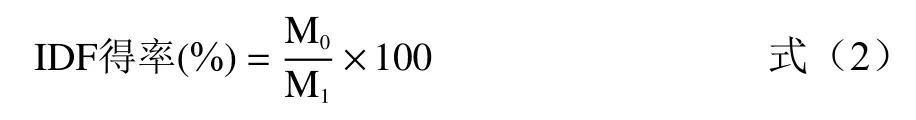
式中:M表示IDF 干重,g;M表示样品干重,g。
1.2.6 理化性质测定
1.2.6.1 持水力测定 按料液比1:25 g/mL 将TDF样品与水加入离心管中,37 ℃搅拌1h 后于4000 r/min的条件下离心15 min,弃上清液并将离心管壁上多余水分吸干后称量其重量。

式中:WHC 表示持水力,g/g;M表示吸水后样品及离心管质量,g;M表示离心管质量,g;M表示样品质量,g。
1.2.6.2 持油力测定 按TDF 样品质量与油的体积1:25 的比例加入离心管中,37 ℃搅拌1 h 后于4000 r/min 的条件下离心15 min,弃上层油后用吸干管壁多余油后称重。

式中:OHC 表示持油力,g/g;M表示吸油后样品及离心管质量,g;M表示离心管质量,g;M表示样品质量,g。
1.2.6.3 膨胀力测定 将0.40 g TDF 样品加入10 mL量筒中并记录干样体积,在量筒中加入8 mL 蒸馏水并搅拌均匀,于室温条件下静置24 h,记录膨胀后的体积。

式中:SC 表示持油力,mL/g;V表示膳食纤维干样体积,mL;V表示膳食纤维膨胀后体积,mL;M 表示样品质量,g。
1.2.6.4 胆固醇吸附率测定 参照文献[14]中的方法绘制胆固醇标准曲线。取市售鸡蛋蛋黄加九倍体积去离子水后混合均匀,在离心管中加入50 mg 的TDF 及15 mL 蛋黄液,使用NaOH 和HCl 溶液将pH分别调至2.0 及7.0 来分别模拟胃和肠道环境,37 ℃搅拌2 h 后 4000 r/min 离心20 min,取上清液检测并计算胆固醇含量,实验做空白对照,按式(6)计算胆固醇吸附率。

式中:A表示膳食纤维吸附后胆固醇含量,mg;A表示膳食纤维吸附前胆固醇含量,mg;M 表示样品质量,g。
1.2.6.5 葡萄糖吸附率测定 用DNS 法制备葡萄糖标准曲线,配制浓度为0.1 mmol/mL,pH 为7 的葡萄糖溶液,取0.10 g TDF 样品加入10 mL 葡萄糖溶液中,37 ℃搅拌6 h,此后在4000 r/min 的条件下离心20 min,取上清液按标准曲线的方法检测并计算葡萄糖溶液浓度,实验做空白对照,按式(7)计算葡萄糖吸附率。
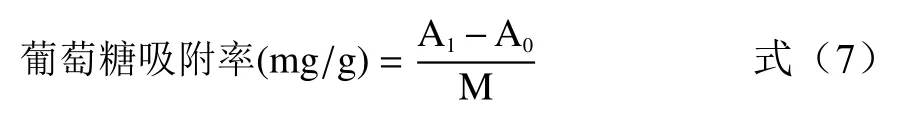
式中:A表示膳食纤维吸附后葡萄糖含量,mg;A表示膳食纤维吸附前葡萄糖含量,mg;M 表示样品质量,g。
1.2.7 结构表征分析
1.2.7.1 红外光谱(FT-IR)的测定 参考文献[15]的方法略作修改,按干燥膳食纤维样品与溴化钾粉末1:100 的比例充分研磨并进行红外光谱扫描,扫描波数400~4000 cm,扫描分辨率4 cm。
1.2.7.2 显微结构分析 将膳食纤维粉处理后进行电镜观察,放大100、500 与1000 倍,拍照得到电镜图并进行分析。
1.2.7.3 粒径测定 参考文献[17]的方法略作修改,将样品与水 1:20 使用超声混匀,并用激光粒度仪对油茶粕膳食纤维的粒径分布情况进行测定。
1.3 数据处理
所有实验数据均平行测定3 次,基础数据采用Excel 处理,响应面试验由Design Expert8.0.6 进行设计分析,作图采用Origin2018 软件。
2 结果与分析
2.1 单因素实验结果
2.1.1 纤维素酶添加量对SDF 得率的影响 由图1可知,随酶添加量的增加,SDF 的得率呈先增加后减小的趋势,在酶添加量为0.2%时所得的SDF 达到最高。这是因为纤维素酶可将IDF 水解,因此部分IDF 转化为SDF,SDF 得率增加,而酶用量过高时酶达到饱和,SDF 可能会被水解为小分子多糖、低聚糖等物质,这些物质不能被乙醇沉淀,从而引起SDF 的得率下降。因此确定0.2%为纤维素酶最佳添加量。

图1 酶添加量对SDF 得率的影响Fig.1 Effect of enzyme addition amount on SDF yield
2.1.2 超声时间对SDF 得率的影响 由图2 可知,超声时间在10~30 min 期间SDF 得率随时间的增加而增大,超过30 min 后SDF 的得率开始迅速降低。这是因为超声波的机械震动可加快其内部分子运动,提高了酶解效率,当时间超过30 min 后膳食纤维的结构可能遭到破坏,纤维素酶活性也随着时间的增加及超声导致的升温而降低,故确定超声酶解的最适时间为30 min。

图2 超声时间对SDF 得率的影响Fig.2 Effect of ultrasonic time on SDF yield
2.1.3 超声功率对SDF 得率的影响 由图3 可知,超声功率在150~210 W 范围内,SDF 的得率随超声功率的增大而增大,到210 W 时达到最高值,此后开始有所下降。超声可能会破坏细胞结构,随着超声功率增大,超声波的机械效应与空化效应也会增强,IDF 中的化学键断裂形成小分子物质,超声功率过大时可能会引起纤维素酶活性的降低,破坏膳食纤维结构;超声导致升温,超声功率大,温度上升快,因此SDF 得率迅速下降。综合考虑最适超声功率为210 W。

图3 超声功率对SDF 得率的影响Fig.3 Effect of ultrasonic power on SDF yield
2.1.4 料液比对SDF 得率的影响 由图4 可知,当料液比为1:25 g/mL 时SDF 得率达到最高值,当溶剂较少时,原料在溶液中得率较高,酶与底物不能充分接触,SDF 溶出受限。当溶剂升高,原料也在溶液中充分扩散,酶与底物接触充分,因此SDF 得率会有所升高。当溶剂过多时,酶浓度降低,此时SDF 的得率也会降低。因此可得出最佳料液比为1:25 g/mL。

图4 料液比对SDF 得率的影响Fig.4 Effect of solid-liquid ratio on SDF yield
2.2 响应面优化试验
在单因素实验结果的基础上进行响应面优化试验,以SDF 得率(Y)为响应值,考察酶添加量(A)、超声酶解时间(B)、超声功率(C)、料液比(D)4 个因素对SDF 得率的影响,试验方案及结果如表2 所示。
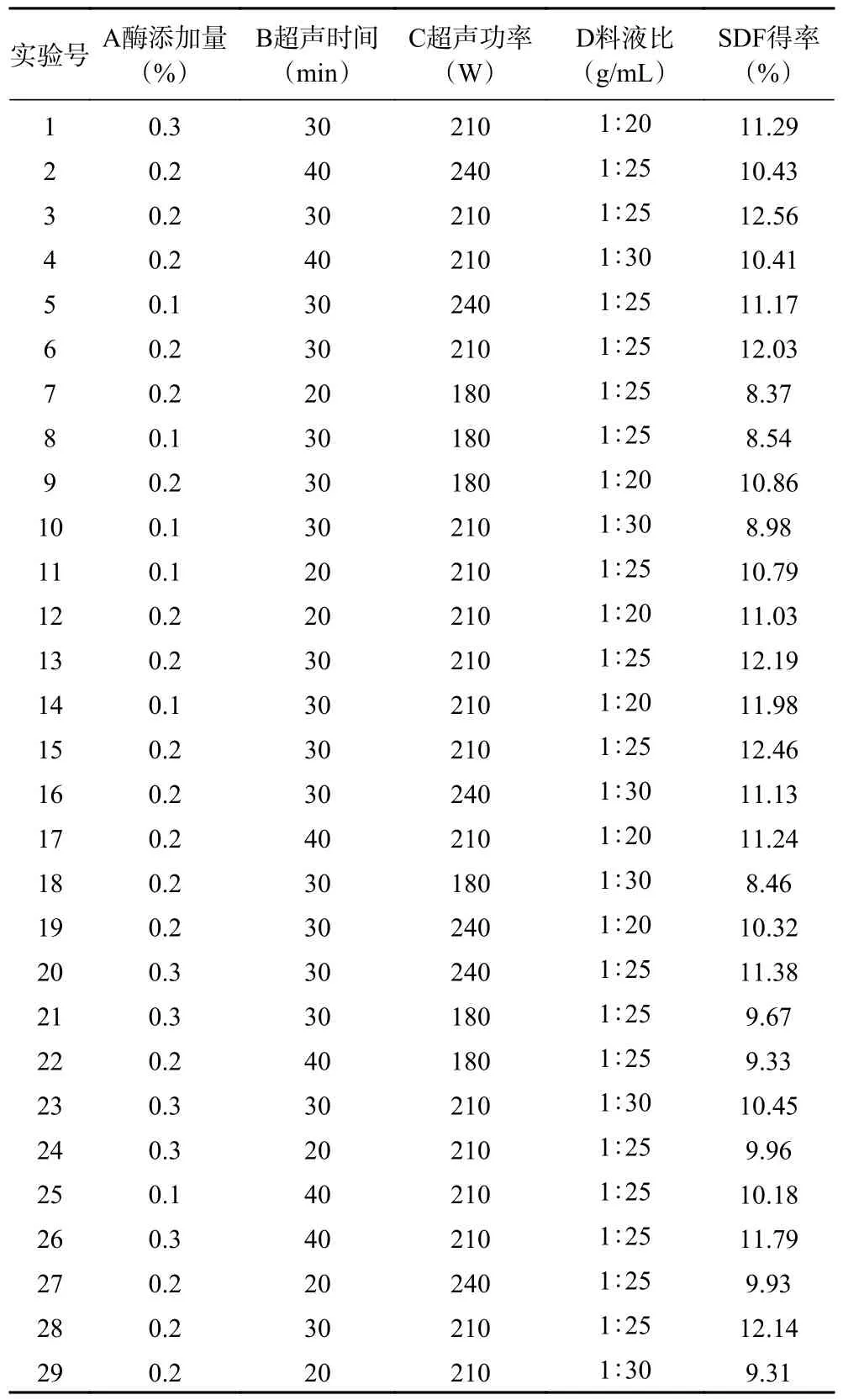
表2 中心组合试验设计方案及结果Table 2 Central combination experiment design scheme and results
2.2.1 响应面试验设计及结果 由表3 可知,该回归模型<0.0001,说明此模型回归效果达到极显著,失拟项=0.1093>0.05 不显著,=0.9505 线性关系较好,能够反应酶添加量、超声酶解时间、超声功率、料液比对SDF 得率的影响,可用于确定其最佳工艺。其回归方程为:
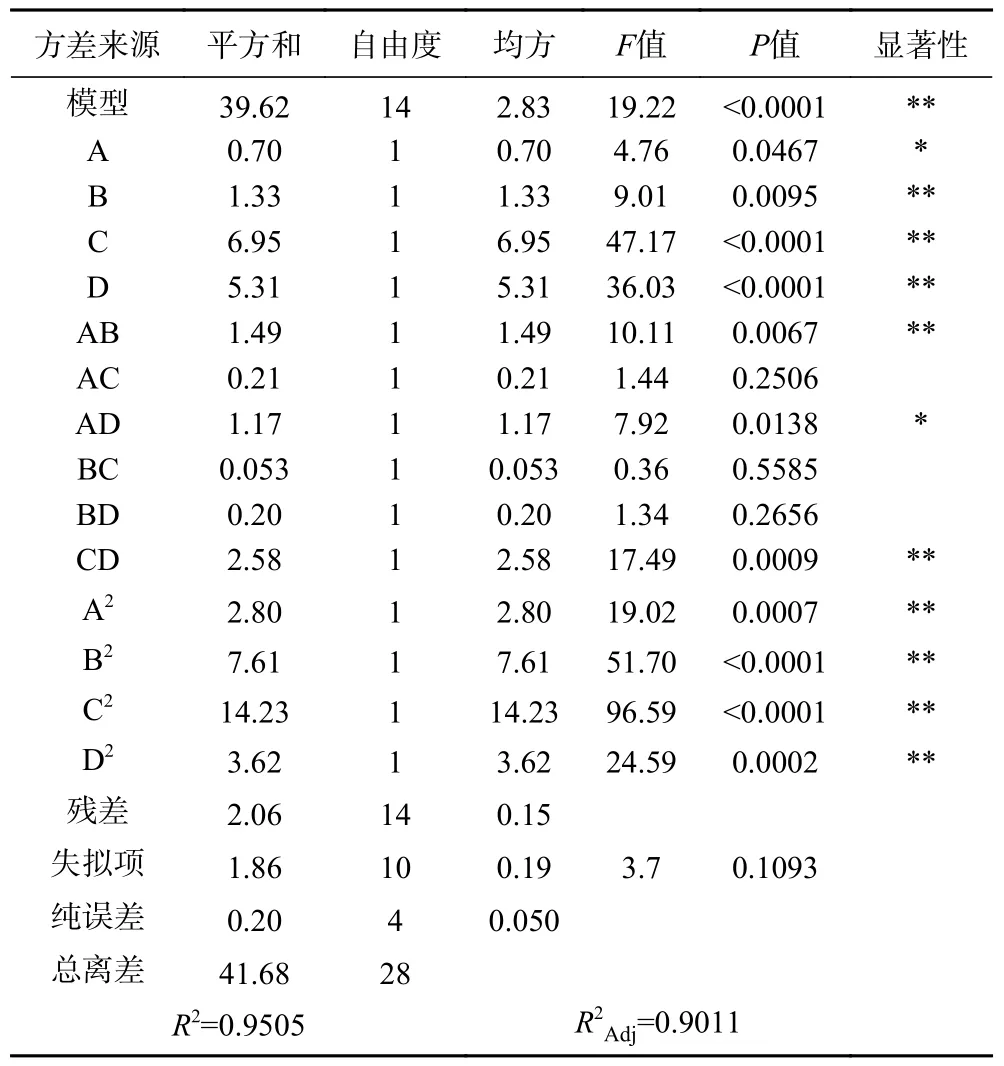
表3 回归模型的方差分析Table 3 Results of variance analysis of regression model
Y=12.28+0.24A+0.33B+0.76C−0.66D+0.61AB−0.23AC+0.54AD−0.11BC+0.22BD+0.80CD−0.66A−1.08B−1.48C−0.75D
经软件分析可得三维响应面及等高线图(图5~图7)。图5~图6 说明AD等高线比较圆润,响应面坡度平缓,C(超声功率)与D(料液比)之间交互作用对响应值的影响比A(酶添加量)与D(料液比)之间的交互作用显著,A(酶添加量)与B(超声时间)的交互作用对响应值的影响(<0.01)与A(酶添加量)与D(料液比)的交互作用(<0.05)相比更为显著。图7可根据等高线及响应面坡度可直观得出C(超声功率)与D(料液比)之间的交互作用对响应值的影响最为显著(<0.01)。

图5 酶添加量与超声时间交互作用Fig.5 Interaction between the amount of enzyme and ultrasonic time

图6 酶添加量与料液比交互作用Fig.6 Interaction between the amount of enzyme and solid-liquid ratio
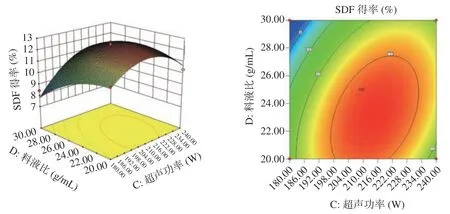
图7 超声功率与料液比交互作用Fig.7 Interaction between ultrasonic power and solid-liquid ratio
2.2.2 最佳工艺参数及验证 通过Design Expert8.0.6软件进行实验分析,得出最佳工艺条件为酶添加量0.21%,超声时间31.42 min,超声功率214.86 W,料液比1:23.49 g/mL,此时SDF 得率可达12.4732%。与实际结合将工艺条件修改为酶添加量0.2%,超声酶解时间31 min,超声功率210 W,料液比1:23 g/mL,在此条件下做3 次平行实验,得到SDF 得率为12.43%±0.14%,此结果与理论值相近,说明基于响应面优化所得到的模型参数真实可靠。当按最佳工艺条件进行实验时,IDF 得率为68.39%±0.27%。
2.3 理化性质分析
由1.2.6 的方法制备标准曲线,得到胆固醇标准曲线y=4.3555x+0.0843,=0.9991,葡萄糖标准曲线y=38.614x+0.2315,=0.9993。由表4 所示,油茶粕TDF 的持水力为4.36 g/g,持油力为3.67 g/g,膨胀力为6.83 mL/g,由于TDF 含有较多亲水集团,可以与水分子结合,从而膨胀,可以有效减少肠炎及便秘的风险。TDF 在pH 为2 的条件下胆固醇吸附率为5.79 mg/g,小于pH 为7 时的胆固醇吸附率,这与小米麸皮所得到的结论相似,而滇橄榄果渣总膳食纤维的胆固醇吸附率pH 为2 时更高,这可能是由于原料不同,性质有所不同。油茶粕 TDF 的葡萄糖吸附率为11.49 mg/g,TDF 可通过吸附胆固醇、葡萄糖等物质来预防高血糖、高血脂等疾病。

表4 油茶粕TDF 理化性质Table 4 Physicochemical properties of TDF of Camellia oleifera meal
2.4 结构表征分析
2.4.1 红外光谱(FT-IR)的测定 TDF 的红外分析如图8 所示,TDF 在3458 cm处有圆润且宽的吸收峰,此处为O-H 伸缩振动峰,此处有处于缔合状态的氢键,可推测油茶粕TDF 含有纤维素与半纤维素。在2928 cm左右处的吸收峰证明有C-H基团,证明有糖类物质的存在。1615 cm处的吸收峰是由木质素中芳香苯基团产生的。1354 cm处的吸收峰证明有C-H 的变角振动峰的存在,1000~1200 cm处有糖类C-O 吸收峰的存在,这些吸收峰表明油茶粕TDF 符合膳食纤维的结构特征。

图8 油茶粕TDF 红外光谱Fig.8 TDF infrared spectrum of Camellia oleifera meal
2.4.2 显微结构分析 采用电子扫描显微镜观察TDF 的表面特征,如图9 所示,膳食纤维的孔隙特征与有效表面特征有关,当放大倍数为100 倍时,TDF具有空腔且形状不规则的块状结构,颗粒大小不均匀,表面有孔状结构且凹凸不平。当放大倍数为500、1000 倍时可观察到疏松的孔状结构,有蜂巢型的多孔网状结构特征,表面粗糙且凹凸不平,空间结构比较均匀,由于蜂巢状的小孔使得TDF 表面积更大,造就了良好的亲水性,因此有着更好的持水力和持油力。

图9 油茶粕TDF 扫描电镜Fig.9 TDF scanning electron microscopy of Camellia oleifera meal
2.4.3 粒径测定 油茶粕TDF 的粒度分布如图10所示,其平均粒径为50.699 nm,由图可知膳食纤维呈现单峰分布的状态,近似正态分布,且峰波较窄,膳食纤维颗粒尺寸比较均匀。这与李鹏冲等提取的可溶性膳食纤维结果相似,均为单峰且近似正态分布。
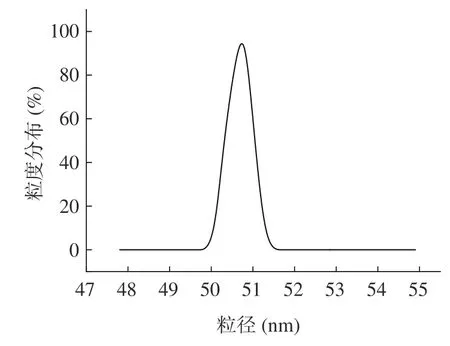
图10 油茶粕TDF 粒径分布Fig.10 Particle size distribution of camellia oleifera mealdietary fiber
3 结论
以油茶粕为原料进行前处理后以SDF 的得率为指标进行工艺条件优化,确定最佳工艺条件为酶添加量0.2%、超声酶解时间31 min、超声功率210 W、料液比1:23 g/mL,此时SDF 得率为12.43%,IDF得率为68.39%。此工艺条件用酶量少,提取时间短,减少了经济与时间成本。
对TDF 的理化性质进行测定,实验表明油茶粕TDF 的持水力为4.36 g/g、持油力为3.67 g/g、膨胀力为6.83 mL/g、胆固醇吸附率在pH2 时为5.79 mg/g,pH7 时为8.38 mg/g,葡萄糖吸附率为11.49 mg/g。油茶粕TDF 理化性质良好。在不同条件下胆固醇吸附率不同,油茶粕TDF 在肠道环境下更容易吸附胆固醇。通过对TDF 的结构表征研究可知,油茶粕TDF 具有蜂巢型多孔网状结构且颗粒均匀,含有糖类、木质素、纤维素及半纤维素,结构表征结果表明油茶粕TDF 具有膳食纤维的结构特征。
本实验采用超声辅助酶法对油茶粕SDF 进行工艺优化,并对油茶粕TDF 进行了理化性质及结构表征分析,为今后油茶粕膳食纤维的提取提供理论基础,并对油茶粕的有效开发利用提供了理论参考。在今后的实验中可以对多种提取方法对比,获得更加优质的油茶粕膳食纤维。
