谷子几丁质酶基因家族鉴定及在白发病菌胁迫下的表达分析
2022-09-09韩海丽董梦迪马芳芳韩渊怀韩彦卿
韩海丽,王 鹤,董梦迪,马芳芳, 韩渊怀,韩彦卿*
(1. 山西农业大学 a. 植物保护学院;b. 创新创业学院;c. 农学院,太谷 030801;2. 杂粮种质创新与分子育种山西省重点实验室,太原 030031)
几丁质酶是一类与植物病害相关的蛋白质[1-2],在高等植物生长发育过程和抗病过程中起着重要的作用[3-5]。Tabei等[3]将水稻的几丁质酶基因导入黄瓜后,转基因黄瓜对灰霉病的抗性显著提高。Yamamoto等[4]将水稻的Ⅰ类几丁质酶基因导入葡萄中提高了葡萄对白粉病的抗性。近年来,几丁质酶基因已经被广泛地转入到不同作物种中,如水稻[5-6]、棉花[7]、大豆[8-9]、花生[10]、烟草[11-12]等,以提高植物的抗病性。关于植物几丁质酶的研究比较常见,而且在真菌抗病研究中也有相关报道[13]。该基因最早是在菜豆中研究的[14],相关研究人员将菜豆几丁质酶载入油菜、烟草中,发现菜豆几丁质酶基因表达上升,死苗率下降,发病率显著降低[15]。Rohini等[16]将烟草几丁质酶基因导入花生中,发现几丁质酶的基因表达量显著上升,花生褐斑病的发病率显著下降。2002年,Kishimoto等[17]将水稻几丁质酶基因RCC2导入烟草中,发现其对灰霉病的抗性显著提高。王果萍等[18]通过对西瓜植株进行接菌,并对转基因西瓜进行分析,发现几丁质酶基因显著表达,且对西瓜枯萎病的发生有显著的抑制作用。刘伟华等[19]通过对小麦的愈伤组织进行接菌,并对转基因植株进行分析,发现几丁质酶基因成功表达,与对照植株相比,几丁质酶活性显著增强,对白粉病的发生起到了很强的抑制作用。
几丁质酶根据酶活结构域差异分为糖苷水解酶家族 18(glycoside hydroase family 18,GH18)和糖苷水解酶家族 19(glycoside hydroase family 19,GH19)2个亚家族。GH18在细菌、真菌、植物、哺乳动物、昆虫和病毒中广泛存在,而GH19亚家族仅出现在植物和链霉菌属中,且其成员具有几丁质结合域(chitin-bind domain,CBD)结构,可与几丁质结合,增强植物体的抵抗能力[20-22]。
谷子是我国北方特色杂粮作物[23],不仅耐脊薄、耐贮藏、适应性强、水分利用率高[24],而且营养丰富、可粮草兼用[25],具有重要的经济价值,也是禾本科作物抗逆基因挖掘的模式植物[26-28]。但随着谷子品种的单一化种植,谷子白发病逐渐成为其主要病害之一。该病害的发生严重影响了谷子的生长发育,对谷子产量和品质构成了极大的威胁[29]。本研究通过谷子响应白发病菌侵染的转录组数据分析获得了30 个几丁质酶基因,并对谷子抗病相关几丁质酶家族基因的基本信息、理化性质、染色体定位、基因结构、系统发育树、蛋白基序等进行分析,拟明确几丁质酶基因的基本特征和潜在功能,研究结果可为几丁质酶基因的深入抗病机制解析及分子育种提供一定的研究基础。
1 材料与方法
1.1 谷子几丁质酶基因染色体定位、基因结构和保守结构域分析
首先从谷子的基因库中获得它们的染色体位置信息,接着利用TBtools软件分析30个几丁质酶基因的染色体位置[30],随后对其进行串联重复分析。判断串联重复的原则为:1)相邻基因间的距离小于100 kb ;2)基因间相识度大于70%[31]。利用MEGA 7.0软件对30个几丁质酶基因的保守基序及保守结构域进行分析,得出Motif示意图,进而用TBtools软件对其进行可视化作图。
1.2 谷子几丁质酶基因家族结构及系统发育分析
利用 MEGA 7.0对30个几丁质酶基因的蛋白序列进行比对,进而构建进化树,校验参数Bootstrap设置为1 000,其余参数为默认值。
1.3 谷子几丁质酶基因家族成员蛋白理化性质分析及亚细胞定位
结合网站phytozome V12.1(https://phytozome.jgi.doe.gov/pz/portal.html V12.1),从在线公共网站上下载30个几丁质酶基因的基本信息,再利用Expasy在线网站(https://www.genscript.com/psort.htm)对几丁质酶基因家族成员进行理化性质分析。
1.4 谷子几丁质酶基因表达模式分析
本课题组前期以抗病品种JG42及感病品种JG21为试验材料,通过RNA的提取及公司测序后,我们获得了12、24和48 h的转录组数据。经分析发现,几丁质酶基因在抗感谷子品种中表达差异显著。从谷子基因数据库下载30个几丁质酶基因的数据,用TBtools软件绘制基因表达热图。
1.5 谷子几丁质酶基因在干旱胁迫下的表达分析
选择抗旱谷子(AN04)和干旱敏感谷子(豫谷1号)为材料,以不同光照条件(早:中等光照;中:强光照;晚:弱光照)为试验组,正常未胁迫植株作为对照组,取其叶片进行RNA的提取,送公司进行二代测序后,利用TBtools软件绘制基因表达热图。
1.6 差异表达基因的实时荧光定量PCR分析
分别对感病品种JG21及抗病品种JG42 两叶一心时期的谷子进行孢子囊悬浮液喷洒接菌,接菌后12、24、48 h对抗感品种的叶片进行取样,提取总RNA,反转录合成cDNA后进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)验证基因表达水平。采用Primer Premier设计基因特异引物(表1)。使用TaKaRa实时荧光定量试剂盒,以谷子β-Actin(Seita.3G265400.1)为内参基因,反应体系为10 μL,包括5 μL 2×PCR混合酶、1 μL 上下游引物混合液(10 μmol/L)、1 μL cDNA、3 μL无菌水。PCR程序为 :95℃ 30 s;95℃ 5 s,60℃ 30 s,39个循环 ;95℃ 1 min ;60℃ 30 s。试验设3次重复,计算谷子几丁质酶基因在白发病侵染下的相对表达量[32]。

表1 本试验所用PCR扩增引物Tab. 1 Primers used in this study
2 结果与分析
2.1 谷子几丁质酶基因家族的基因定位分析
通过染色体定位分析发现,谷子的30个几丁质酶基因定位在除6号染色体外的其余8条染色体上(图1)。其中,7号染色体上定位到的基因最多,为8个,其次是5号染色体,共定位到6个基因。1号染色体和3号染色体上的几丁质酶基因最少,仅1个。2号、4号、8号和9号染色体上定位到的基因分别有4、2、3和4个,而其中Seita.J0579300定位在尚未组装完整的scaffold上。进一步分析发现,在5号、7号、8号、9号染色体上,10个串联重复涉及到14个基因(红色矩形方框表示),如Seita.9G263100和Seita.9G263200属于一个串联重复,可推测所有形成的几丁质酶基因串联重复属于同一亚家族。
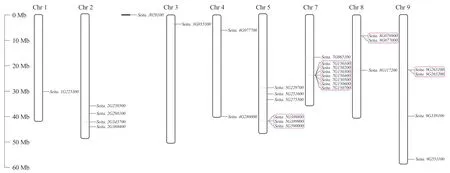
图1 谷子几丁质酶基因的染色体定位Fig. 1 Chromosome mapping of chitinase genes in foxtail millet
2.2 谷子几丁质酶系统进化分析
为明确几丁质酶蛋白基因的进化关系,本文利用MEGA 7.0软件对查找到的30个几丁质酶基因构建系统发育树。根据几丁质酶基因的功能可将其分为3大亚类(图2)。第一大亚类含有2 个基因,第二大亚类含有11个基因,第三大亚类含有15个基因。第一大亚类具有相同的结构域,其2个基因都含有GRAS结构域,为赤霉素信号传导的主要参与者,修饰或者结合小分子物质,能够参与调节植物生长发育的各个方面;第二大类的11个基因主要为GH18,具有GH18的保守结构域;第三大亚类的15个基因为GH19,GH19家族几丁质酶主要存在于植物中,作为真菌细胞壁的主要成分参与植物抗逆等过程[33]。
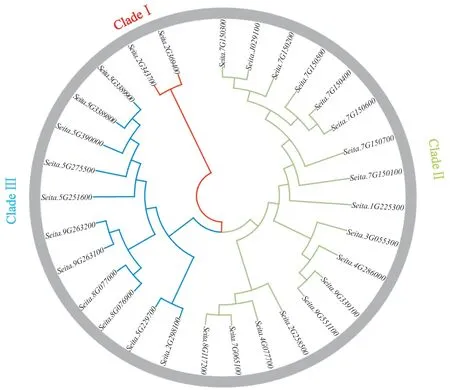
图2 谷子几丁质酶基因系统进化树Fig. 2 Phylogenetic tree of the chitinase gene family of foxtail millet
2.3 谷子几丁质酶基因蛋白理化性质分析
通过理化性质分析发现,该基因家族的氨基酸等电点(pI)为4.28(Seita.5G275500)~9.86(Seita.4G286000),相对分子质量为24 369.27(Seita.J0579300)~64 469.26 kD(Seita.2G343700)。蛋白质的不稳定指数(instability index,II)为19.17(Seita.7G150200)~50.91(Seita.2G298100),其中有12个几丁质酶基因不稳定指数大于40,属于不稳定蛋白。脂肪系数(aliphatic index)为53.80(Seita.4G286000)~84.49(Seita.5G229700),平均为72.71,说明它们的热稳定性较为一致。依据平均疏水指数介于-0.5~0.5的为两性蛋白的原则,这些几丁质酶基因都为两性蛋白,其中Seita.2G298100最大(0.250),Seita.2G343700最小(-0.482)(表2)。
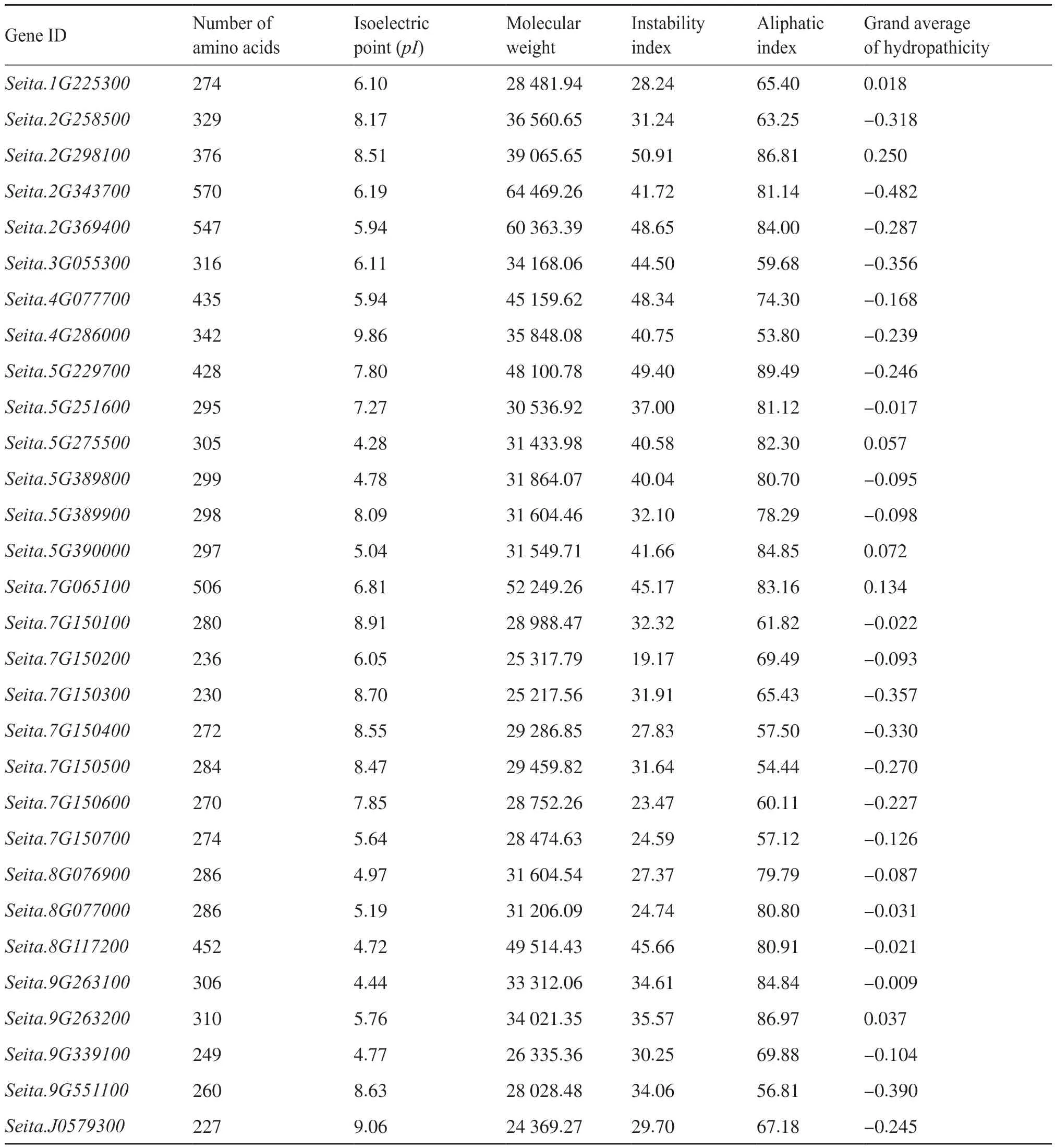
表2 谷子几丁质酶蛋白基本理化性质Tab. 2 Basic physicochemical properties of chitinase in foxtail millet
2.4 谷子几丁质酶蛋白二级结构预测和亚细胞定位
对30个谷子几丁质酶蛋白的二级结构进行预测,发现该家族含有α-螺旋、延伸链、β-折叠和无规则卷曲。其中,延伸链占7%~19%,β-折叠在8% 左右,无规则卷曲和α-螺旋占二级结构总量的20%~40%。亚细胞定位预测表明,谷子几丁质酶基因全部定位在细胞外(extracelluar),属于分泌蛋白(表3),其所有基因表达蛋白质均在细胞外发挥作用。
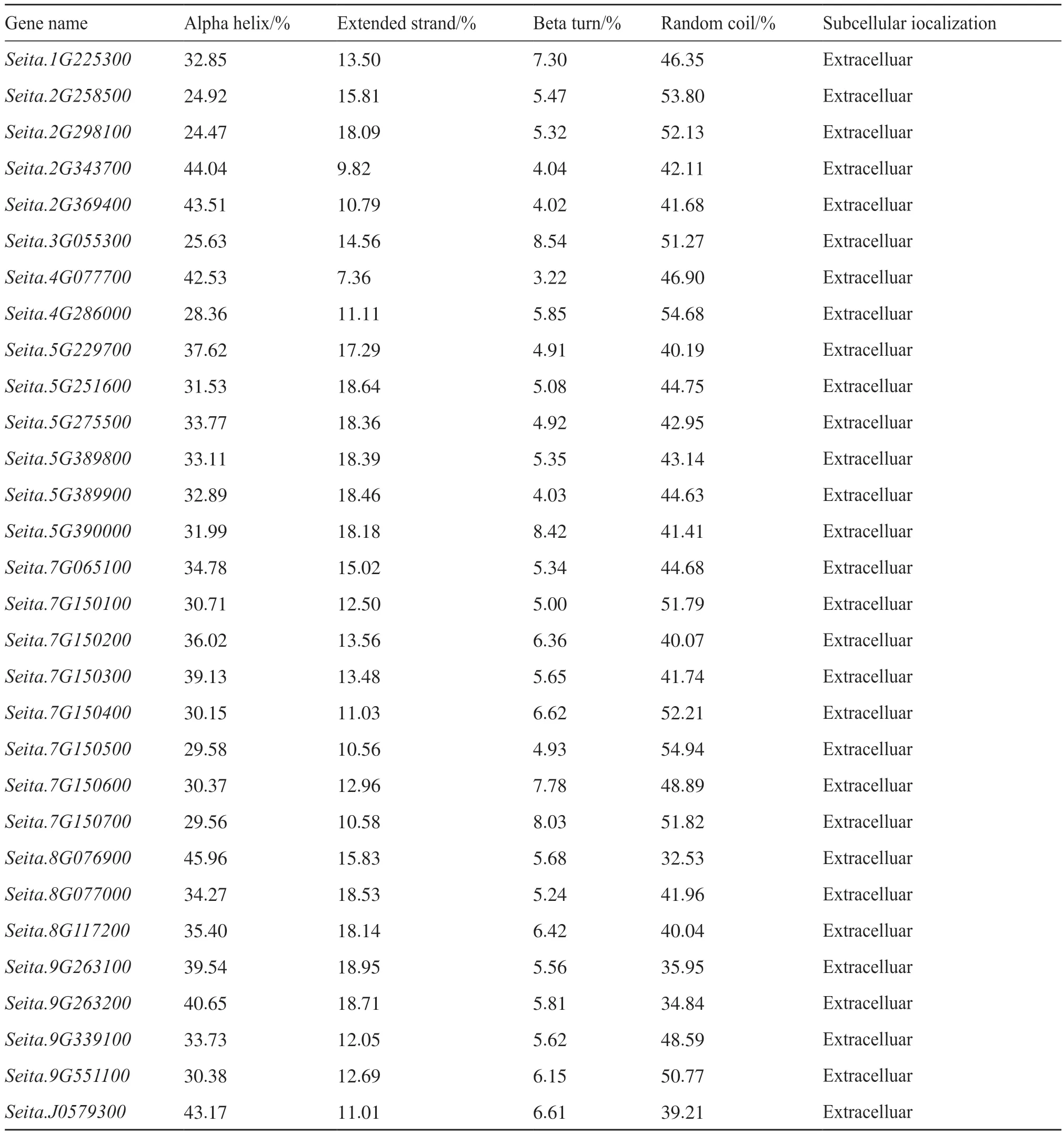
表3 谷子几丁质酶蛋白二级结构预测和亚细胞定位Tab. 3 Secondary structure prediction and subcellular localization of chitinase foxtail millet
2.5 谷子几丁质酶基因结构和保守结构域分析
对30个几丁质酶基因家族基因结构分析和蛋白基序分析发现:它们含有10类蛋白基序(Motif 1~Motif 10),长度分别在15~50 个氨基酸之间(表4),其中,Seita.5G229700没有鉴定到保守的Motif结构,Seita.2G369400只含有Motif 10 ;Motif 1、Motif 3 和 Motif 4 在 14 个蛋白中均被鉴定到 ;含有Motif 9 的蛋白最多,共19个,这19个蛋白被聚类在一起,说明这些蛋白可能发挥类似的功能。其次是Motif 2,在18个蛋白中被鉴定到。此外,Motif 8在11个蛋白中被鉴定到;Motif 7在9个蛋白中被鉴定到,且它们聚集在一起,推测具有相似的功能。Motif 5 和 Motif 6 分别在 7 个和 5 个蛋白中被鉴定到(图3)。基因结构分析发现,30个几丁质酶基因都含有上下游调控区(UTR),所有成员均包含外显子、内含子,但在具体的数量和位置上存在差异(图3)。
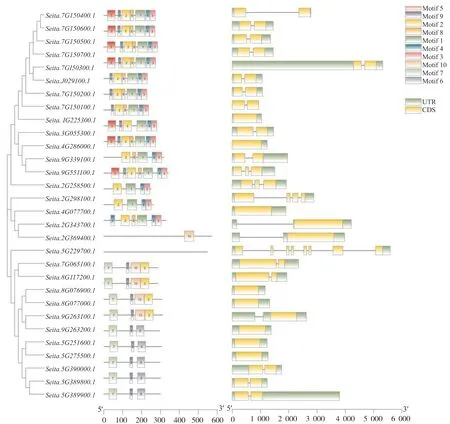
图3 谷子几丁质酶基因结构和保守结构域分析Fig. 3 Chitinase gene structure and conserved domain in foxtail millet

表4 谷子几丁质酶基因家族成员10个蛋白基序分析Tab. 4 Protein motif analysis of ten members of chitinase gene family in foxtail millet
2.6 谷子几丁质酶基因参与谷子逆境胁迫响应
对抗旱和干旱敏感两个谷子品种的转录组数据进行分析,由图4 可知,多数几丁质酶基因在抗旱和敏感谷子品种中未见显著表达差异。 其中,5个几丁质酶在抗旱和敏感谷子品种中基因表达在不同时期存在差异。Seita.7G150200在干旱敏感品种,中等光照(早)中上调表达,而在强光照(午)、弱光照(晚)下调表达或几乎不表达;Seita.7G150400和Seita.7G150500及Seita.7G150700有着相同的表达模式,在抗旱品种,中等光照(早)中上调表达,强光照(午)下调表达;Seita.5G390000和Seita.7G065100有着相同的表达模式,在干旱敏感品种弱光照(晚)中上调表达,而在中等光照(早)、强光照(午)中不表达或下调表达。这说明部分几丁质酶的基因表达受到光照和品种的影响,在抗旱和干旱敏感的表达存在明显差异(图4)。
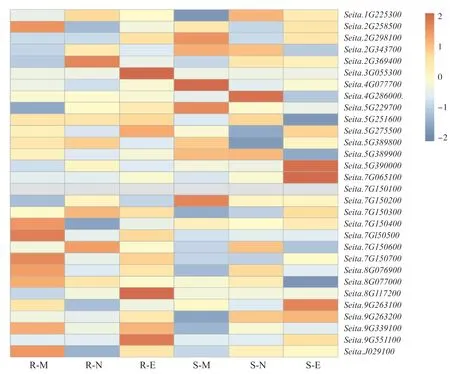
图4 谷子几丁质酶基因在干旱胁迫下的表达分析Fig. 4 Relative expression patterns of chitinase genes under drought stress in foxtail millet
2.7 谷子几丁质酶基因响应白发病菌侵染的表达分析
为明确谷子几丁质酶应对白发病菌侵染的响应,我们分析了抗感谷子在接种白发菌12、24和48 h后的基因表达模式。由热图可以看出:在抗病品种中,除Seita.2G369400在12 h表达明显下调外,其他几丁质酶基因大部分在抗病品种中12、24和48 h这3个时间段中均上调表达;在感病品种中,除了Seita.9G263100、Seita.8G117200和Seita.7G150400这3个基因在12 h表达上调外,其余大部分几丁质酶基因在感病品种中3个时间段均表现为下调表达(图5)。由此可推测,这些几丁质酶基因在响应白发病菌侵染过程中发挥了重要的抗病调控作用。
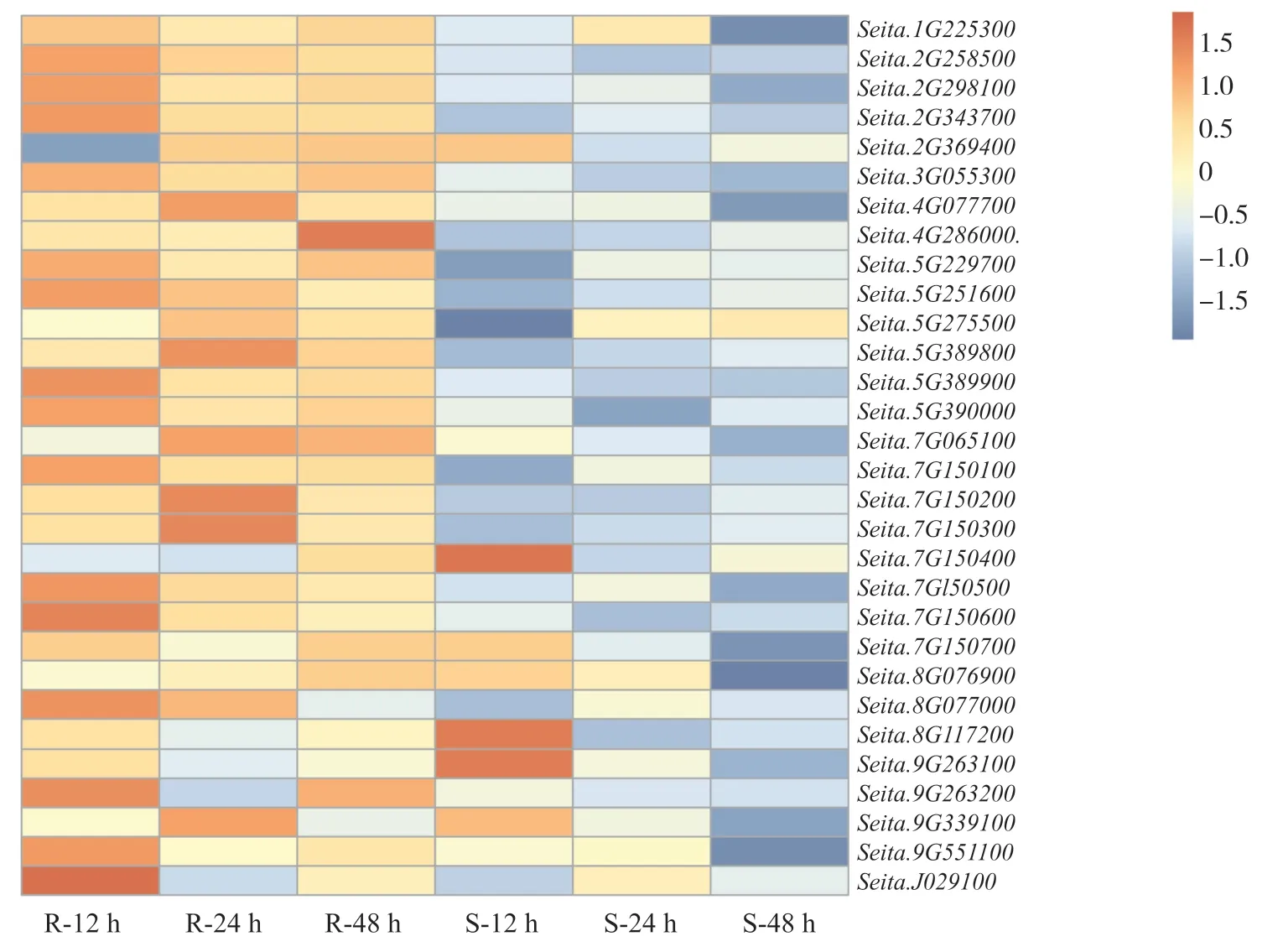
图5 谷子几丁质酶基因在抗感品种中3个时间段的表达分析Fig. 5 Expression analysis of chitinase gene in foxtail millet during three time periods in resistant cultivars
2.8 谷子几丁质酶基因参与抗病响应的表达验证
为进一步验证几丁质酶基因参与谷子抗白发病响应的表达差异,本文选择Seita.1G225300、Seita.4G286000、Seita.5G389900、Seita.7G150600、Seita.7G150700和Seita.8G076900共6个基因进行实时荧光定量表达分析。通过验证可知:Seita.1G225300在抗病品种中12、24和48 h 3个时间段均上调表达,而在感病品种中12 h时基因不表达;Seita.4G286000基因在抗病品种中48 h时表达量达到最高,而在感病品种中在这3个时间段内均呈现逐渐下降的趋势;Seita.5G389900在抗病品种中3个时间段表达量上调,而在感病品种中表达量下调;Seita.7G150600在3个时间段内表达量明显上调,而在感病品种中表达量较抗病品种均下调;Seita.8G076900基因在感病品种中48 h时显著下调。
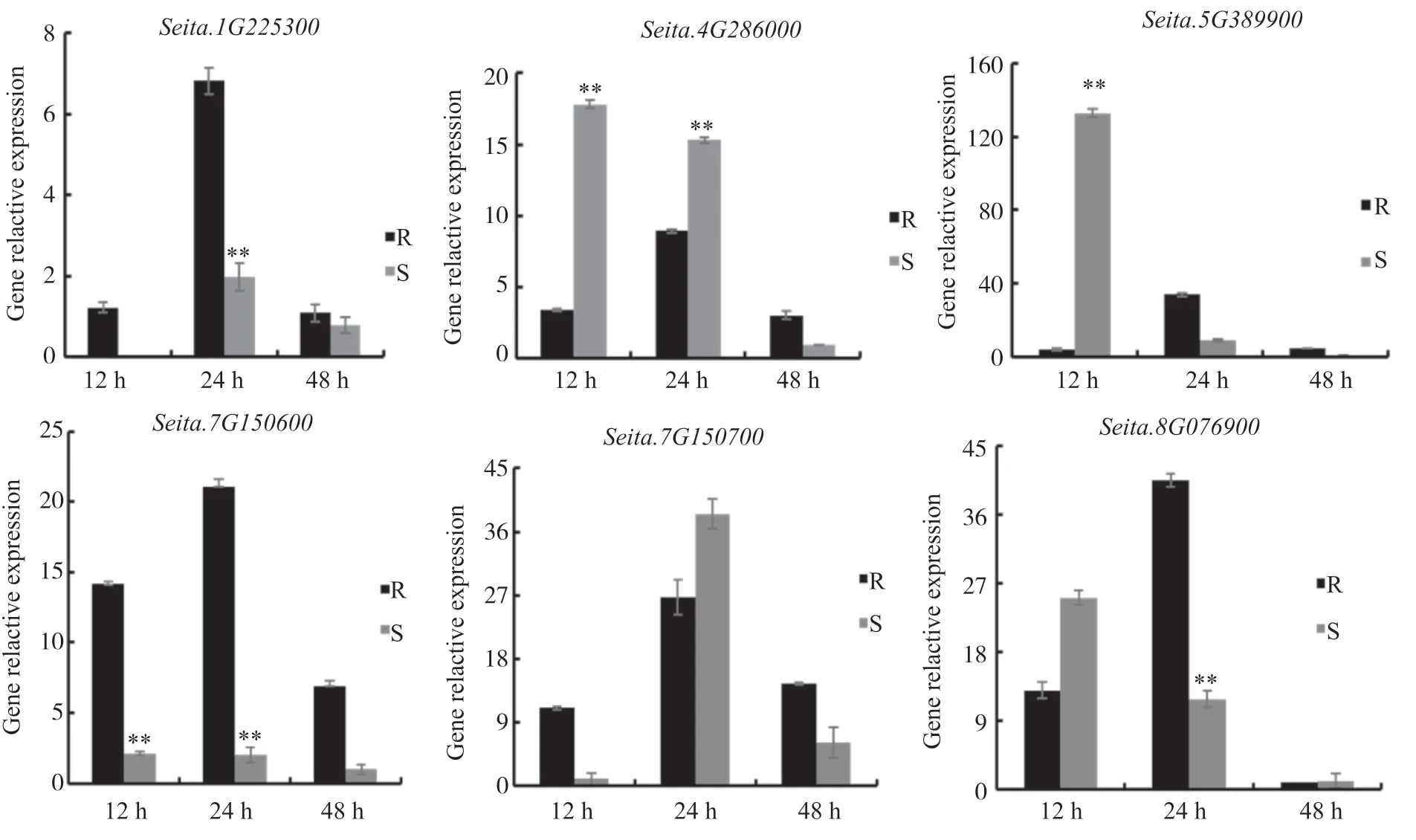
图6 谷子几丁质酶基因在白发病侵染后胁迫下的表达分析Fig. 6 Relative expression patterns of chitinase genes under adversity stress in foxtail millet
3 讨论
几丁质酶基因已在水稻[34]上被证明可参与调控植物的生长发育、抗逆性等过程。本研究对谷子中的几丁质酶基因进行结构以及氨基酸保守结构域分析,发现其基因结构上表现出了一定的变异性,这与水稻和高粱中的结果相似[35]。对30个几丁质酶基因进行染色体定位分析发现,分布在同一条染色体上的几丁质酶基因具有相似的保守结构域。定位在第7条染色体上的几个基因具有相似的Motif及相似的UTR及CDS区域。根据相似的结构域推测其具有相似的功能(图3)。保守结构域分析显示,几丁质酶基因家族具有相同或相似的结构域,证明了几丁质酶基因在进化过程中存在一定的保守性。
植物几丁质酶基因的表达形式可以分为两种:组成型表达和诱导型表达。植物几丁质酶广泛分布于植物的根、茎、叶、花及胚等部位。在外源因子的刺激下,植物体内的几丁质酶大幅上调表达。本研究根据系统发育树及染色体定位分析发现,同一条染色体上的基因在系统发育树的分类相同,且有相似的保守结构域,结合热图分析可知,它们在抗病或抗旱过程中具有相似的调控方式(图3~5)。几丁质酶基因家族在植物抗病过程中发挥了重要作用[35]。在甘蓝型油菜黑胫病和菌核病过程中,一些几丁质酶基因家族成员被特异地诱导表达[36]。另外,荔枝的果皮几丁质酶参与霜疫霉菌的抗病过程[37]。而本研究发现,Seita.7G150700和Seita.8G076900两个基因共同参与抗旱和抗病过程。在这两个过程中,抗病品种表达上调,而在感病过程中表达下调,且与转录组的结果一致,说明这两个基因可能同时参与抗病和抗旱的过程。
本研究通过对其染色体定位、理化性质、基因结构与保守结构域进行分析,明确谷子几丁质酶基因在抗感品种中的表达模式。其研究结果可为后期研究相关几丁质酶基因对谷子的抗病性提供一定的理论基础,为谷子分子育种发掘潜在的基因资源。
