微滴式数字PCR定量检测鸡毒支原体方法的建立
2022-09-08谢志勤谢芝勋张艳芳谢丽基万丽军罗思思张民秀曾婷婷黄娇玲李小凤任红玉阮志华
谢志勤,谢芝勋,张艳芳,范 晴,谢丽基,万丽军,罗思思,李 孟,张民秀,曾婷婷,黄娇玲,王 盛,李 丹,韦 悠,李小凤,任红玉,阮志华
(广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,广西南宁 530001)
鸡毒支原体(Mycoplasma gallisepticum,MG)主要侵害鸡,引起不同日龄、不同品种鸡发生慢性呼吸道病,轻者咳嗽、流鼻液,重者窦部肿胀、呼吸困难。MG 对雏鸡危害极大,除可导致呼吸道疾病外,还可引起雏鸡生长迟缓,发育不全,淘汰率非常高。MG 可引起蛋鸡产蛋减少[1-2]。种鸡感染MG 后可在体内长期带有病原。MG 一旦感染鸡群就很难被彻底清除[3-4],可在鸡群中长期存在并可扩散至其他鸡群,极易继发或并发大肠杆菌、传染性支气管炎病毒等病原体感染,导致鸡群死亡,给养禽业带来重大经济损失[5-6]。
鸡MG 感染很普遍,正呈世界性流行态势。MG 引发的症状与其他病原如H9N2 亚型禽流感病毒、鸡新城疫病毒引起的症状很相似,临床上很难区分,需要通过实验室方法进行诊断。常用的实验室鉴别MG 方法有病原分离鉴定[7]、PCR 方法[8]、荧光定量PCR 方法[9-10]、LAMP 方法[11]等。但这些方法都或多或少存在不足,不能满足低拷贝数MG,如MG 感染早期的定量检测需求。例如:病原分离鉴定方法虽准确,但操作繁琐,费时费力;普通PCR 方法检测不够灵敏,且需要电泳;荧光定量PCR 方法能进行相对定量检测,检测MG 的灵敏度达100 拷贝/μL,但每次检测结果会因荧光定量PCR 内参的稳定性及扩增Ct 值的变化而变化;LAMP 方法虽敏感,但操作中易受污染,假阳性较多。目前缺乏绝对定量检测MG 的方法,需要建立一种更敏感的绝对定量检测方法,特别是针低拷贝数样品,如MG 早期感染的绝对定量检测,这对准确诊断防控MG 感染有重要意义。
微滴式数字PCR(droplet digital PCR,ddPCR)是近几年发展应用起来的一种新技术,其将反应液通过油包水方式、分为数万个独立的纳米反应微滴,根据每个反应微滴信号统计阳性拷贝数。目前该技术在很多领域包括动物疫病病原检测方面已有成功应用,证明其在动物疫病病原检测方面敏感性好,能实现绝对定量检测[12-13]。目前还没有建立ddPCR 检测MG 方法的报道。本研究以MGmgpc基因为靶基因,建立ddPCR 定量检测MG 方法,旨在为更加准确定量检测MG 提供技术支撑。
1 材料与方法
1.1 病原及临床样品
MG 株(MG S6、MG K2221、MG A5969)、鸡滑液囊支原体(MS)K1415 株、禽衣阿华支原体(MI)K-1805 株、禽脑脊髓炎病毒(AEV)Van 株,由美国康涅狄格洲州立大学Khan Mazhar I.教授惠赠;禽偏肺炎病毒(APV)MN-10 株,由美国滨夕法尼亚州立大学Lu Huagang 教授惠赠;鸡传染性支气管炎病毒(IBV)Mass 41 株、鸡传染性喉气管炎病毒(ILTV)BJ 株、鸡新城疫病毒(NDV)LaSota 株、禽呼肠孤病毒(ARV)S1133株、H9N2 亚型禽流感病毒(H9N2 AIV)066C 株,由广西壮族自治区兽医研究所实验室鉴定保存;鸡白痢沙门氏菌(SP)C79-13 株和鸡大肠杆菌(E.coli)O2 株,购自国家兽医微生物菌株保藏管理中心;60 份病鸡喉拭子、气囊拭子及肺样品,于2021 年1—12 月从广西7 个鸡场采集并保存于-80 ℃。
1.2 主要试剂及仪器
Supermix for Probe ddPCR(No dUTP,货号1863024)、Droplet generation oil for Probes ddPCR(货号1863005)、Droplet Reader Oil(货号1863004)、DG8 Cartridges(货号1863008)、DG8 Gaskets(货号1863009)、Pierceable Foil Heat Seal(货号1814040),购自美国Bio-rad 公司;EasyPure Viral DNA/RNA Kit(货号N20527),购自北京全式金生物技术有限公司;TIANamp Bacteria DNA Kit,购自天根生化科技(北京)有限公司;RT-PCR 扩增试剂盒、Premix ExTaq试剂盒、100 bp DNA Ladder、pMD18-T 载体、大肠杆菌DH5α、T4 连接试剂盒、凝胶回收试剂盒,购自宝生物工程(大连)有限公司;微滴生成仪(QX200 Droplet generator)、热封仪(PX1)、微滴数字读取仪(QX200 Droplet Reader)、梯度PCR 扩增仪(T-100),购自美国Bio-rad 公司;荧光PCR 仪(quantStudio 5)、分光光度计(Nanodrop 2000),购自美国Thermo Fisher Scientific 公司。
1.3 引物设计与合成
根据已发表的MGmgpc基因(No.JX869132.1)序列,利用在线https://bioinfo.ut.ee/primer3-0.4.0/软件,设计ddPCR 特异性引物和探针,并在线进行BLAST 分析。在探针序列5'端添加FAM 荧光基团,3'端添加BHQ1 淬灭基团。引物及探针由生工生物工程(上海)股份有限公司合成并经HPLC 纯化。所设计的引物和探针序列见表1。

表1 所用的引物和探针序列
1.4 病原核酸提取
按EasyPure Viral DNA/RNA Kit 说明书提取1.1 中的病毒株DNA/RNA,按TIANamp Bacteria DNA Kit 说明书提取MG S6、MG K2221、MG A5969 以及MS、MI、ILTV、SP 及E.coli等菌株的DNA,提取的DNA/RNA 直接用于扩增或于-80 ℃保存备用。
1.5 重组质粒标准模板构建与鉴定
提取MG S6 总DNA 后作为模板,用引物MG F/MG R 扩增后,克隆至与pMD18-T 载体构建重组质粒pMD18-MG,经PCR 鉴定后由宝生物工程(大连)有限公司测序,测序正确的质粒DNA用分光光度仪测定D260nm/D280nm值,并按公式计算拷贝数。拷贝数=(浓度×阿伏加德罗常数)/(1 个碱基对的平均相对分子质量×总长度)。
1.6 ddPCR 反应体系建立及条件优化
20 μL 反应体系:2×Supermix 10 μL,5~40 μmol/μL 的 MG F/MG R 各 1 μL,2.5~40.0 μmol/μL MG Pro 1 μL,标准质粒模板2 μL,加灭菌 ddH2O 补足至20 μL。微滴生成:在DG8 Cartridges 的第二排孔分别加入上述反应液20 μL,第三排孔每孔加入droplet generation oil 70 μL,盖上DG8 Gaskets,置微滴生成仪上自动生成微滴于第一排孔。封膜:吸取生成的微滴至96 孔板内,加铝膜Pierceable Foil Heat Seal 置PX1热封仪上,程序设置为180 ℃ 10 s 进行封膜。PCR扩增:封膜的96 孔板放入PCR 扩增仪上进行扩增。设计反应程序:95 ℃ 10 min;94 ℃ 30 s,退火温度设置50~60 ℃ 1 min(2 ℃/s),共进行40 个循环;98 ℃ 10 min,4 ℃结束。数据读取及分析:反应结束后,将96 孔板置QX200 Droplet Reader上读取信号并进行数据分析。
1.7 ddPCR 特异性测定
提取NDV、H9N2 AIV、IBV、ARV、AEV、APV 的总RNA 并反转录为cDNA,提取MG S6、MG K2221、MG A5969 以及MS、MI、ILTV、SP 及E.coli的DNA 分别作为模板,按照优化的ddPCR 方法进行检测,评估该方法的特异性。
1.8 ddPCR 灵敏度测定
测定重组质粒标准品浓度并进行10 倍倍比稀释(10-4~10-11)后作为模板,按照优化的ddPCR方法检测,评估该ddPCR 方法的敏感性。同时采用荧光定量PCR 方法,用同样的引物探针,对相同质粒标准品浓度进行平行检测,比较两种方法的灵敏度。同时取5 个稀释度进行4 次平行试验,分析ddPCR 检测的线性区间。
1.9 ddPCR 重复性测定
取10-5~10-73 个连续稀释度的质粒标准品为模板进行3 次ddPCR 扩增反应,通过计算3 次反应结果的变异系数来验证ddPCR 的重复性。
科学技术是经济发展的第一生产力,也是推动实现全面持续发展的必然要求,人才是发展科学技术不可或缺的部分,因此必须注重对人才的培养,尤其是对企业内部高层管理人员素质的培养,通过这种方法使得企业能够在面对各种情况时更好地决策,更好地发挥产业园区的内部优势,为企业的长远发展做出贡献,从而促进当地的产业发展,推动经济向着更加合理、稳定、高效的方向发展。
1.10 临床样品检测
取约5 g 肺样品,按质量比1:8 加入无血清的DMEM 培养液研磨,在喉及气囊拭子中,分别加入2 mL 无血清的DMEM 培养液混匀,-70 ℃反复冻融3 次,4 000 r/min 离心5 min,取上清,14 000 r/min 离心10 min,弃上清,按TIANamp Bacteria DNA Kit 说明书步骤提取沉淀中的总DNA。用建立的ddPCR 方法进行检测,同时用文献[10]中的荧光定量PCR 方法进行检测,比较两种检测方法检测效果的符合率。
2 结果与分析
2.1 重组质粒标准品鉴定
挑取重组质粒pMD18-MG 进行PCR 鉴定,结果扩增出大小约198 bp 的明亮条带;送宝生物工程(大连)有限公司进行测序,用MegAlign 软件将测定的序列与MGmgpc基因(No.JX869132.1)序列进行Clustal W Method 分析,结果发现测定的序列与MGmgpc基因100%同源,序列正确;用分光光度仪测定的重组质粒pMD18-MG 标准品D260nm/D280nm值为1.90,按公式计算的拷贝浓度为1.35×1010拷贝/μL。
2.2 ddPCR 反应条件优化
ddPCR 反应中,对不同引物浓度和探针浓度进行优化,当MG F/MG R 引物浓度和MG Pro 浓度分别为20 和10 μmol/μL 时,即MG F 和MG R终浓度为1 μmol/μL,MG Pro 为0.5 μmol/μL 时,阳性微滴信号高,阳性微滴与阴性微滴之间的荧光信号区分明显,此时的引物、探针浓度为最佳反应浓度。用最佳引物浓度和探针浓度,退火温度设50、51、52、54、55、56、58、60 ℃共8 个不同梯度,对相同模板浓度进行ddPCR 反应扩增,结果退火温度为55 ℃时,阳性微滴信号(显示为蓝色)和阴性微滴信号(显示为黑色)之间的荧光信号区分明显,扩增获得的阳性微滴数最高,此时的退火温度55 ℃即为最佳退火温度。
2.3 优化后的ddPCR 反应体系及程序
20 μL 反应体系:2×Supermix for probe(No dUTP)10 μL,20 μmol/μLMG F/MG R 引物各1 μL,10 μmol/μLMG Pro 1 μL,DNA/RNA 模板2 μL,用 ddH2O 补足至20 μL。反应程序:95 ℃ 10 min;94 ℃ 30 s,设置退火温度55 ℃1 min(2 ℃/s),40 个循环;98 ℃ 10 min,4 ℃结束。
2.4 ddPCR 反应特异性测试
将NDV、H9N2 AIV、IBV、ARV、AEV、APV 的总RNA 并反转录为cDNA,然后与MG S6、MG K2221、MG A5969 以 及MS、MI、ILTV、SP 及E.coli的DNA 一起分别加入已优化好的ddPCR 反应体系中进行特异性检测。结果显示,每孔扩增总微滴的生成量均达1 万以上,且较均衡,说明微滴扩增反应成立。出现阳性微滴的病原有MG S6、K2221、A5969,其他病原无阳性微滴出现,与MG 株也没有出现交叉反应(图1),表明该方法的特异性强。
2.5 ddPCR 灵敏度测定
取10-4~10-11稀释的pMD18-MG 重组质粒标准品各2 μL 作为模板,分别按照优化的ddPCR 和荧光定量PCR 进行检测。结果显示,ddPCR 对质粒标准品的最低检测限为3.9 拷贝/μL(10-8稀释,图2-A),而荧光定量PCR 只检测到10-7稀释的质粒标准品(40.6 拷贝/μL,图2-B),10-8稀释的质粒标准品没有被检出。用5 个连续稀释的MG重组质粒标准品及检测阳性拷贝数的对数值,绘制ddPCR 绝对定量曲线,结果为线性。线性方程为y=-1.007x+8.63,斜率为-1.007,R2为0.999(图3)。
2.6 ddPCR 重复性测定
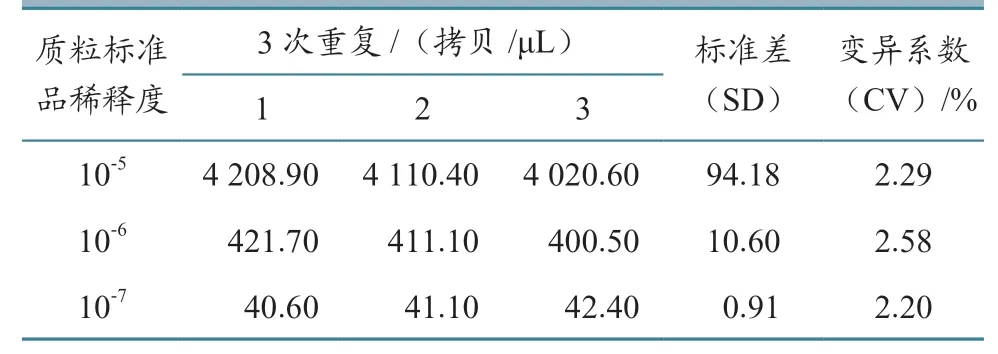
表2 ddPCR 重复试验结果
2.7 临床样品检测
对60 份病鸡喉拭子、气囊拭子及肺样品进行检测,ddPCR 检测结果为MG 阳性9 份,分别为喉拭子样品2 份、气囊拭子样品6 份及肺样品1 份,样品中检出的MG 拷贝数浓度为12.2~972.0 拷贝/μL,阳性检出率为15.0%(9/60);荧光定量PCR 检测结果为MG 阳性8 份,分别为喉拭子样品2 份及气囊拭子样品6 份,阳性检出率为13.3%(8/60)。从检测结果看出,ddPCR 检出率高于荧光定量PCR。部分样品检测结果见图4 和表3。

表3 60 份临床样品检测结果 单位:份
3 讨论
鸡MG 感染较为普遍,感染率高,难以清除。准确诊断是防控MG 感染的重要手段。目前在众多的检测诊断方法中,没有一种方法能及时准确对MG 早期感染进行绝对定量检测。本ddPCR 检测方法的建立,实现了对低拷贝数MG,如MG 早期感染的准确绝对定量检测。经特异性检测验证,本方法只检出MG,没有检出其他常见禽病病原,也没有发生交叉反应,说明本方法具有很好的特异性。
dPCR 方法虽然是在荧光定量PCR 的基础上发展而来的,但这两种检测方法有所不同。ddPCR方法是通过直接计算反应的微滴数来实现对拷贝数的绝对定量检测,受扩增效率影响较小[11],可直接读取结果且结果直观准确;而荧光定量PCR 需要通过标准曲线及扩增的Ct 值来计算标准品的拷贝数,常因检测的内参稳定性及Ct 值变化而影响结果。在敏感性检测方面,已有报道认为ddPCR方法比荧光定量PCR 方法敏感,如刘洋等[14]建立的ddPCR 检测方法比荧光定量PCR 方法灵敏度高10 倍。本研究建立的方法经灵敏度检测,证明检测限为3.9 拷贝/μL 的MG 重组质粒标准品模板,而荧光定量PCR 方法只检测到40.6 拷贝/μL。这一结果进一步证明了ddPCR 检测方法比荧光定量PCR 方法灵敏度高10 倍。由此表明,本研究建立的方法灵敏度,可实现个位拷贝数的绝对定量检测,这将有助于对低拷贝数MG 的定量检测。
用本研究建立的方法,对采集的临床样品进行检测,采用ddPCR 方法检出MG 阳性9 份,阳性检出率为15%,荧光定量PCR 方法检出MG 阳性8 份,拷贝数浓度为12.2 拷贝/μL 的样品没有检出,阳性检出率为13%。从检测样品的结果分析,ddPCR 方法的阳性检出率高于荧光定量PCR 方法,而且ddPCR 方法可以直接显示检测出的拷贝数,结果直观准确,实现了对低拷贝数MG 或需要绝对定量样品的检测,为定量检测MG 提供了更加准确的方法。
目前ddPCR 技术在各领域已得到广泛应用,在动物疫病检测方面也发挥了重要作用[15-16]。目前制约国内ddPCR 技术广泛应用的主要问题是仪器设备需要进口,试剂昂贵,且操作步骤复杂,要求高。相信不久的将来,会实现仪器及试剂的国产化,这样ddPCR 技术将随着检测成本的大幅降低而得到更广泛应用。
