海马齿状回内beta肾上腺素能受体对睡眠剥夺大鼠空间学习记忆的作用及其机制*
2022-09-08王琮民闫纪琳
吕 晶,王琮民△,刘 鑫,闫纪琳
(1.河北工程大学医学院,2.河北工程大学附属医院,邯郸 056038)
睡眠不良是日常生活中常见的现象,可导致严重的认知障碍,包括注意力下降、决策和记忆障碍[1-3],海马是脑内认知功能的重要区域。许多报道表明,睡眠剥夺(sleep deprivation,SD)会导致海马依赖的记忆障碍。例如,48 h SD可降低大鼠海马依赖的空间学习记忆表现[3]。齿状回区(dentate gyrus,DG)在学习记忆尤其是在空间编码中发挥重要的功能[4]。长时程增强(long-term potentiation,LTP)是重要突触可塑性细胞模型。研究发现,3~4 h的SD降低了DG颗粒细胞的LTP[5],同时SD也可抑制颗粒细胞依赖的神经发生[6]。然而SD损害DG功能潜在的神经生物学机制尚不明确。
去甲肾上腺素(norepinephrine,NE)是诱导和维持LTP所必需的重要神经递质之一,广泛分布于中枢神经系统。去甲肾上腺素能纤维主要起源于蓝斑(locus coeruleus,LC),它们广泛的投射到整个前脑区域,特别是海马中[7]。更重要的是,研究发现在DG区去甲肾上腺素能投射最为密集,且beta-肾上腺素能受体(beta-adrenergic receptors,beta-AR)高度表达[7,8]。行为学研究表明,NE激活beta-AR是空间学习和记忆所必须,且DG中阻断beta-AR不仅抑制空间学习还会损伤LTP的持久性[9,10]。然而,目前有关DG内beta-AR对SD大鼠空间学习记忆作用的研究报道较少。因此,本研究旨在研究beta-肾上腺素能信号对睡眠剥夺记忆障碍的干预作用及其机制。
1 材料与方法
1.1 动物、仪器与试剂
清洁级雄性SD大鼠,体重250~300 g,由北京维通利华提供,许可证号:SCXK京2008-0011;剥夺杆式睡眠剥夺仪(上海新软,XR-XS107);脑立体定位仪(成都泰盟,DW-2000);微量注射泵(日本Eicom,ESP-64);石蜡切片机(金华华速科技,HS2046);光学显微镜(莱卡,DMC5400);异丙肾上腺素(isoproterenol,ISO,I5627)购买自sigma;脑源性神经营 养 因 子(brain derived neurotrophic factor,BDNF,Ab108319)抗体购买自abcam。c-Fos(2250)及b-actin(3700)抗体购买自Cell signaling。
1.2 动物分组及模型制备
动物分为对照组,异丙肾上腺组(ISO),模型组(SD)和SD+ISO组。施加睡眠剥夺每日18 h,连续21 d,设备中的剥夺杆可以周期性地围绕设备底部左右滑动,每次滑动时间30 s,速度3 m/min,间隔2 min,重复循环滑动。期间饮食饮水自由。对照组不进行处理。
1.3 微量注射针的植入及给药
模型结束后,动物麻醉,稳定于仪器上,参照Pazinos和Watson大鼠脑图谱[11]将外套管置于DG区上1.5 mm处(AP-3.4 mm;L/R-1.8 mm;H-2.5 mm),牙托水泥固定。术后休息3 d,将自制微量注射针(前端超出套管1.5 mm)植入套管内并固定。每日行为学检测之前,应用微量注射泵将盐水和ISO(2μg/μl溶于盐水)通过注射管分别注射到ISO组,SD组和SD+ISO组DG区域,注射速度0.5μl/min,时间2 min,总体积1μl,滞留时间2 min。
1.4 大鼠行为学测试
Morris水迷宫(Morris water maze,MWM)检测空间学习能力。MWM分四个象限,圆形平台放置在第III象限的中心。训练包括定位航行(1~4 d)和空间探索(第5日)实验。正式训练前,动物先入水适应2 min。定位航行实验中,大鼠每天分别从四个象限入水自由游泳,每次每只大鼠游泳时间限制120 s,若在此期间大鼠找到并爬上站台稳定站立10 s,则大鼠进水至游上隐蔽平台所逃逸时间记为逃避潜伏期,若120 s内未游上站台,潜伏期为120 s。空间探索实验中,将圆形平台从游泳池中移除,记载2 min间动物在每个象限的时间比和穿台次数。整个训练中动物的游泳速度也将计入最终统计。
1.5 免疫组织化学染色
训练结束大鼠处死,取出一侧脑组织,经固定、浓度梯度递减的乙醇溶液脱水、石蜡包埋、切为5μm的薄片、脱蜡、样本处滴3%过氧化氢溶液,随后微波热源修护,烧杯内缓冲液沸腾后停止加热,重复上述步骤3次。随后组织切片自然冷却,应用5%BSA封闭20 min,轻甩表面残留液体。c-Fos一抗4℃过夜,第2日室温下滴加二抗反应20 min,最后显色,应用光学显微镜采集图片。
1.6 免疫印迹
动物处死并在显微镜下分离一侧DG组织。组织内加入RIPA裂解缓冲液,于冰上匀浆提取总蛋白,采用BSA蛋白定量试剂盒进行定量,提前配置浓缩和分离胶,SDS-PAGE凝胶电泳后转PVDF膜,室温下与5%脱脂牛奶孵育2 h,随后PBST洗膜。分别加入含c-Fos(1∶1 000)和BDNF(1∶1 000)抗体4℃孵育过夜。洗涤后,应用二抗(1∶1 000)在室温下孵育2 h。用化学发光试剂(ECL)显影,凝胶成像系统采集图片,应用image Lab软件分析目的蛋白条带和内参蛋白条带的灰度值,将其二项蛋白条带的灰度值比值作为蛋白相对表达量。
1.7 统计学处理
2 结果
2.1 海马DG内beta-AR对大鼠空间学习与记忆功能的影响
2.1.1 海马DG内beta-AR对大鼠空间学习能力的影响 前4日大鼠逃避潜伏期作为定位航行指标,代表大鼠的空间学习能力,结果如表1所示,各组大鼠前4 d逃逸时间伴随学习天数累加均逐渐减少。与对照组相比,SD组在第2~4日逃逸时间明显增加(P<0.01);ISO组在第4日逃避潜伏期显著减少(P<0.05),与ISO组相比,SD+ISO组第4日逃避潜伏期明显增加(P<0.05),然而与SD组相比,SD+ISO组逃逸时间降低,且在第3和4日具有显著性差异(P<0.01)。MWM水迷宫训练中四组大鼠游泳速度均无显著性差异(P>0.05,表2)。
Tab.1 Comparison of escape latency in various groups of rats(s,±s,n=6)

Tab.1 Comparison of escape latency in various groups of rats(s,±s,n=6)
SD:Sleep deprivation;ISO:Isoproterenol *P<0.05,**P<0.01 vs control group;##P<0.01 vs SD group;△P<0.05 vs ISO group;▲P<0.05,▲▲P<0.01 vs1 d
Group 1 d 2 d 3 d 4 d Control 52.27±17.34 29.93±12.52▲ 20.92±7.18▲▲ 18.61±6.45▲▲ISO 61.22±32.24 39.69±6.08 23.09±6.75▲ 10.35±4.07*▲▲SD 77.95±15.35 64.78±31.56** 58.44±19.74**▲ 38.95±18.11**▲▲SD+ISO 73.40±29.76 45.85±19.78 29.75±12.98##▲▲ 19.77±5.99##△▲▲
Tab.2 Comparison of swimming speed in various groups of rats(mm/s,±s,n=6)

Tab.2 Comparison of swimming speed in various groups of rats(mm/s,±s,n=6)
Group 1 d 2 d 3 d 4 d 5 d Control 159.14±17.63 145.60±26.45 121.36±16.53 105.24±16.53 186.92±40.22 ISO 178.62±39.77 165.32±29.54 140.23±27.99 92.22±23.95 190.17±37.89 SD 143.87±18.29 134.40±8.54 143.67±14.32 125.90±28.36 190.79±8.69 SD+ISO 154.83±32.62 143.69±19.74 128.72±15.99 108.13±24.81 192.71±60.60
2.1.2 海马DG内beta-AR对大鼠空间记忆能力的影响 第5日每个象限时间百分比及穿台次数作为空间探索指标,代表大鼠的空间记忆能力,结果显示,第5日所有组动物对第III象限均表现出显著的偏爱,滞留时间最高(图1)。如表3所示,与对照组相比,SD组III象限停留时间比例(P<0.01)及穿台次数(P<0.05)均显著降低。ISO组在目标象限停留时间百分比稍高,但无统计学意义(P>0.05),穿台次数两组无显著差异(P>0.05)。与ISO组相比,ISO+SD组穿台次数无明显差异(P>0.05),但III象限滞留时间均显著减少(P<0.05)。与SD组相比,ISO+SD组穿台次数虽无显著变化(P>0.05),但III象限滞留时间显著增加(P<0.05)。四组间大鼠第5日游泳速度无显著差异(P>0.05,表2)。

Fig.1 Representative swimming traces in the spatial probe trial of MWM test
Tab.3 Comparison of the proportion of total time spent in each quadrant and number of platform crossing in various groups of rats(±s,n=6)

Tab.3 Comparison of the proportion of total time spent in each quadrant and number of platform crossing in various groups of rats(±s,n=6)
*P<0.05,**P<0.01 vs control group;#P<0.05 vs SD group;△P<0.05 vs ISO group
Group Percentage of time spent in quadrant(%)(Quadrant)I II III(target) IV Number of platform crossing(Times/120 s)Control 18.83±5.92 18.12±6.85 43.57±7.98 19.48±6.36 8.67±3.01 ISO 11.86±8.15 15.96±3.21 49.81±2.96 20.95±6.63 8.16±4.28 SD 18.08±4.11 28.84±7.59* 31.33±3.20** 21.74±5.80 5.67±1.49*SD+ISO 18.01±4.06 17.94±8.59 40.00±5.90#△ 24.04±8.52 6.83±2.57
2.2 海马DG内beta-AR对c-Fos蛋白表达的影响
图2免疫组织化学结果显示,DG区c-Fos蛋白在所有组别胞浆和核中均有所表达,其中在对照组,ISO组及SD+ISO组表达较明显。免疫印迹结果显示(表4,图3),与对照组相比,SD组动物c-Fos表达明显减少,ISO组大鼠c-Fos表达无显著差异(P>0.05)。SD+ISO组大鼠c-Fos蛋白水平较ISO组低(P<0.05),但较SD组相比显著增加(P<0.05)。
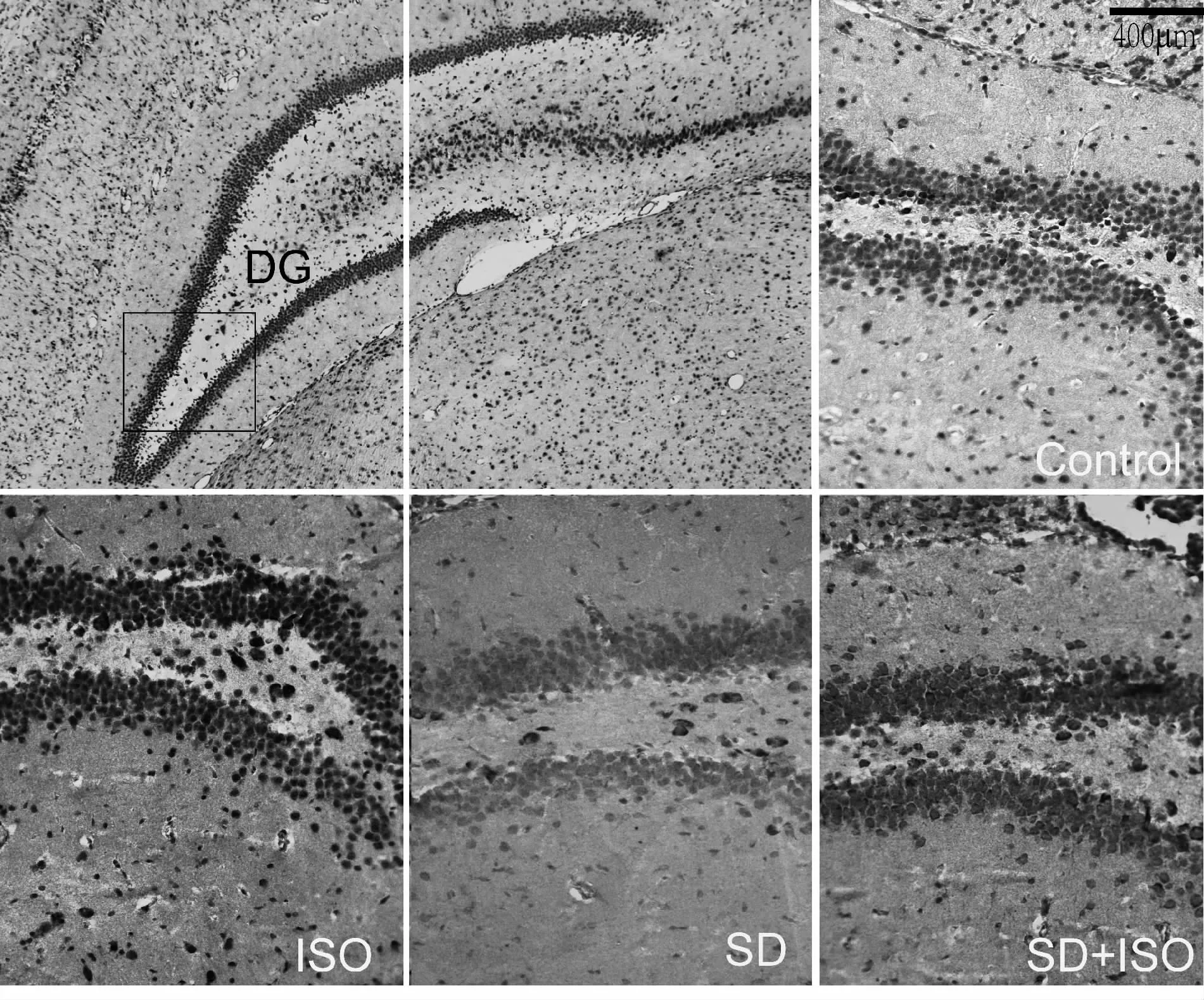
Fig.2 The expressions of c-Fos detected by immunohistochemical staining(×20)
2.3 海马DG内beta-AR对BDNF蛋白表达的影响
免疫印迹检测DG区BDNF蛋白表达,结果如表4和图3所示,与对照组相比,SD组DG区BDNF蛋白表达显著下降(P<0.05),与SD组相比,ISO+SD组中BDNF蛋白水平显著升高(P<0.05)。对照组、SD+ISO及ISO组三组大鼠BDNF水平之间均无显著差异(P>0.05)。
Tab.4 Comparison of c-Fos and BDNF protein levels in the hippocampus DG in various groups of rats(±s,n=6)

Tab.4 Comparison of c-Fos and BDNF protein levels in the hippocampus DG in various groups of rats(±s,n=6)
*P<0.05 vs control group;#P<0.05 vs SD group;△P<0.05 vs ISO group
Group c-Fos/b-actin BDNF/b-actin Control 0.725±0.174 0.726±0.881 ISO 0.867±0.240 0.612±0.306 SD 0.473±0.134* 0.392±0.102*SD+ISO 0.659±0.051#△ 0.540±0.129#

Fig.3 The expressions of c-Fos and BDNF detected by Western blot
3 讨论
睡眠不足可对认知功能产生不利影响。多种研究都强调了SD会损害学习和记忆,特别是海马依赖性记忆,如空间学习和记忆[1,12]。在本研究中也发现,SD大鼠在空间学习和记忆方面也表现出类似的损害。
海马由不同的亚区组成,其中DG区对于编辑与分析空间位置记忆非常关键[4]。行为研究表明,LC激活后的NE释放不仅能促进记忆的形成和巩固,对于DG中LTP的诱导和维持也是必不可少的,而这些过程中主要由beta-AR所介导[9,10]。已知beta-ARs高表达于DG突触后部位的颗粒细胞内[8],且有研究发现,DG内特异性阻断beta-AR会抑制LTP的产生而导致空间学习障碍[10]。因此,本研究探究在SD这一特殊情况下,DG内beta-AR对空间学习和记忆的影响。本研究在DG内微量注射beta-AR激动剂,结果显示,外源性激活beta-AR可明显改善SD诱发的空间学习与记忆障碍。早期研究发现,beta-AR激动剂增加DG颗粒细胞中电压依赖性钙通道的活性[13]。本研究室前期研究也发现,在海马DG内ISO激活beta-AR后可增加突触传递效率及DG区局部谷氨酸的水平,进而促进大鼠主动回避反应的获得[11],因此,本研究结果提示,beta-AR改善SD大鼠空间认知障碍可能与直接或间接影响DG区细胞兴奋性进而调节突触可塑性有关。
c-Fos作为即早基因一种,是目前最常用的神经元激活标志之一。很多研究表明,c-Fos在海马中具有重要调节作用,调控神经元生长、发展及受损修复[14]。不仅如此,c-Fos还可调节长期记忆的形成及神经可塑性[15],因此c-Fos表达常被作为神经可塑性的代表蛋白。在海马DG区c-Fos高度表达,且可在海马依赖性物体识别学习记忆后表达明显增加[16]。然而,DG区beta-AR是否可调节c-Fos影响海马学习记忆功能尚不明确。本研究结果显示,c-Fos在海马DG区大量表达,且SD降低DG区c-Fos蛋白水平,表明SD降低神经元活性。激活beta-AR后DG区c-Fos蛋白水平显著增加,提示DG区beta-AR激活可调节c-Fos表达,增加神经元活性改善SD大鼠空间学习记忆表现。
BNDF作为广泛研究的生长因子,在中枢神经系统中发挥许多关键功能。很多研究表明,BDNF在中枢内神经细胞再生、成熟以及突触产生等过程发挥关键调控功能[17]。Mello-Carpes PB等人发现,NE激活beta-AR后,可通过增加海马内BDNF表达提高海马依赖性新物体认知记忆的巩固[18]。因此,本实验检测了DG区突触蛋白BDNF水平。结果显示,SD会减少DG区BDNF水平,而ISO激活beta-AR后BDNF蛋白表达增加。研究发现,海马内灌注BDNF会恢复应激诱发的空间记忆及LTP的损害[19],而DG内NE作用beta-AR也可通过影响BDNF表达调节突触可塑性参与到应激大鼠空间学习记忆中[9]。因此,本研究中海马DG区beta-AR激活后改善SD大鼠空间学习记忆,可能是通过增加突触蛋白BDNF相关突触可塑性机制完成的,然而其具体生理机制还有待继续探究。
综上所述,本研究表明,海马DG中beta-AR的激活通过增加c-Fos和BDNF蛋白的表达来改善SD诱发的空间学习和记忆障碍,本研究结果为改善SD诱发认知功能障碍相关研究提供理论基础。
