有氧运动改善自发性高血压大鼠肾纤维化的作用*
2022-09-08曹书源刘国纯罗明昊何龙林
曹书源,常 青,刘国纯,罗明昊,汪 洋,何龙林
(1.重庆医科大学,重庆 400016;2.重庆医科大学附属康复医院,重庆 400050)
高血压引发慢性肾病(chronic kidney disease,CKD)和终末期肾病(end stage renal disease,ESRD),最终导致肾间质纤维化甚至肾功能衰竭[1],已经成为全球公共卫生的巨大威胁,目前在临床治疗中能够阻止或逆转肾纤维化的疗法仍然有限[2,3]。近年来有研究表明,有氧运动或有氧运动联合抗阻运动可以改善高血压、增强肾脏抗氧化能力、减轻肾脏纤维化程度。Souza Michel Kendy等人[4]研究表明,抗阻训练可有效减轻5/6肾切除CKD模型大鼠的肾脏纤维化和炎症;Shimojo Guilherme Lemos等人[5]证明有氧运动联合抗阻训练可降低平均动脉血压,减少去卵巢大鼠心脏炎症因子TNF-α和IL-6表达,降低心脏和肾脏的脂质过氧化水平,还增强心脏和肾脏的总抗氧化能力。有氧运动作为运动康复的重要手段之一,是改善原发性高血压患者血压的一种潜在的非药物治疗方法。但是关于有氧运动如何改善高血压肾损伤的机制研究甚少,有待进一步的探讨。
有氧运动训练可以通过下调肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的活性来降低血压。Silva SD等人研究[6]证实有氧训练降低自发性高血压大鼠(spontaneously hypertensive rats,SHR)的动脉收缩压,下调RAAS的血管收缩轴进而发挥肾脏保护作用,并且这些益处是可持续的。付常喜等人研究显示[7],8周跑台运动后自发性高血压大鼠有氧运动组的TGF-β和CTGF蛋白表达量下调,提示规律运动训练至少部分通过抑制TGF-β信号通路改善高血压诱导的肾脏纤维化。综上,有氧运动可以下调RAAS的血管收缩轴,抑制肾素-血管紧张素系统活性。本研究旨在探讨在持续有氧运动训练干预下,肾脏中的血管紧张素Ⅱ含量的变化,血管紧张素Ⅱ-血管紧张素1型受体-转化生长因子β(AngⅡ-AT1R-TGF-β)通路的表达是否会随之下调,并对比低、中有氧运动强度对自发性高血压大鼠(spontaneously hypertensive rats,SHR)肾脏纤维化影响的差异。
1 材料与方法
1.1 实验动物与分组
8周龄雄性SHR和同龄Wistar京都大鼠(WKY),均为SPF级,购自北京维通利华实验动物技术有限公司(实验动物生产许可证:SCXK(京)2019-0009)。将大鼠随机分为4组(n=6):安静WKY对照组(WKY-S)、安静SHR对照组(SHR-S)、低强度运动组(SHR-L)和中等强度运动组(SHRM)。重庆医科大学实验动物中心(实验动物使用许可证:SYXK(渝)2018-0003)统一饲养,每笼约5只,室温约22℃,正常光照周期(昼夜12∶12 h),湿度保持40%~45%,饮用水和饲料自由获取,所有实验环境达到特定的无病原体(SPF级)。本研究经重庆医科大学伦理委员会批准。
1.2 实验设计与运动方案
根据《心血管研究动物运动和训练方案指南》[8]的要求,运动组大鼠经过一周的适应性训练后,SHR-L组、SHR-M组分别以14 m/min(最大有氧速度的35%)、20 m/min(最大有氧速度的50%)在0°坡度的运动跑步机上跑步[9]。运动训练组运动负荷为每天跑步60 min,每周跑步5 d,共14周。大鼠运动结束后72 h的上午,进行血压、心率测定(避免急性运动的影响),三次测量结果计算平均值,之后取血和肾脏。
1.3 实验取材与检测指标
实验14周后,所有实验大鼠进行血压、心率测定后,称重,腹腔注射1%戊巴比妥麻醉。采用眼眶取血法,1 500 r/min离心10 min,分离血清,-80℃冻存。氧化酶法测定血清肌酐(serum creatinine,SCr),尿素酶-谷氨酸脱氢酶法测定血清尿素氮(blood urea nitrogen,BUN)。对大鼠实施安乐死,取出肾脏,剥离筋膜后将肾脏分为两部分,一部分用多聚甲醛浸泡固定后待切片病理组织学观察,采用苏木精与伊红(HE)染色观察肾组织形态,Masson染色观察肾组织胶原沉积情况,计算肾脏胶原容积分数;另一部分肾脏用冻存管储存并迅速转移至-80℃低温冰箱冻存,待Western blot检测肾脏AngⅡ、AT1R、TGF-β、α-SMA、CTGF蛋白表达。
1.4 血压心率测定
智能无创血压计-Softron BP-2010系列血压计,测定尾动脉收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP)、心率(heart rate,HR)。
1.5 肾脏病理组织学观察
肾脏病理组织学观察组织用4%多聚甲醛溶液固定24 h,石蜡包埋并利用病理切片机(RM2255,德国)制作4μm切片。用苏木精与伊红(HE)染色观察组织形态,Masson染色胶原纤维,正置相差显微镜(Leica DM4B,德国)下选取10个视野,观察胶原沉积情况,用图像分析软件(ImageJ 1.52v,美国)测量结缔组织面积与所测视野面积的比值作为胶原容积分数(collagen volumetric fraction,CVF)。
1.6 蛋白表达量检测
利用Western blot法检测肾脏AngⅡ、AT1R、α-平滑肌肌动蛋白(α-SMA)、TGF-β和CTGF蛋白表达量。分离肾皮质,匀浆后提取总蛋白,用考马斯亮蓝法测定蛋白浓度。取50μg蛋白样品在垂直电泳仪上经7.5%SDS-PAGE分离后转移至PVDF膜。兔抗鼠一抗4℃静置孵育过夜,羊抗兔二抗37℃孵育2 h。充分洗涤后,ECL发光成像,利用凝胶成像系统拍摄并扫描各条带灰度值。将各组与GAPDH灰度值的比值作为目的蛋白相对表达量。
1.7 统计学处理
2 结果
2.1 有氧运动后SHR大鼠血压水平变化
与WKY-S组比较,SHR-S组SBP、DBP和MAP均显著性升高(P<0.05);与SHR-S组比较,SHR-L组和SHR-M组血压水平降低(P<0.05),SHR-M组血压水平降低相较SHR-L组更明显(P<0.05,表1)。
2.2 有氧运动后SHR大鼠肾脏功能变化
肾脏功能检测显示,与WKY-S组比较,SHR-S组BUN和SCr升高(P<0.05);与SHR-S组比较,SHR-L组和SHR-M组BUN和SCr下降(P<0.05),SHR-M组BUN和SCr下降水平相较SHR-L组更明显(P<0.05,表1)。
Tab.1 Changes of blood pressure and kidney function of SHR after aerobic exercise(±s,n=6)
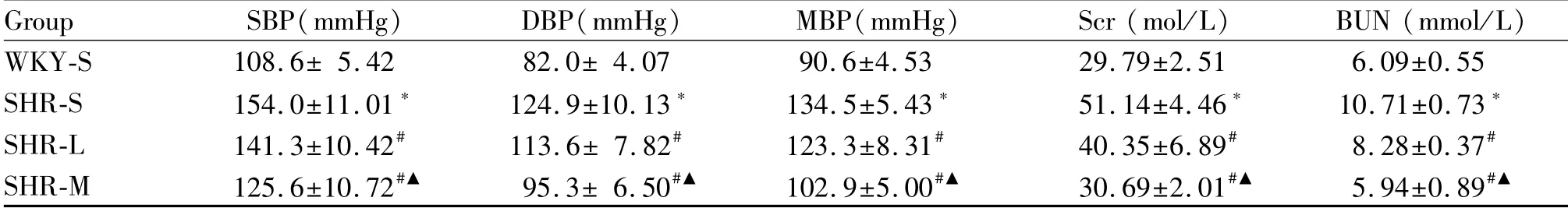
Tab.1 Changes of blood pressure and kidney function of SHR after aerobic exercise(±s,n=6)
SBP:Systolic blood pressure;DBP:Diastolic blood pressure;MBP:Mean arterial pressure;Scr:Serum creatinine;BUN:Blood urea nitrogen;WKY-S:Sedentary wistar kyoto rats;SHR-S:Sedentary spontaneously hypertensive rats *P<0.05 vs WKY-S;#P<0.05 vs SHR-S;▲P<0.05 vs SHR-L
Group SBP(mmHg) DBP(mmHg) MBP(mmHg) Scr(mol/L) BUN(mmol/L)WKY-S 108.6±5.42 82.0±4.07 90.6±4.53 29.79±2.51 6.09±0.55 SHR-S 154.0±11.01* 124.9±10.13* 134.5±5.43* 51.14±4.46* 10.71±0.73*SHR-L 141.3±10.42# 113.6±7.82# 123.3±8.31# 40.35±6.89# 8.28±0.37#SHR-M 125.6±10.72#▲ 95.3±6.50#▲ 102.9±5.00#▲ 30.69±2.01#▲ 5.94±0.89#▲
2.3 肾脏组织病理学观察与胶原容积分数(CVF)
四组大鼠肾脏HE染色与Masson染色显示病理变化见图1,肾实质细胞呈红色,胶原纤维呈蓝色。WKY-S组肾小球和肾小管形态结构正常,间质中仅有少量胶原纤维;SHR-S组肾小球萎缩,肾小管管腔扩张,间质增厚并存在大量胶原纤维,CVF高于WKY-S组(P<0.05);SHR-L组和SHR-M组肾小球、肾小管病变减轻,胶原纤维减少,CVF较SHR-S组分别降低(P<0.05)。SHR-M组胶原纤维减少相较SHR-L组更明显(表2)。
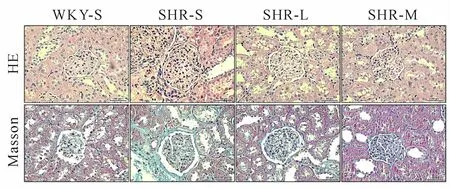
Fig.1 HE and Masson staining in renal tissues of rats in each group
2.4 AngⅡ、AT1R蛋白表达量的变化
与WKY-S组比较,SHR-S组AngⅡ、AT1R蛋白表达量上调(P<0.05);与SHR-S组比较,SHR-L组和SHR-M组AngⅡ、AT1R蛋白表达下调(P<0.05),SHR-M组AngⅡ、AT1R蛋白表达下调相较SHR-L组更明显(P<0.05,图2,表2)。
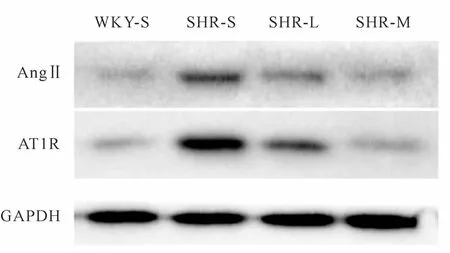
Fig.2 AngⅡand AT1R protein expressions in renal tissues of rats in each group
Tab.2 The levels of SHBG and LPSin rats(±s,n=10)
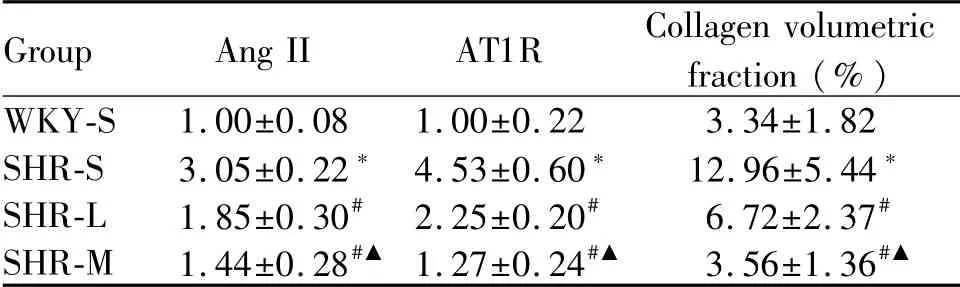
Tab.2 The levels of SHBG and LPSin rats(±s,n=10)
*P<0.05 vs WKY-S;#P<0.05 vs SHR-S;▲P<0.05 vs SHR-L
Group Ang II AT1R Collagen volumetric fraction(%)WKY-S 1.00±0.08 1.00±0.22 3.34±1.82 SHR-S 3.05±0.22*4.53±0.60* 12.96±5.44*SHR-L 1.85±0.30#2.25±0.20# 6.72±2.37#SHR-M 1.44±0.28#▲1.27±0.24#▲ 3.56±1.36#▲
2.5 TGF-β、α-SMA、CTGF蛋白表达量的变化
与WKY-S组比较,SHR-S组TGF-β、α-SMA、CTGF蛋白表达量上调(P<0.05);与SHR-S组比较,SHR-L组和SHR-M组TGF-β、α-SMA、CTGF蛋白表达下调(P<0.05),SHR-M组TGF-β、α-SMA、CTGF蛋白表达下调相较SHR-L组更明显(P<0.05,图3,表3)。
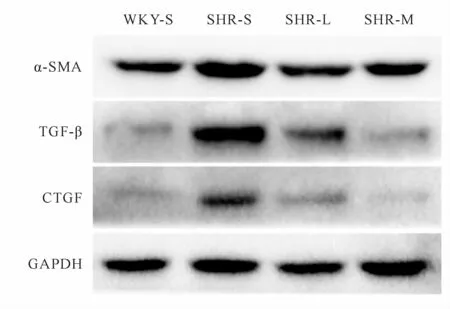
Fig.3 Expressions ofα-SMA,TGF-β,CTGF protein in renal tissues of rats in each group
Tab.3 The protein levels ofα-SMA,TGF-βand CTGF(±s,n=6)

Tab.3 The protein levels ofα-SMA,TGF-βand CTGF(±s,n=6)
*P<0.05 vs WKY-S;#P<0.05 vs SHR-S;▲P<0.05 vs SHR-L
Group α-SMA TGF-β CTGF WKY-S 1.00±0.11 1.00±0.11 1.00±0.23 SHR-S 2.05±0.22*4.49±0.41*4.30±0.45*SHR-L 1.47±0.17#2.47±0.17#2.73±0.61#SHR-M 1.26±0.14#▲1.26±0.11#▲1.05±0.20#▲
3 讨论
本研究结果表明:(1)14周的规律有氧运动可以降低SHR血压,中等强度有氧运动降血压效果更明显。(2)SHR肾功能发生损伤,14周规律的有氧运动可以减轻SHR肾损伤程度且中等强度有氧运动较低强度有氧运动减轻肾损伤的作用更显著。(3)SHR出现肾纤维化,经过14周的规律有氧运动减轻了肾纤维化程度,中等强度有氧运动较低强度有氧运动减轻肾纤维化的效果更明显。(4)运动后SHR肾脏AngⅡ-AT1R-TGF-β促纤维化信号转导途径受到抑制,AngⅡ、AT1R、TGF-β、α-SMA、CTGF蛋白表达下调,且中等强度有氧运动组较低强度有氧运动组下调效果更明显。
运动可以改善高血压状态,且本研究在设置不同强度有氧运动的对比实验中显示,中等强度有氧运动组的降血压效果更明显。其他相关研究对此有相同性结论:窦丽的研究表明[10]持续有规律的有氧运动对SHR的降压效果持续有效,且坚持运动数周后降压效果更明显。肾素-醛固酮-血管紧张素系统(RAAS)活化会促进血管紧张素Ⅱ的血管收缩作用升高血压[11]。李晔研究表明[12]长期中等强度跑台运动对SHR大鼠血浆、胸主动脉、心脏和肾脏的内皮素-1和血管紧张素Ⅱ的分泌均有明显的下调作用,提示有氧运动对SHR的降压作用是通过影响内皮素-1和血管紧张素Ⅱ的产生和释放来实现的。黄超清等人[13]通过12周的运动跑台实验,阐释了运动训练能有效降低SHR的血压和SHR肾损害的严重程度;Almeida,J.A等人[14]研究发现,高强度间歇有氧训练可降低SHR的血压。本实验在有氧运动可以下调AngⅡ活性的假设前提下,试图阐明有氧运动可以通过抵抗AngⅡ的血管收缩作用来降低血压,实验结果提示肾脏中AngⅡ表达量降低和SHR的血压下降明显相关。本研究表明规律的有氧运动可以减轻SHR肾损伤程度,且中等强度有氧运动较低强度有氧运动减轻肾损伤的作用更显著。但是牛衍龙等人[15]的研究表明,大鼠6周递增负荷游泳训练后肾功能受损,出现蛋白尿,此现象的可能原因为过度训练诱导肾脏内部及循环系统中RAAS持续兴奋,下调Nephrin蛋白的表达,进而导致肾脏结构与功能异常。
通过组织病理学观察和胶原容积分数分析,我们发现SHR出现肾纤维化,经过14周规律的有氧运动减轻肾纤维化程度,中等强度有氧运动较低强度有氧运动减轻肾纤维化的效果更明显。TGF-β通路被激活促进上皮细胞-间充质细胞转化(epithelial-mesenchymal transdifferentiation,EMT),从而促进AngⅡ诱导肾脏纤维化[16]。AngⅡ作为促纤维化细胞因子,通过EMT有关的各种途径调节肾细胞的增殖,细胞外基质的合成和降解,诱导转化生长因子-β(TGF-β)的下游靶标结缔组织生长因子(CTGF)的表达[17]。Silva SD等人[6]实验研究表明有氧运动训练可以通过下调肾素-血管紧张素-醛固酮系统(RAAS)的活性,特异性降低SHR肾血管AngⅡ含量来降低血压和改善肾脏纤维化。Ciampone S等人研究表明[18],长期运动对AngⅡ受体表达产生调节作用,可以使肾脏中AT1R表达降低。在以上研究基础上,本研究重点关注运动强度的差异对SHR肾纤维化的影响。实验结果表明,中等强度有氧运动更有利于下调RAAS活性,降低SHR肾血管AngⅡ含量,减少通路下游血管紧张素Ⅰ型受体(AT1R)和AngⅡ的结合,抑制AngⅡ-AT1R-TGF-β通路上游的传导,从而延缓SHR肾纤维化的发展进程。
王欣彤[19]在实验研究中阐明血管紧张素Ⅱ-血管紧张素1型受体-结缔组织生长因子(AngⅡ-AT1R-CTGF)的过度活跃是高血压肾损害的重要原因,阻断其中任何一个因子,不仅可以降血压,而且还有肾脏保护作用。付常喜等人研究显示[7]8周跑台运动后SHR有氧运动组的TGF-β和CTGF蛋白表达量下调,从而改善高血压诱导的肾脏纤维化。12周运动跑台训练通过降低转化生长因子-β(TGFβ),磷酸化-Smad2/3(p-Smad2/3)的表达,减弱结缔组织生长因子(CTGF)纤维化途径,改善高血压肾纤维化程度[13]。本研究设定低、中强度的有氧运动强度梯度,实验结果表明,中等强度有氧运动更明显地降低SHR的TGF-β、α-SMA、CTGF蛋白表达,提示AngⅡ-AT1R-TGF-β信号通路被抑制,有效地减轻SHR的肾纤维化。但是Almeida JA等人[14]研究发现,8周高强度间歇有氧训练可降低SHR的血压并下调RAAS活性。以上研究结果的差异可能与运动类型不同有关,需要进一步的实验论证。
本课题组前期研究证明[9],低中强度的运动训练可以激活SIRT1/3-AMPK通路,延缓SHR的病理生理进展,降低血压,改善血管功能。SIRT1/3-AMPK通路激活可以对抗纤维化[20],我们推测运动改善肾纤维化可能与SIRT1/3-AMPK通路有关,下一步准备进行验证。本次研究只设计低中强度有氧运动组的对比实验,对其他不同运动类型、不同运动强度比如高强度或高强度间歇性运动对高血压肾损害影响的作用效果与机制,还有待科研人员开展进一步的研究,为临床医学疾病治疗提供更全面、完整的参考依据。
综上所述,AngⅡ-AT1R-TGF-β通路的过度活跃会导致SHR肾纤维化、肾功能进行性下降;有氧运动可以通过下调AngⅡ-AT1R-TGF-β信号通路抑制高血压肾病大鼠肾脏纤维化并提高肾功能;中等强度的有氧运动可以更好地改善SHR肾功能损害、抑制SHR肾纤维化。
