H9N2流感病毒诱导MDCK细胞自噬对病毒复制的影响
2022-09-08李春红董玉龙李欣蕊
李春红, 王 丽, 董玉龙, 李欣蕊, 杨 昊, 魏 鑫, 徐 彤
(1.河北北方学院预防兽医学重点实验室,河北张家口 075000;2.河北北方学院理学院,河北张家口 075000)
H9N2流感病毒属于A型流感病毒,易使家禽和猪受到感染,同时也可感染人(殷斌等,2015;王斌和童光志,2012;Myers,2007)。1966年,从患有呼吸道疾病的火鸡中分离出H9N2亚型禽流感病毒 (Homme和Easterday,1970)。H9N2亚型禽流感容易导致鸡产蛋下降,与其他病原体混合感染而致鸡的死亡率升高。流感病毒在猪体内出现了混合感染的情况。Xu等(2004)从山东发病率和致死率较高的猪群中分离到了H9N2病毒。Peiris等证实中国东南地区猪群中存在H9N2禽流感和H3N2猪流感病毒。此外,H9N2流感病毒在禽类和猪群中不断感染和传播为流感病毒进一步感染人 类 提 供 了 条 件 (Xu等 ,2018;Pan等 ,2018)。2016年四川省出现人感染H9N2流感病毒危重临床病例的报道(Ninomiya等,2002)。可见,H9N2流感病毒引起的病毒性传染病,严重威胁着公众健康,给社会带来了沉重的经济负担。对H9N2流感病毒的研究具有十分重要的公共卫生学意义。
细胞自噬是细胞内的一种“自食”的现象,是溶酶体对自身结构的降解,释放出游离小分子供细胞回收利用的正常动态生命过程,是细胞内的再循环系统。机体应对外来病原微生物感染时启动免疫应答,细胞自噬在此发挥重要的作用(Kundu和Thompson,2008)。通过抑制自噬,在发生自噬的后期病毒免于被降解(Levine等,2011),抑制自噬可以促进病毒粒子的生成和释放。另有研究报道,自噬参与流感病毒的复制(Yeganeh等,2015;Zhou等,2009)。 在H9N2流感病毒感染的A549细胞中,抑制自噬后流感病毒的滴度和TCID50均显著降低(Zhou等,2009)。细胞自噬到底是促进病毒的自身复制还是清除细胞内的病毒有待进一步研究。MDCK细胞因其病毒生产效率高、快速增殖和低突变率而被认为是生产流感病毒的有效宿主 (Merten等,1999;Taub等,1979)。因此本研究进行了H9N2流感病毒诱导MDCK细胞发生自噬及其对病毒复制影响的研究。
1 材料和方法
1.1 毒株与细胞H9N2流感病毒A/swine/Hebei/012/2008(H9N2)由河北北方学院预防兽医学重点实验室分离保存;犬肾上皮细胞(MDCK细胞)由河北北方学院预防兽医学重点实验室保存。
1.2 主要试剂DMEM培养基、胎牛血清等常用细胞培养相关试剂均购自浙江天杭生物科技有限公司;雷帕霉素(Rapamycin)、3-甲基腺嘌呤(3-MA) 购 自Sigma公 司 ;Polybrene和 嘌 呤 霉 素(Puromycin)均购自圣克鲁斯生物公司;自噬标记慢病毒(GFP-LC3)购自汉恒生物公司;总RNA提取试剂盒和实时荧光定量PCR试剂盒购自北京赛恩诺尔公司。
1.3 细胞培养与传代MDCK细胞放于DMEM完全培养基中,常规细胞培养条件培养。观察细胞生长状态,选取符合试验要求的MDCK细胞,弃去培养基,加入PBS洗涤细胞。之后加入EDTA-胰酶约1 mL,置细胞培养箱消化0.5~1 min。待细胞瓶成雾状时消化即可终止。收集处于分散均匀状态的细胞,分装至新的细胞瓶或者培养板备用。
1.4 MDCK细胞系的构建与结果观察
1.4.1 慢病毒感染细胞最适MOI值的确定MDCK细胞铺96孔板,培养过夜。吸去培养好细胞的培养基,加入新培养基,随后GFP-LC3慢病毒按MOI为1、5、10、20、40、100加入MDCK细胞中使其混合均匀。慢病毒感染细胞需要Polybrene的参与,随即加入预先准备好的Polybrene,终浓度为1.5 μg/mL。待感染MDCK细胞24 h后,需更换培养液。感染48 h后进行荧光观察,72 h后感染率80%左右,确定为MOI值。
1.4.2 GFP-LC3慢病毒感染MDCK接种24孔板培养过夜。感染前吸弃培养好细胞的培养基,更换新培养基,按1.4.1确定的MOI将慢病毒加入细胞中使其混匀。加入Polybrene,使其终浓度为1.5 μg/mL。慢病毒感染24 h,吸弃培养液,加入新培养液。感染48 h,观察GFP表达效率,更换含有终浓度为0.5 μg/mL Puromycin的新培养液。定时更换,使其Puromycin终浓度升至2.0 μg/mL。锁定处于稳定表达GFP-LC3的MDCK细胞株,直至没有受到慢病毒感染的细胞被全部处理掉。将获得的MDCK细胞株命名为MDCK/GFP-LC3。
1.4.3 激光共聚焦观察MDCK/GFP-LC3细胞铺小皿,培养过夜后接种H9N2流感病毒,感染24 h后按常规洗涤方法处理,即可进行激光共聚焦拍照分析影像资料。
1.5 病毒感染与药物处理MDCK细胞预先经H9N2流感病毒处理,MOI为2。置37℃、5% CO2培养箱中作用1 h后经PBS洗涤处理,继续培养。待12、24 h和36 h时分别收集细胞进行检测。H9N2流感病毒感染+药物处理组:3-MA(终浓度为8 mM)作用MDCK细胞1 h后接种H9N2流感病毒,Rapamycin(终浓度为100 nM)作用MDCK细胞12 h接种H9N2流感病毒,使H9N2流感病毒在37℃、5% CO2培养箱中作用1 h后,用处理过的PBS洗涤,DMEM继续培养,感染后12、24、36 h收集细胞进行检测。
1.6 细胞活性和TCID50的测定 参照CCK8试剂盒说明书进行细胞活性检测。96孔板中每孔缓慢加入10 μL CCK8溶液,细胞培养,二氧化碳培养箱中孵育2 h后,检测细胞在450 nm处的吸光光度(OD)值。细胞存活率%=(给药组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。选取3-MA和Rapamycin两种自噬剂,各给药组按照预定的浓度梯度加入相应的药物。
按照常规方法检测病毒的半数细胞培养物感染量 (TCID50),用Reed-Muench法计算病毒的TCID50。
1.7 实时荧光定量PCR测定 按照RNAeasyTM病毒RNA抽提试剂盒提取细胞总RNA,反转录后进行Real-time PCR测定。 测定在ABI 7300 system中进行,20 μL体系,用内参GAPDH处理,由2-△△Ct公式计算mRNA的相对表达量。
1.8 数据分析 利用Excel 2007对试验数据进行初步处理;采用SPSS 20.0软件进行单因子方差分析后进行Tukey’s多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 稳定表达GFP-LC3 MDCK细胞系的鉴定研究报道,细胞自噬使LC3-II的合成显著增加,LC3蛋白可被募集到自噬体膜上发生点状聚集(Martinet等,2006;Kirisako等,1999)。 本试验激光共聚焦得出,MDCK/GFP-LC3细胞呈现均匀的绿色荧光,说明GFP-LC3在MDCK中稳定表达(图1),此结果将用于H9N2流感病毒感染后自噬发生的判断。

图1 激光共聚焦观察GFP-LC3在MDCK细胞中的表达
2.2 H9N2流感病毒感染MDCK/GFP-LC3后绿色荧光的点状聚集 转染细胞中出现绿色荧光的点状聚集,可作为检测细胞自噬发生的方法(Mizushima等,2010)。本试验利用H9N2流感病毒感染MDCK/GFP-LC3细胞,激光共聚焦观察MDCK/GFP-LC3绿色荧光的点状聚集。试验结果如图2所示,对照组的绿色荧光呈现弥散的均匀分布 (图2A),而H9N2流感病毒感染MDCK/GFP-LC3细胞24 h时弃去培养基,PBS洗涤3次,观察到了绿色荧光的点状聚集(图2B)。由此得出,H9N2流感病毒感染MDCK/GFP-LC3细胞发生细胞自噬。

图2 H9N2流感病毒感染MDCK/GFP-LC3绿色荧光的点状聚集
2.3 自噬抑制剂与自噬诱导剂对MDCK细胞生长活性的影响 利用自噬抑制剂3-MA和自噬诱导剂Rapamycin对细胞自噬进行调控,检测H9N2流感病毒感染MDCK细胞后自噬的发生对病毒复制的影响。以CCK8试剂盒检测3-MA和Rapamycin对细胞活性的影响。
分 别 用20、40、100、160 nΜ 和220 nΜ 的Rapamycin处理MDCK细胞,结果如图3A显示,与空白对照组相比较,无论是低剂量Rapamycin处理组,还是高剂量Rapamycin处理组,细胞的活性均没有显著差异(P>0.05)。分别用2、4、8、16 mM和24 mM 3-MA处理MDCK细胞,结果如图3B显示,与空白对照组相比较,无论是低剂量3-MA处理组,还是高剂量3-MA处理组,细胞的活性均没有明显变化(P>0.05)。因此,给定浓度的自噬诱导剂Rapamycin和自噬抑制剂3-MA处理MDCK细胞,结果显示细胞的活性均没有呈现明显的变化。
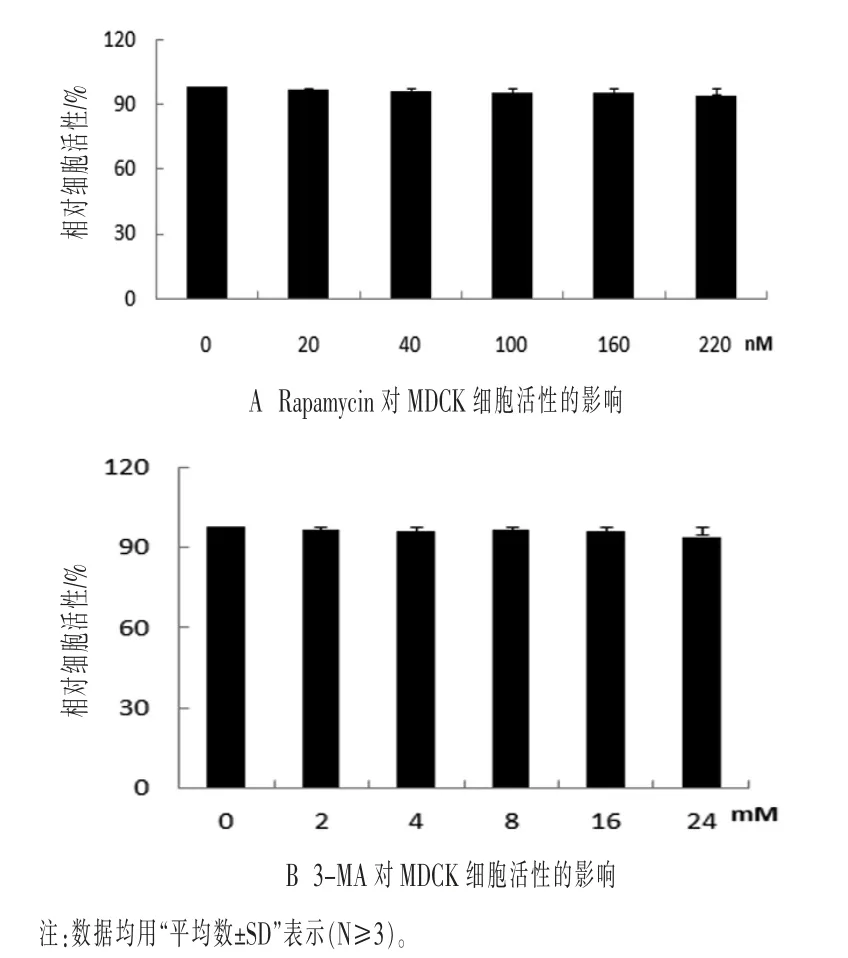
图3 CCK8检测Rapamycin和3-MA对MDCK细胞活性的影响
2.4 自噬促进剂对H9N2流感病毒增殖的影响为进一步探讨细胞自噬对于H9N2流感病毒复制的影响,利用Rapamycin诱导细胞自噬,检测NP的mRNA水平以及病毒的滴度。结果如图4所示,Rapamycin处理MDCK细胞后,接种H9N2流感病毒,可以显著增加NP的mRNA水平和病毒滴度(P<0.01)。因此,Rapamycin在调节细胞自噬方面发挥了重要的作用,诱导细胞自噬可以促进H9N2流感病毒的增殖,细胞自噬参与H9N2流感病毒复制的过程。

图4 Rapamycin对于NP mRNA水平和病毒滴度的影响
2.5 自噬抑制剂对H9N2流感病毒增殖的影响为探讨细胞自噬是否参与H9N2流感病毒复制的过程,利用3-MA处理MDCK细胞,接种H9N2流感病毒,分析NP的mRNA水平,结果如图5所示,与H9N2流感病毒感染组相比,3-MA处理MDCK细胞后,接种H9N2流感病毒后的12、24 h和36 h均能显著降低NP的mRNA水平和病毒滴度(P<0.01)。可见,3-MA在调节细胞自噬方面发挥了重要的作用,抑制细胞自噬阻碍H9N2流感病毒复制,细胞自噬参与H9N2流感病毒复制的过程。

图5 3-MA对于NP mRNA水平和病毒滴度的影响
3 讨论
病毒诱导的细胞自噬是一种常见的自噬形式。自噬可以清除细胞内没有用处的物质,也可以清除细胞内受感染的细菌和病毒。然而有研究认为在流感病毒感染细胞后,流感病毒能够通过诱导细胞自噬,抑制自噬体与溶酶体融合,自噬体在细胞内积累,阻止了病毒抗原呈递,促使病毒复制,因此对细胞有害对病毒有利。然而有研究证实在流感病毒感染的细胞中,抑制自噬导致在细胞培养上清液中流感病毒的滴度显著降低。
基于上述前人研究结果,本研究利用自噬抑制剂3-MA抑制细胞自噬,实时定量PCR结果显示NP的mRNA的水平显著降低,TCID50结果显示病毒的滴度显著降低,说明抑制细胞自噬可以降低H9N2流感病毒的复制。进而本研究利用自噬诱导剂Rapamycin诱导细胞自噬,实时定量PCR显示NP的mRNA的水平显著升高,TCID50结果显示病毒的滴度也显著上升,说明诱导细胞自噬可以促进流感病毒的复制。
在生物进化过程中,自噬已经发展成为生物体内一种必不可少的细胞机制。在MDCK细胞中,细胞自噬可以促进流感病毒的复制,提示细胞自噬参与H9N2流感病毒的致病机理。
4 结论
在MDCK细胞中,自噬抑制剂可以降低NP的mRNA水平以及病毒的滴度,抑制自噬可降低H9N2流感病毒的复制。自噬促进剂诱导细胞自噬,NP mRNA的表达水平增加以及病毒的滴度也上升,可以促进H9N2流感病毒的复制。
