K+、Ca2+对酿酒酵母的蔗糖乙醇发酵及理化特性的影响
2022-08-31袁瑞祥伍时华龙秀锋
袁瑞祥,伍时华,龙秀锋
(1.广西科技大学生物与化学工程学院,广西 柳州 545006;2.广西糖资源绿色加工重点实验室,广西 柳州 545006)
0 引言
乙醇以其清洁可再生等优势,为国家医疗卫生、燃油等方面做出多重贡献[1],但其生产规模受原料所限。甘蔗糖蜜是制糖业的副产品,含有约50%的可发酵糖、蛋白质、维生素和微量元素,具有产量大、价格低廉等特点[2]。但甘蔗糖蜜中的金属离子、胶体、色素、糠醛等物质的存在,会影响酵母细胞的生长代谢[3]。糖蜜中的金属离子一般来自于甘蔗施肥、制糖过程及石灰澄清脱色过程[4],金属离子一方面可以与细胞内特定蛋白质结合,形成更稳定的惰性酶复合物,直接干扰许多酶的活性[5];另一方面可以使酵母细胞生成过量活性氧(Reactive Oxygen Species,ROS)引起细胞氧化损伤、DNA损伤、破坏细胞壁的完整性,影响细胞的生长代谢[6]。低外部K+浓度可以弥补胁迫下细胞内离子的损失,而较高的K+浓度会破坏细胞膜结构对酵母细胞产生毒性作用[7]。据报道,K+、Ca2+可以通过影响蔗糖转化酶活性对酵母表现出较强的抑制作用[8]。过量金属离子会增大发酵环境的渗透压,抑制酵母细胞生长代谢,使得糖蜜发酵的乙醇浓度偏低,不利于糖蜜乙醇产业的长久可持续发展[9]。
本文通过电感耦合等离子体质谱(Inductively Coupled Plasma Mass Spectrometry,ICP-MS)对甘蔗糖蜜中金属离子的含量进行测定,通过外源添加含量较高的金属离子探究其对酵母细胞生长的影响。以对酵母生长抑制较强的K+、Ca2+为研究对象,探究其对蔗糖乙醇发酵过程中细胞生长、糖代谢和乙醇生成的影响;进一步通过扫描电镜(Scanning electron microscopy,SEM)、傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR)分析高浓度K+、Ca2+胁迫条件下酵母细胞形态、细胞壁结构成分,测定胞内海藻糖含量变化,探究K+、Ca2+对酿酒酵母细胞理化特性的影响,为实现高浓度甘蔗糖蜜乙醇发酵和选育耐受性菌株提供一定的研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本论文所采用菌种为耐高糖的酿酒酵母GJ2008(Saccharomyces cerevisiaeGJ2008),由广西科技大学发酵工程研究所提供。
1.1.2 化学试剂
KCl、CaCl2、MgCl2·6H2O、FeCl3·6H2O、MnCl2·4H2O、NaCl、硫酸、三氯乙酸(AR),西陇科学股份有限公司;酵母粉、蛋白胨(BR),赛默飞世尔科技(中国)有限公司;乙腈,成都市科隆化学品有限公司;D-海藻糖、蒽酮,北京索莱宝科技有限公司;甘油含量测定试剂盒,泉州市睿信生物科技有限公司;葡萄糖(BR)、戊二醛(AR),天津市科密欧化学试剂有限公司;蔗糖(市售)。
1.2 仪器与设备
赛里安456GC气相色谱仪,荷兰赛里安仪器公司;HITACHI高效液相色谱仪,日本株式会社日立制作所;Agilent 7700电感耦合等离子体质谱仪,安捷伦科技(中国)有限公司;Alpha1-2LDplus真空冷冻干燥机,德国CHRIST公司;Phenom飞纳台式扫描电镜,上海复纳科学仪器有限公司;FTIR傅里叶变换红外光谱仪,上海兴和仪器有限公司;UV-8000S紫外可见分光光度计,上海元析仪器有限公司。
1.3 方法
1.3.1 培养基及种子液的制备
一(二)级种子培养基:葡萄糖20(50)g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH自然,115℃高压蒸汽灭菌20 min。
蔗糖发酵培养基:蔗糖250 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH自然,115℃高压蒸汽灭菌20 min。
从斜面试管中挑取1环酿酒酵母GJ2008接种至一级种子培养基(250 mL装液量50 mL),30℃、150 r/min摇床中培养12 h;将10倍浓缩的菌悬液以1%(v/v)接入二级种子培养基(500 mL装液量200 mL)中继续培养8 h,离心弃上清液,加无菌水稀释为10倍浓缩种子悬液。
1.3.2 甘蔗糖蜜中总糖及金属离子测定
将甘蔗糖蜜与超纯水1:1稀释搅拌均匀,缓慢沿杯壁滴入浓硫酸调pH至3,90℃水浴加热酸化30 min,静置冷却后,用新配置的15%石灰乳调pH至7.0,8000 r/min离心20 min除去沉淀[10]。采用高效液相色谱仪测定上清液中总糖含量,检测分析条件参照曾令杰等[11]和GB/T 9735-2008国家标准[12],通过ICP-MS测定金属离子种类及含量。
1.3.3 外源添加金属离子对酵母细胞生长的影响
将10倍浓缩菌悬液接种1%(v/v)至蔗糖发酵培养基(500 mL装液量200 mL),根据1.3.2所测金属离子种类及含量,分别添加至培养基中作为处理组,以未添加的菌液作为对照组,30℃、150 r/min摇床培养,定时取样,测定酵母菌悬液在560 nm下的吸光度值,以发酵时间为横坐标,吸光度值为纵坐标,绘制生长曲线。
1.3.4 K+、Ca2+对酵母的蔗糖乙醇发酵过程的影响
根据所测总糖含量及理论产15%(v/v)乙醇而配制250 g/L蔗糖发酵培养基,根据1.3.3试验结果,分别添加15.64 g/L K+、8.17 g/L Ca2+于250 g/L蔗糖发酵培养基中作为处理组,以未添加K+、Ca2+的250 g/L蔗糖乙醇发酵为对照组;用透气膜加牛皮纸密封三角瓶口后(微通氧发酵环境)于30℃、150 r/min摇床中培养36 h。定时取样离心,沉淀用于测定酵母菌悬液在560 nm下的吸光度值,绘制生长曲线;上清液采用高效液相色谱仪用于测定蔗糖、葡萄糖、果糖含量,检测分析条件参照曾令杰等方法[11];采用气相色谱仪测定发酵过程乙醇的生成情况,检测分析条件参照吴佳敏等[13]方法。
1.3.5 K+、Ca2+对酵母细胞形态的影响
按照1.3.4的培养方法,取9 h的发酵液3 mL,5000 r/min离心10 min,弃上清;加入2.5%戊二醛1 mL,4℃固定过夜,离心收集菌体;用PBS缓冲液清洗3次,30%~100%的乙醇梯度脱水处理,5000 r/min离心10 min收集菌体,真空冷冻干燥后喷金,用扫描电子显微镜观察酵母菌的形态变化。
1.3.6 K+、Ca2+对酵母细胞壁分子结构的影响
按照1.3.4的培养方法,取9 h的发酵液3 mL,5000 r/min离心10 min,弃上清;用PBS缓冲液清洗3次,真空冷冻干燥后,将干燥的酵母菌体与溴化钾研磨均匀压片,用FTIR仪对干燥酵母细胞进行分析。
1.3.7 K+、Ca2+对酵母胞内海藻糖含量的影响
参考安佳星等[14]的海藻糖测定方法,将活化后的酵母细胞于250 g/L蔗糖培养基培养10 h后,分别添加15.64 g/L K+、8.17 g/L Ca2+作为处理组继续培养;分别取两份处理0 h、3 h、6 h培养液各4 mL,12000 r/min离心3 min,弃上清,沉淀用水洗涤3次,其中一份烘干称重,另一份加入4 mL 0.5 mol/L三氯乙酸冰浴1 h,离心后取1 mL上清液于冷水浴的比色管中,加入5 mL硫酸蒽酮试剂,混匀后沸水浴10 min,再冰水浴中冷却后测定620 nm下的吸光度值。绘制海藻糖标准曲线,得到回归方程:y=10.015x+0.0221(R2=0.9994)。
1.4 计算公式
(1)残总糖浓度(g/L)=残果糖(g/L)+残葡萄糖(g/L)+残蔗糖(g/L)×1.05;
(2)糖类变化速率[g/(L·h)]=糖类减少量(g/L)/取样间隔时间(h);
(3)乙醇生成速率[g/(L·h)]=乙醇生成量(g/L)/取样间隔时间(h)。
1.5 数据统计与分析
论文数据均为3次平行实验的平均值。采用软件SPSS 19.0和Origin Pro 9.5软件对数据进行显著性分析和图表的绘制。
2 结果与分析
2.1 甘蔗糖蜜中总糖、金属离子含量测定及其对酿酒酵母细胞生长的影响
2.1.1 甘蔗糖蜜中总糖及金属离子含量测定
甘蔗糖蜜中的金属离子一般来自甘蔗种植施肥、制糖和糖蜜预处理过程[9],本研究采用热酸法对甘蔗糖蜜进行预处理,测得预处理后的糖蜜样液总糖含量为273.3±4.09 g/L,共检测到58种金属离子,所测含量较高的金属离子种类及含量结果如表1所示。大多数金属离子在甘蔗糖蜜中含量较低,含量较高的金属离子种类分别为K+(15.64 g/L)、Ca2+(8.17 g/L)、Mg2+(2.76 g/L)。周嫄[10]研究了不同预处理方式对糖蜜中金属离子含量的影响,通过热酸法预处理测得糖蜜中K+含量为16.46 g/L。王进[15]的研究中,广西金光糖厂甘蔗糖蜜中K+含量为16.68 g/L、Mg2+含量为2.54 g/L,与本研究结果相似。而杨丽峰[16]所测糖蜜中K+(6.62 g/L)、Ca2+(1.48 g/L)离子含量与本论文所测结果有较大的差别,这可能与甘蔗产地、制糖及预处理方式的不同有关。

表1 甘蔗糖蜜中金属离子种类及含量
2.1.2 甘蔗糖蜜中金属离子对酿酒酵母细胞生长的影响
适量金属离子可通过降低质膜通透性保护线粒体功能,对细胞生长、活力和乙醇代谢有显著影响[17],但过量金属离子会对酵母产生毒害作用[18]。根据甘蔗糖蜜中金属离子含量测定结果,外源添加含量较高的前6种金属离子进行250 g/L蔗糖乙醇发酵试验,定时取样测定菌液OD值绘制细胞生长曲线,并结合细胞生长速率,研究其对酿酒酵母GJ2008生长的影响,结果如图1所示。
综合分析图1的细胞生长曲线和细胞生长速率可知,与未添加金属离子的对照组比较,分别添加K+、Ca2+试验组的细胞生长受到较强抑制,相比之下,添加Ca2+试验组的细胞生长受到的抑制比添加K+试验组的强,表现在(1)细胞生长减慢,例如发酵至12 h的菌体OD值分别比对照组减少16.3%、24.21%,0~12 h的细胞生长速率分别比对照组降低29.72%、42.7%;(2)达到生长稳定期的快速生长时间延长6 h;(3)发酵36 h的细胞生物量相对较低,比对照组分别减少9.83%、18.45%。据此,本文进一步研究K+、Ca2+对酿酒酵母的蔗糖乙醇发酵和理化特性的影响。

图1 添加不同金属离子的250 g/L蔗糖乙醇发酵过程中酿酒酵母GJ2008细胞生长曲线及生长速率图
2.2 K+、C a2+对酿酒酵母蔗糖乙醇发酵的影响
2.2.1 K+、Ca2+对蔗糖乙醇发酵的糖代谢影响
蔗糖乙醇发酵过程中,酿酒酵母通过蔗糖水解酶将胞外蔗糖水解为葡萄糖和果糖,利用其进行生长代谢,残葡萄糖和残果糖的含量由蔗糖水解生成量与同期消耗量所决定[19]。结果如图2所示。

图2 添加K+、Ca2+的250 g/L蔗糖乙醇发酵过程中残糖曲线及蔗糖水解和果糖、葡萄糖消耗速率图
由图2A的残蔗糖曲线及水解速率可知,对照组在发酵6~12 h蔗糖水解速率最快(26.88 g/(L·h)),蔗糖大量水解(占比60.88%)。与对照组相比,分别添加K+、Ca2+试验组的蔗糖水解缓慢、水解时间延长,发酵6~12 h的蔗糖水解量分别降低48.49%、45.67%,最大蔗糖水解速率分别比对照组降低了38.06%、45.72%,且分别在滞后12 h、18 h两处理组蔗糖才几乎水解完全(0.059 g/L、1.61 g/L)。
由图2B的残果糖曲线及消耗速率可知,对照组在发酵6~12 h果糖消耗速率达到最大(9.35 g/(L·h)),果糖消耗量最多(56.08 g/L),发酵12 h的残果糖浓度最高(56.4 g/L),发酵42 h仍有剩余(30.1 g/L)。与对照组相比,分别添加K+、Ca2+试验组的残果糖消耗缓慢,6~12 h的果糖消耗量分别降低56.58%、58.42%,最大果糖消耗速率明显降低(35.29%、56.04%),残果糖浓度分别滞后12 h、18 h达到最大值(56.2 g/L、69.6 g/L),且42 h的残果糖浓度偏高,分别是对照组的1.68倍、1.85倍。
由图2C的残葡萄糖曲线及消耗速率可知,对照组在发酵6~12 h葡萄糖消耗速率达到最大12.58 g/(L·h),葡萄糖消耗量最多(75.48 g/L),发酵12 h残葡萄糖浓度最高(28.6 g/L),42 h已消耗完全。与对照组比较,分别添加K+、Ca2+试验组的残葡萄糖消耗缓慢,发酵6~12 h的葡萄糖消耗量分别降低56.58%、58.42%,最大葡萄糖消耗速率分别比对照组降低了42.37%、51.99%,残葡萄糖浓度均滞后6 h达到最大值(31.35 g/L、41.75 g/L),且发酵42 h的残葡萄糖浓度偏高(14.2 g/L、19.55 g/L)。
2.2.2 K+、Ca2+对酿酒酵母的蔗糖乙醇发酵过程总糖消耗与乙醇生成的影响
在蔗糖乙醇发酵过程中,蔗糖水解产生的葡萄糖、果糖经糖酵解途径生成丙酮酸[19],在丙酮酸脱羧酶的作用下转化为乙醛最终生成乙醇。本研究通过定时取样测定乙醇浓度和计算总糖含量,研究K+、Ca2+对酵母细胞总糖消耗、乙醇生成的影响,结果如图3所示。

图3 添加K+、Ca2+的250 g/L蔗糖乙醇发酵过程中残总糖、乙醇生成曲线及残总糖消耗、乙醇生成速率图
总糖消耗的实质是蔗糖水解产生的葡萄糖和果糖消耗。由图3可知,对照组在发酵6~12 h总糖消耗及乙醇生成速率均达到最大值(21.93 g/(L·h)、7.65 g/(L·h)),发酵6~24 h,酵母细胞生长活力旺盛,总糖大量消耗(占比70.37%),同期乙醇快速积累(占比81.09%),发酵24 h后随着乙醇浓度升高抑制细胞活性、营养物质减少等因素,残总糖浓度与乙醇生成量趋于平稳。与对照组比较,添加K+、Ca2+试验组的总糖消耗、乙醇生成缓慢,最大总糖消耗速率分别降低39.31%、54.76%,最大乙醇生成速率分别降低37.91%、50.07%,发酵6~24 h的总糖消耗量分别降低11.9%、27.85%,同期乙醇生成量分别减少20.64%、37.87%;发酵42 h的残总糖浓度高、乙醇生成量低,残总糖浓度分别是对照组的2.16倍、2.79倍,乙醇终浓度与对照组相比分别减少18.03%、23.81%。表明高浓度K+、Ca2+存在时,酵母细胞的糖代谢及发酵产乙醇性能受到较强抑制,且Ca2+对酵母的综合抑制效果较K+更明显。
2.3 K+、C a2+对酵母细胞理化特性的影响
2.3.1 K+、Ca2+对酵母细胞形态的影响
为探究K+、Ca2+对酵母细胞形态的影响,本研究采用扫描电子显微镜观察K+、Ca2+胁迫条件下酿酒酵母细胞形态的变化情况,结果如图4所示。

图4 K+与Ca2+处理对酿酒酵母GJ2008形态变化的影响(*10000)
正常发酵的酵母细胞(图4A)形态完整、分散均匀,出芽率高、饱满圆润、不粘连,体积较大且无褶皱破损;而K+、Ca2+处理组中的酵母细胞(图4B、4C)表面粗糙、存在较多絮状物,体积偏小、胞间粘结成团块状,部分表面出现凹陷、空洞、褶皱变形;由SEM图可知,发酵体系中存在高浓度的金属离子K+、Ca2+时,酿酒酵母细胞形态受到破坏,表面存在絮状物且出现胞间粘连、堆积现象,使得酵母细胞物质运输及信息传递功能受阻,影响细胞正常生长与代谢,导致酵母细胞发酵能力下降,甚至导致细胞损伤与死亡[20]。
2.3.2 FTIR分析K+、Ca2+对酵母细胞结构的影响
细胞壁外层含丰富甘露糖蛋白,内层主要物质为β-葡聚糖与少量几丁质,这些物质富含大量活性基团,对细胞的形态、活力具有严格的控制[21]。本研究通过红外光谱分析考察了K+、Ca2+处理条件下酿酒酵母细胞结构的变化,如图5所示。
根据前人研究结果,3319.3 cm-1处有一个很强的特征吸收峰,是几丁质中的O-H与仲胺基N-H的伸缩振动引起的[22];1652 cm-1、1542.9 cm-1、1242.1 cm-1附近的吸收峰一般为酰胺Ⅰ、Ⅱ、Ⅲ带,一般由-COOH中C-O的伸缩振动、N-H的弯曲振动和C-N的伸缩振动引起,反映蛋白质分子的状态[11,22];1078.1 cm-1附近的吸收峰一般为细胞壁中碳水化合物或多糖的C-O伸缩振动峰[14,22],反映酵母细胞壁中碳水化合物和多糖环键的状态;在指纹区894.9 cm-1吸收峰可能对应于细胞壁多糖的β糖中C1-H沿键轴方向氢的弯曲振动,反映酵母细胞表面的多糖羟基骨架的变化情况[22]。
由图5可以看出,K+、Ca2+处理组在3319.3 cm-1的透过率明显高于对照组,推测酵母细胞壁中的几丁质结构在高浓度K+、Ca2+条件下发生变化。蛋白质是细胞膜的主要成分之一,处理组中的酰胺Ⅰ、Ⅱ、Ⅲ带特征吸收峰值显著减弱,表明蛋白质的特征官能团结构发生改变,可能是胁迫条件下的细胞膜发生破损。在1078.1 cm-1、894.9 cm-1附近的透过率明显增强,表明K+、Ca2+改变了酿酒酵母的多糖羟基骨架,导致酵母细胞壁的结构发生了改变。综合上述结果可知,K+、Ca2+能通过改变酵母细胞的几丁质、蛋白质、多糖等结构对细胞壁和细胞膜进行破坏,从而影响细胞的正常生长及代谢。
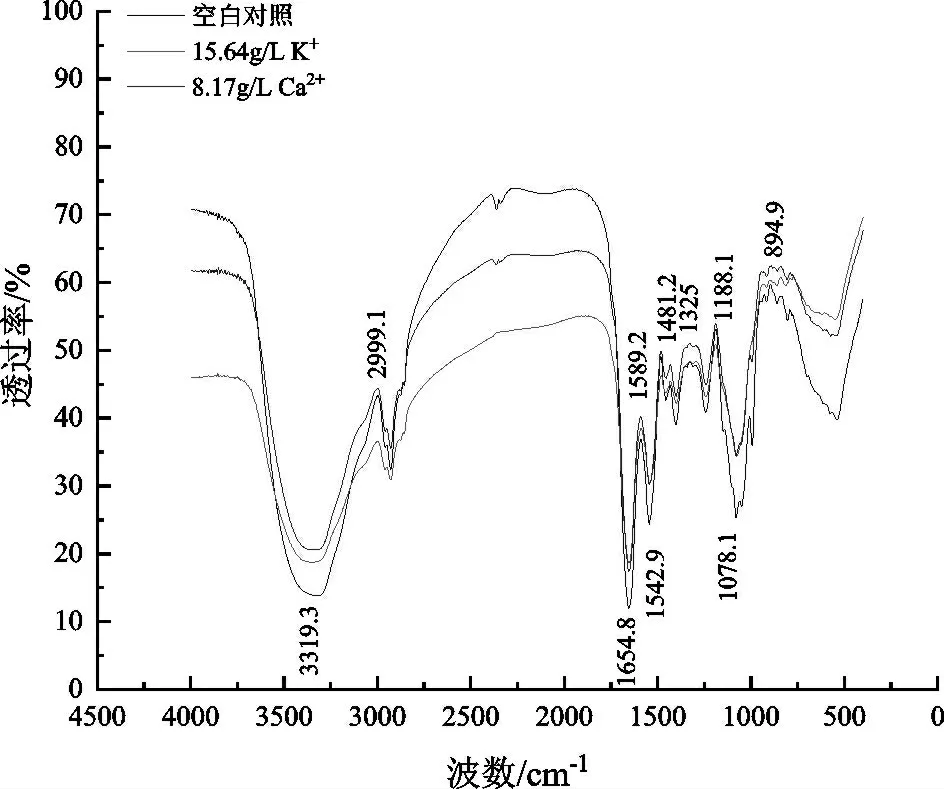
图5 K+、Ca2+处理条件下酿酒酵母细胞红外光谱图
2.3.3 甘蔗糖蜜中K+、Ca2+对胞内海藻糖含量的影响
海藻糖由两分子葡萄糖经糖苷键连接而成,是胞内应激代谢产物之一,可通过抑制酵母胞内ROS产生,防止细胞死亡,具有稳定脂膜、蛋白质和生物膜系统的特性[23-24]。本研究考察了K+、Ca2+处理条件下酵母细胞胞内海藻糖含量的变化,结果如图6所示。
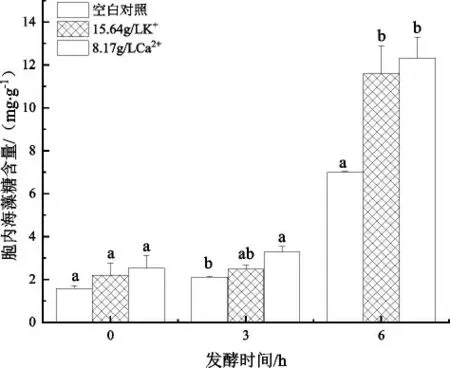
图6 K+、Ca2+胁迫下对酿酒酵母GJ2008胞内海藻糖含量的影响
由图6可知,空白对照组与处理组的胞内海藻糖含量在0 h时没有显著差异(P<0.05),处理3 h的各组酵母细胞内的海藻糖含量缓慢增加,随着处理时间的延长,胞内海藻糖含量均逐渐升高趋势;6 h时,经K+、Ca2+处理后的胞内海藻糖含量分别是对照组的1.66倍、1.76倍。出现此现象的可能原因是K+、Ca2+处理的酵母细胞面临高浓度金属离子的胁迫作用,细胞通过快速合成海藻糖以稳定生物膜系统,导致含量明显高于对照组。此外,随着发酵的进行乙醇不断积累,空白对照组中高浓度乙醇诱导海藻糖合成酶基因(TPS1、TPS2、TLS1)和海藻糖酶基因(NTH1、NTH2、ATH1)的表达,促使酵母细胞海藻糖含量增加以抵御乙醇胁迫[25]。
3 讨论
甘蔗糖蜜中含有约50%的可发酵糖,可用于生物乙醇的发酵,因含大量金属离子、胶体、色素等物质,影响酵母的生长代谢导致发酵醪液中酒精含量偏低。本文对糖蜜样品进行热酸预处理后,测得总糖含量为273.3±4.09 g/L,检测到含量较多的金属离子为K+(15.64 g/L)、Ca2+(8.17 g/L),与周嫄[10]所测预处理糖蜜中K+(16.46 g/L)、王进[15]所测甘蔗糖蜜中K+(16.68 g/L)、Mg2+(2.54 g/L)含量相似。本文依据所测甘蔗糖蜜预处理后含量较高的前六种金属离子进行发酵实验,通过对细胞生物量的测定,与对照组相比,K+、Ca2+处理组均出现细胞生物量偏低,可能是由于处理组酵母生长环境渗透压增大,引起胞内氧化还原反应,降低酵母细胞活力[26]。K+、Ca2+处理组中蔗糖水解速率慢、葡萄糖/果糖消耗速率低,残糖量偏高、乙醇生成量偏低的原因可能是由于细胞膜结构受损,蔗糖水解酶活性受到抑制而影响蔗糖的正常水解速率[27]。此外,由残果糖、残葡萄糖曲线可知,对照组和处理组中的残果糖含量均明显高于残葡萄糖含量,产生此现象的原因可能是酵母细胞己糖跨膜转运对葡萄糖和果糖的亲和力不同[19]。
通过SEM图像可以直观的看到处理前后酿酒酵母细胞表面结构的变化,经K+、Ca2+处理后的细胞表面出现絮状物、部分细胞壁塌陷,且细胞有堆积现象,这与姜敏[20]通过扫描电镜对比啤酒酵母和分别吸附Cd2+、Zn2+的啤酒酵母表面形貌变化结果大体一致。结合傅里叶红外光谱可以看出,经K+、Ca2+处理后的酿酒酵母,其蛋白质、几丁质、多糖羟基骨架等分子成分官能团发生明显变化,表明细胞壁及细胞膜结构发生较大变化,且抑制程度越强,官能团变化越明显。与曾令杰等[11]研究甲酸对酵母细胞毒性作用红外结果变化趋势一致。海藻糖是酿酒酵母应对胁迫环境产生的重要应激产物,特异性保护菌体蛋白质、生物膜和核酸等大分子结构[28],高浓度K+、Ca2+存在时,胞内海藻糖含量出现显著增大,这与胡梦蝶[29]研究的鲁氏酵母应对乙醇和高温胁迫时胞内海藻糖积累的结果较为相似。
4 结论
对热酸预处理后的甘蔗糖蜜进行总糖、金属离子含量测定,依据所测总糖(273.3±4.09 g/L)及金属离子含量进行生物量的测定,发现K+(15.64 g/L)、Ca2+(8.17 g/L)处理组与对照组相比,最大细胞生物量分别减少9.83%、18.45%。开展250 g/L蔗糖乙醇发酵试验,与对照组相比,经K+、Ca2+处理后,蔗糖水解速率减慢(38.06%、45.72%),水解时间延长;42 h的残果糖浓度分别是对照组的1.68倍、1.85倍,残葡萄糖浓度均有剩余(14.2 g/L、19.55 g/L),残总糖浓度分别是对照组的2.16倍、2.79倍,乙醇生成量减少(18.03%、23.81%);对比发现各组残果糖明显高于残葡萄糖量,是导致残总糖剩余的重要原因。从SEM图像可以看出,处理组的酵母细胞表面出现絮状物,并且细胞堆积、破裂、粘连,使细胞无法进行正常生理代谢甚至死亡。FTIR图谱表明处理组中细胞蛋白质、几丁质、多糖羟基骨架等结构发生较大变化,且抑制程度越强,结构变化越明显。为了应对高浓度K+、Ca2+的抑制作用,处理6 h的酵母细胞胞内海藻糖含量出现显著提高,分别是对照组的1.66倍、1.76倍,说明酵母在K+、Ca2+胁迫条件下可通过合成大量海藻糖以抵御金属离子胁迫。此外,综合对比发现,Ca2+处理组对酿酒酵母GJ2008的抑制作用强于K+处理组。本研究结果有助于了解酿酒酵母在K+、Ca2+胁迫条件下蔗糖乙醇发酵过程的蔗糖水解、葡萄糖和果糖消耗、乙醇生成及理化特性的变化规律,为进一步研究金属离子对酿酒酵母的毒性机理,选育耐受型菌株,实现高浓度甘蔗糖蜜乙醇发酵提供试验基础。
