青方腐乳中益生乳酸杆菌的筛选鉴定及益生特性研究
2022-08-31张贵富于寒松朱先明朱世杰任大勇
张贵富,田 萌,于寒松,朱先明,朱世杰,任大勇
(1.吉林农业大学 食品科学与工程学院,吉林 长春 130118;2.长春市朱老六食品股份有限公司,吉林 长春 130500)
腐乳至今已有上百年的历史,为我国特有的发酵制品之一。腐乳通常分为青方、红方、白方三大类。青方腐乳风味奇特,与众不同,具有刺激性的臭味,颜色青色或豆青色,故而得名。青方腐乳采用优质大豆为原料,利用毛霉菌发酵,自备优质卤汤汁作为辅料,经过磨浆、成坯、培养、前期发酵、腌渍、装坛、后期发酵等工艺制备[1]。青方腐乳因其分解较其他品种彻底,氨基酸的含量较为丰富,特别是青方腐乳中含有较多的丙氨酸以及谷氨酸、天门冬氨酸、乌苷酸、肌苷酸和醇类生成芳香酯类的化合物,这类物质赋予青方鲜美的滋味[2-3]。
乳酸菌,常被用作人体的益生菌[4]。相比于从其他传统发酵食品中分离出许多乳酸菌菌株,对青方腐乳中乳酸菌的研究仍然较少[5-6]。由于青方腐乳中含有大量的蛋白质和糖类,因此其特别适合乳酸菌的生长,有研究表明,青方腐乳中的乳酸菌具有多样性[7]。由于青方腐乳自身的独特性,其乳酸菌可能与酸奶、泡菜等食品中分离的菌株具有不同的特性。
本试验从青方腐乳中分离乳酸菌,通过菌株形态学、生理生化试验及16S rRNA序列分析相结合的方法对分离菌株进行鉴定。通过人工胃液、胆盐的耐受性及其细胞表面特性测定对分离菌株进行初步筛选,并将筛选出的菌株进行清除亚硝酸钠、降胆固醇、乳糖消耗、抑菌和抗氧化的益生特性功能试验,旨在筛选出有效降亚硝酸钠、胆固醇及乳糖并兼具抑菌、抗氧化的功能性乳酸菌,从而为加工生产高品质青方腐乳提供优质种质资源。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
青方腐乳:长春市朱老六食品股份有限公司;福氏志贺氏菌(Shigella flexneri)、肠炎沙门氏菌(Salmonella enteritidis)、鼠伤寒沙门氏菌(Salmonella typhimurium)、痢疾志贺氏菌(Shigella dysenteriae)、肺炎克雷伯菌(Klebsiella pneumonia)和蜡样芽孢杆菌(Bacillus cereus):吉林农业大学食品科学与工程学院食品与安全毒理学实验室。
1.1.2 化学试剂
磷酸缓冲盐溶液(phosphate buffered saline,PBS):北京酷来搏科技有限公司;过氧化氢(分析纯):天津市富宇精细化工有限公司;氯化钠、二甲苯、亚硝酸钠、硫酸亚铁(均为分析纯):北京化工厂;乳糖(纯度>98%):北京鸿润宝顺科技有限公司;硫代乙醇酸钠(分析纯):北京奥博星生物技术有限责任公司;牛胆盐(生化试剂):上海蓝季科技发展有限公司;胆固醇、抗坏血酸(均为分析纯):北京鼎国昌盛生物技术有限责任公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析纯):合肥巴斯夫生物科技有限公司;胃蛋白酶(酶活力>1 200 U/g)、氢氧化钠、乙醇、蒽酮、溴甲酚紫(均为分析纯):国药集团化学试剂有限公司;三氯乙酸(分析纯):天津市光复精细化工研究所;1,10-菲啰啉(分析纯):天津市科密欧化学试剂有限公司。
1.1.3 培养基
MRS琼脂培养基、MRS肉汤培养基、LB琼脂培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
SW-CJ-2FD型净化工作台:上海新苗医疗器械制造有限公司;WMW-02型电热恒温培养箱:湖北省黄石市医疗器械厂;UV-2600i型紫外可见分光光度计:岛津仪器(苏州)有限公司;5804R型离心机:德国Eppendorf公司;CX23LEDRFS1C型生物显微镜:奥林巴斯(广州)工业有限公司;QL-901型涡旋振荡器:海门市其林贝尔仪器制造有限公司;Delta320型pH计:梅特勒托利仪器。
1.3 方法
1.3.1 青方腐乳中潜在乳酸杆菌的分离及初步鉴定
将当地超市采购的青方腐乳作为分离乳酸杆菌的来源。将1 mL腐乳汤汁加入到9 mL无菌水中,将其充分混匀后,吸取1 mL再加入到9 mL无菌水中,依次梯度稀释至10-6,分别移取不同浓度的汤汁100 μL至无菌MRS固体培养基(含有0.15%溴甲酚紫),置于恒温培养箱中37 ℃厌氧培养48 h。挑取黄色单菌落(乳酸菌代谢产酸会使指示剂溴甲酚紫由紫变黄)接种于MRS固体培养基,于37 ℃培养48 h,选择表面光滑的单菌落重复纯化两次。纯化后的菌株进行形态特征、过氧化氢酶试验和革兰氏染色的初步鉴定。
1.3.2 菌株菌体细胞的制备
分离菌株在厌氧培养箱中,在MRS肉汤中37 ℃培养48 h,得到菌株培养液,将其在4 ℃、12 000 r/min条件下离心5 min,得到的菌体细胞用于后续人工胃液和胆盐耐受性及细胞表面疏水性试验。
1.3.3 人工胃液和胆盐的耐受性试验
分离菌株菌体细胞后用PBS缓冲液(经121℃灭菌15min,pH 7.2)洗涤2次,并将菌体细胞重悬于PBS溶液中使其浓度达到1×109CFU/mL,并将10%的菌悬液加入到MRS-人工胃液(MRS培养液中添加0.35%胃蛋白酶,0.2%氯化钠,pH值为1.5,经过0.22 μm滤网过滤)中,37 ℃厌氧培养3 h。以菌悬液加入到MRS中作为对照。培养结束后,在波长600 nm处测量其光密度(opticaldensity,OD)值。菌株人工胃液耐受性计算公式如下:
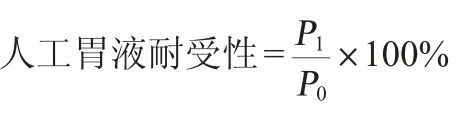
式中:P1和P0分别为接种于MRS-人工胃液和MRS中的菌体细胞的OD600nm值。
同样,将菌悬液按2%的接种量接种于MRS-胆盐培养基(MRS培养基中含0.3%牛胆盐,pH为7.2)中,以菌悬液加入到MRS中的作为对照。在37 ℃厌氧培养24 h后,记录在600 nm波长处的OD600nm值。菌株胆盐耐受性计算公式如下:
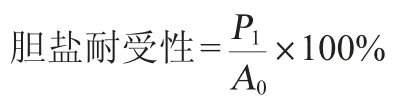
式中:P1和P0分别为接种于MRS-胆盐和MRS中的菌体细胞的OD600nm值。
1.3.4 细胞表面疏水性
参考文献[8]对分离菌株进行烃类的黏附测试(bacterial adherence to hydrocarbons,BATH)。根据DEL R B等[9]的方法测定分离菌株的自聚合能力。
1.3.5 菌株分子生物学鉴定
以染色体脱氧核糖核酸(deoxyribonucleicacid,DNA)为模板,利用引物A27F(5'-AGCGGATCACTTCACACAGGACTACGGCTACCTTGTTACGA-3')和A1495R(5'-GCAGAGTTCTCGGAGTCACGAAGAGTTTGATCCTGGCTCAG-3')扩增筛选细菌的16S rRNA基因序列[5](约1 470 bp)。将测序后得到的16S rRNA基因序列提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库中,采用生物大分子序列基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,进行序列一致性分析。
1.3.6 益生特性功能试验
(1)亚硝酸钠清除试验
根据COLLINS-THOMPSON D L等[10]将100 μL的菌悬液(1×109CFU/mL)加入到1 mL无菌MRS肉汤培养基(亚硝酸钠含量为1 500 μg/mL)中,37 ℃厌氧培养48 h,用亚硝酸盐比色法测定残留的亚硝酸钠[11]。并计算亚硝酸钠清除率,其计算公式如下:
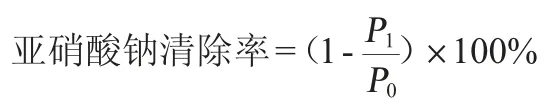
式中:P0和P1分别表示0 h和48 h时MRS肉汤培养基中残留的亚硝酸钠含量,μg/mL。
(2)降胆固醇试验
将100 μL 1×109CFU/mL的菌液接种于10 mL添加了硫代乙醇酸钠(0.2%)、牛胆盐(0.3%)和水溶性胆固醇(终质量浓度100 μg/mL)的MRS培养基中,以未接菌的MRS肉汤作为对照,37 ℃培养24 h后,收集上清液,测定残余胆固醇含量[12]。计算胆固醇降低率,其计算公式如下:

式中:P0和P1分别为0 h和24 h时MRS培养基中的胆固醇含量,μg/mL。
(3)乳糖分解试验
将100 μL的1×109CFU/mL菌悬液接种到2.5 mL含有乳糖的无菌MRS肉汤中,37 ℃培养24 h,用蒽酮比色法测定肉汤中剩余乳糖含量。计算乳糖消耗率,其计算公式如下:

式中:P0和P1分别是0 h和24 h时肉汤中残留的乳糖,μg/mL。
1.3.7 抑菌试验
本研究采用纸片琼脂扩散法[13]检测筛选出的菌株对病原菌的抑制作用,分别将20 μL的新鲜细菌培养液(将菌体细胞接种于无菌MRS肉汤培养基中培养18 h)、菌细胞重悬液(将新鲜细菌培养液在4 ℃、12 000 r/min条件下离心5 min,经无菌PBS缓冲液洗涤后,重悬于PBS缓冲液中)和新鲜细菌培养液的上清液(新鲜菌体培养液去除菌体细胞后得到,pH值为6.5)加入到直径为6 mm无菌滤纸上,将滤纸置于分别涂有6种病原菌的LB琼脂平板上来测定各菌株的培养液、重悬液以及上清液对病原菌的抑制效果。以无菌PBS作为空白对照。所有培养皿在37 ℃条件下培养12 h。根据抑菌圈的半径来评估每个菌株的抑菌能力。
纸片半径为3 mm,抑菌圈半径=3 mm表示无拮抗作用;抑菌圈半径3~8 mm表示拮抗活性弱;抑菌圈半径>8 mm表示拮抗活性强。
1.3.8 抗氧化能力试验
本研究采用羟基自由基(·OH)[14]、DPPH自由基清除试验[15]及亚铁离子(Fe2+)螯合能力测定试验[14]对菌株的抗氧化能力进行综合评价。将新鲜细菌培养液离心后收集上清液,将菌体沉淀洗涤2次后重悬于PBS中(浓度为109CFU/mL),将PBS重悬液和上清液用于测试抗氧化特性。
将0.5 mL的1,10-菲啰啉(2.5 mmoL/L)、1 mL PBS和0.5 mL 硫酸亚铁(2.5 mmoL/L)混合在试管中,然后将1 mL样品和0.5 mL 过氧化氢(0.1%)依次加入其中。将混合物在37 ℃孵育1 h后,在波长536 nm处测定OD值(Ps)。用1 mL蒸馏水代替样品测定OD536nm值(P1),用1.5 mL蒸馏水代替样品和过氧化氢测定其OD536nm值(P0)。·OH清除率计算公式如下:
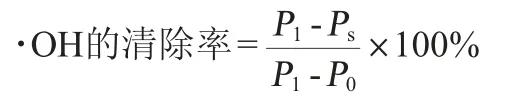
将0.5 mL样品添加到2 mL DPPH-乙醇(0.2 mmoL/L)溶液中,在黑暗环境中反应30 min,然后测定其在波长517 nm处的OD517nm值(Ps)。以0.5 mL蒸馏水代替样品测定OD517nm值(P1)。DPPH自由基清除率计算公式如下:
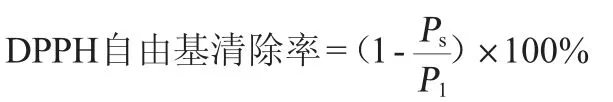
将0.1 mL抗坏血酸(0.1%),0.1 mL 硫酸亚铁(0.4%)和1 mL 氢氧化钠(0.2 moL/mL)混合在试管中,然后加入0.5 mL样品,37 ℃水浴加热20 min,用三氯乙酸沉淀去除蛋白质,3000r/min离心10min,移取上清液0.2 mL至2 mL1,10-菲啰啉(0.4%)中。反应10 min后,测定其在波长510 nm处的OD510nm值(Ps)。用蒸馏水代替样品测定OD510nm值(P0)。计算Fe2+螯合率,其计算公式如下:

1.3.9 数据处理
试验数据均是3次平行试验得到的数据,以“平均值±标准差”并利用GraphPad Prism 6.0对试验数据进行统计分析处理。
2 结果与分析
2.1 分离菌株的特征
从青方腐乳中分离得到24株菌株(编号为S1~S24)。所有分离菌株均为杆状,革兰氏染色为阳性且过氧化氢酶试验为阴性,由于这24株菌均能使指示剂溴甲酚紫由紫变黄,初步认定这些分离菌株属于乳酸杆菌[16-17]。
2.2 菌株人工胃液和胆盐的耐受性及细胞表面疏水性
人工胃液和胆盐可用于评估细菌的相对存活率。乳酸菌的生理功能是基于这它们在胃肠道中的菌体数量,这意味着高耐受性菌株往往是更好的益生菌候选菌株[18-19]。因此,对人工胃液和胆盐的耐受性是评价乳酸菌益生菌特性的重要指标之一。
通过胃肠道液体的极端环境,乳酸菌能够到达胃肠道。然后,如果它们能够粘附在胃肠道粘膜层上,就可以对寄主的健康做出长期的贡献[20-21],例如,乳酸菌与病原体争夺在肠道内的黏附位点,阻断病原体对肠道上皮细胞的感染[22]。有研究表明,细菌的表面疏水性与粘附性能有关,疏水性越高,黏附力越强[9,23-24]。因此,本研究通过菌体疏水性来间接反映其黏附性。
由表1可知,不同菌株对人工胃液的耐受性不同。菌株S8的耐受性最强,为(96.32±2.42)%,而菌株S7在低pH环境下很难生长繁殖(耐受性低于45%的菌株未显示耐受试验结果)。菌株S21、S10、S23、S20、S24和S6均具有较好的耐受性(60.92%~80.53%)。

表1 乳酸杆菌菌株的耐酸性、胆盐耐受性和细胞表面疏水性Table 1 Acid tolerance,bile tolerance and cell-surface hydrophobicity of Lactobacillus strains
由表1可知,这些菌株对胆盐的耐受范围为30.85%~58.33%。菌株S10、S11、S13的存活率最高,分别为58.33%、54.67%、56.72%,也就是说它们有更大的可能存活于肠道中。菌株S12在胆盐耐受试验中表现出存活率最差。筛选掉耐受性<40%的菌株,根据耐受试验结果初步筛选出S3、S5、S6、S8、S10、S11、S13、S17、S20、S21、S23、S24共12株乳酸菌进行进一步的研究。
由表1可知,菌体细胞的疏水性是通过其对烃类的黏附和自聚集来评价的。在BATH实验中,菌株S6的粘附性优于其他菌株,黏附率为(41.95±0.65)%。菌株S11、S17和S24彼此具有的疏水性相似(约14%)。菌株S6、S10、S11、S13、S17、S21、S23、S24的疏水性均高于10.00%。在自聚集试验中,菌株S24、S23、S17和S6的自聚合率最高(>42%),其次是菌株S21、S13、S20、S3和S11(26.0%~39.0%)。
综上,选择8株人工胃液和胆盐的耐受性及细胞表面疏水性较好的菌株(S6、S10、S11、S13、S17、S21、S23、S24)进行进一步分子生物学鉴定。
2.3 筛选菌株的鉴定
筛选出的8株菌株的16S rRNA基因鉴定结果见表2。由表2可知,8株菌株分别属于植物乳杆菌(Lactobacillus plantarum)(菌株S6、S17和S24,相似性99%~100%)、唾液乳杆菌(Lactobacillus salivarius)(菌株S10、S11和S21,相似性93%~94%)、德氏乳杆菌(Lactobacillus delbrueckii)(菌株S13,相似性98%)和短乳杆菌(Lactobacillus brevis)(菌株S23,相似性99%)。值得注意的是,唾液乳杆菌的相似性值较低,可能是新物种,需要进一步鉴定[5]。

表2 筛选菌株16S rRNA基因序列分析结果Table 2 Analysis result of 16S rRNA gene sequence of screened strains
2.4 降亚硝酸钠、胆固醇及乳糖试验
亚硝酸钠是食品中的一种重要添加剂,但它会产生致癌化合物,对肝脏、肾脏和其他器官造成损害[25]。据报道,乳酸杆菌具有清除亚硝酸钠的能力,从而保护机体免受N-亚硝基化合物的侵害[26]。从表3中可以看出,这8株菌大多都表现出了降低亚硝酸钠水平的能力,其中菌株S6和S21的亚硝酸钠清除率分别为(86.84±1.74)%和(82.79±2.17)%,其次为菌株S13、S23和S24,均为75%左右。菌株S10和S11的清除能力较弱(约为36%)。综上所述,本研究筛选到的乳杆菌是一种很好的清除亚硝酸钠(N-亚硝基化合物)的生物资源。过高的胆固醇会导致高胆固醇血症,现代研究发现,动脉粥样硬化、胆结石以及静脉血栓的形成均与高胆固醇血症有很大关系。研究表明,食用乳酸菌有助于降低血液中胆固醇水平[27]。从表3中可以看出,菌株S6和S10具有最强的降低胆固醇水平能力,分别达到61.22%和57.50%,菌株S11、S13、S21和S24降低胆固醇水平的能力均达到29%以上。S17和S23降低胆固醇水平的能力最弱,分别为27.09%和19.73%。显然,乳酸菌在降低胆固醇水平的能力方面存在显著差异。可以将降低胆固醇能力较好的乳酸菌菌株应用于食物的加工生产中,以降低胆固醇对机体可能导致的潜在风险。乳糖不耐受症是指某些人群由于缺乏相应的乳糖酶,导致机体无法对乳糖消化吸收,同时还会使胃肠道不适,甚至会出现腹泻、腹胀和腹部绞痛等症状,而乳酸杆菌被证实能够减缓乳糖不耐受症[28]。从表3中可以看出,分离的8株乳酸杆菌的乳糖消耗能力均为24.91%~33.07%。

表3 筛选菌株降低亚硝酸钠、胆固醇和乳糖的能力Table 3 Ability of reducing nitrite,cholesterol and lactose of screened strains
2.5 抑菌试验
本试验以新鲜的乳酸菌培养液、菌株细胞重悬液和上清液来检测其对6种病原菌的拮抗能力,结果见表4。

表4 筛选菌株抑菌试验结果Table 4 Results of antibacterial tests of screened strains
由表4可知,大多数乳酸杆菌菌株对肠炎沙门氏菌及肺炎克雷伯菌具有较强的抗菌活性(菌株S6、S10的菌悬液对肠炎沙门氏菌的抑菌半径>8.6 mm,菌株S6、S10、S13、S17的上清液对肠炎沙门氏菌的抑菌半径>8.3 mm;除菌株S23、S24外,其余6株细菌的菌悬液对肺炎克雷伯菌的抑菌半径均>8.0 mm,菌株S6、S11、S13、S17的重悬液的抑菌半径>8.5 mm,对福氏志贺菌和鼠伤寒沙门氏菌的增殖抑制作用也很明显(菌株S6、S10、S13、S17、S21的菌悬液对福氏志贺菌的抑菌半径均>8.2 mm;菌株S6、S10、S13、S17的菌悬液对鼠伤寒沙门氏菌的抑菌半径>8.2 mm,S11的抑菌半径也达到7.7 mm),但多数菌株对痢疾志贺氏菌和蜡样芽孢杆菌的抑制能力较弱(除菌株S17的菌悬液外,各菌株的菌悬液、重悬液及上清液对痢疾志贺氏菌的抑菌半径均<8.0 mm;8株细菌对蜡样芽孢杆菌的抑菌半径均<8.0 mm,除菌株S17外的7株细菌上清液均未表现出抑菌能力)。拮抗活性具有菌株特异性,菌株S6对试验病原菌的综合拮抗能力最强(除蜡样芽孢杆菌、痢疾志贺氏菌(抑菌半径为7.3 mm)外,菌株S6的菌悬液对其余病原菌的抑菌半径>9.2 mm,菌株S6的重悬液对肺炎克雷伯菌的抑菌半径为9.3 mm,菌株S6的上清液对肠炎沙门氏菌和肺炎克雷伯菌两种病原菌的抑菌半径都>11 mm),其次是菌株S13和S17,而菌株S23和S24的抑菌能力最弱(S23、S24对鼠伤寒沙门氏菌、蜡样芽孢杆菌基本无抑菌效果,对其他病原菌的抑菌半径<6.1 mm)。与菌株细胞重悬液及上清液相比,乳酸菌培养液具有更强的抗菌活性。
2.6 抗氧化能力
代谢过程中的许多自由基会对人体造成严重的伤害,其中羟基自由基的活动对人体的危害最大。此前的研究表明,一些乳酸杆菌可以保护宿主免受自由基的攻击[29]。本研究采用3种方法对分离得到的乳酸杆菌的抗氧化活性进行了评价,结果见表5。
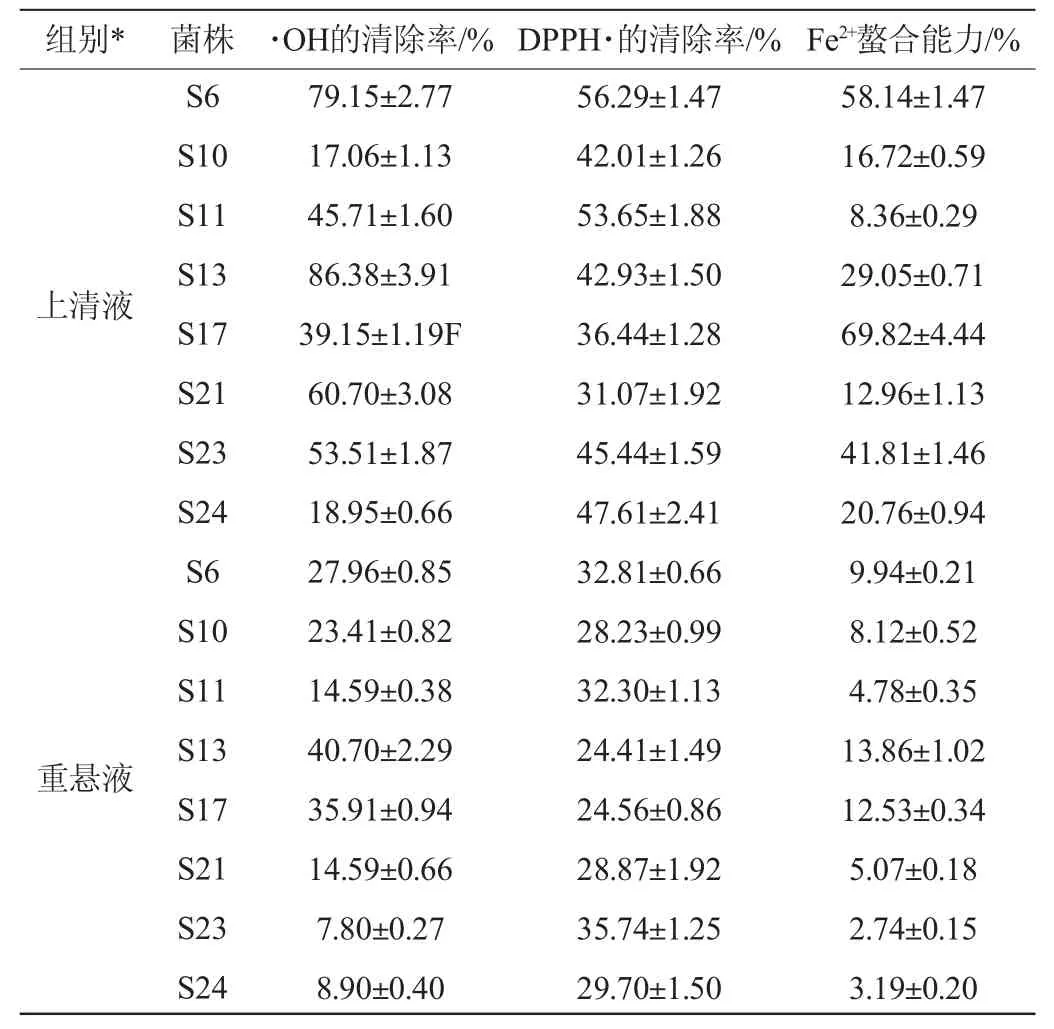
表5 筛选菌株抗氧化活性试验结果Table 5 Result of antioxidant activity tests of screened strains
由表5可知,乳酸杆菌的上清液能够有效地清除·OH,其中菌株S13、S6、S21和S23的上清液具有较强的·OH清除活性,清除率为53.51%~86.38%。除菌株S10外,所有菌株上清液的抗氧化活性均高于相对应的重悬液。据此可初步认定,乳酸杆菌分泌的胞外物质在清除羟基自由基方面发挥主要作用。
由表5可知,菌株S6和S11的上清液具有最强的清除DPPH自由基的能力分别为56.29%、53.65%,而菌株S23的重悬液抗氧化活性最强,为35.74%。
由表5可知,分离菌株在Fe2+螯合能力方面存在巨大的差异。菌株S17和S6的上清液对Fe2+螯合能力最强,分别为69.82%、58.14%,菌株S23和S13也表现出了很好的Fe2+螯合能力,分别为41.81%、29.05%,但其余菌株没有明显的Fe2+螯合能力。
3 结论
本研究从青方腐乳中分离出24株菌株,初步筛选出8株进行了5种功能特性检测。结果表明,植物乳杆菌S6具有更好的降低亚硝酸钠及胆固醇的能力,同时在降乳糖方面也表现良好;在抑菌试验中,对福氏志贺菌、肠炎沙门氏菌、鼠伤寒沙门氏菌、痢疾志贺氏菌、肺炎克雷伯菌5种病原菌均表现出明显的抑制作用;菌株S6在清除·OH自由基、DPPH自由基以及螯合Fe2+方面同样表现良好。综合来看,S6具有最佳的益生菌特性。由于菌株S6筛选自传统发酵食品,因此食用安全性具有保障,后续的研究将对该菌株的发酵性能和益生特性进行进一步的研究,以期未来在包括腐乳在内的发酵食品中加以应用。
