基于DTI分析膜联三肽对脓毒症相关性脑病大鼠海马微结构的保护作用
2022-08-30张永翰王文康宋赣军张志泉
徐 璐,张永翰,王文康,崔 侨,宋赣军,张志泉,3,谢 鹏
(1.遵义医科大学第三附属医院·遵义市第一人民医院 重症医学科,贵州 遵义 563000;2.遵义医科大学附属医院 影像科,贵州 遵义 563099;3.美国杜克大学 麻醉学系,美国 北卡罗来纳州)
脓毒症是由机体对感染反应失调引起的器官功能障碍,脓毒症相关性脑病(Sepsis-associated encephalopathy,SAE)是脓毒症患者急性期和存活后晚期最常见的并发症之一[1-2]。SAE可导致中枢神经系统炎症爆发、氧化应激、细胞凋亡进而引起精神状态和认知功能变化[3-4]。由于缺乏特异性的诊断及治疗方法,SAE已成为重症监护病房内患者死亡率增加的主要原因[5]。
膜联蛋白A1(Annexin A1,ANXA1)是一类结构相关的内源性钙依赖的磷脂结合蛋白,在多种组织中表达(如心脏、脑、血管等)[6]。膜联三肽(ANXA1sp)是ANXA1的活性部位,可参与体内多种病理生理过程如抗炎、调控信号转导通路、促进细胞增殖与分化、吞噬并清除凋亡细胞等[7]。研究表明,应激反应时,中性粒细胞胞质可释放ANXA1,抑制其向炎症部位转移;外源性给予ANXA1也可增加人中性粒细胞的凋亡从而发生抗炎作用[8]。课题组前期研究发现,在大鼠失血性心脏骤停复苏导致的脑损伤模型中,体外注射ANXA1sp可通过下调脑内促炎症警报蛋白HMGB1水平、促炎因子IL-6及TNF-α水平,上调抗炎因子IL-10水平来抑制神经炎症反应,增加神经细胞自噬,改善神经功能[6-8]。目前,ANXA1sp对SAE的治疗作用尚不明确,临床上缺乏评价该疾病预后及治疗效果的特异性手段。
磁共振扩散张量成像技术(Diffusion tensor imaging,DTI)可根据待测水分子的扩散方向无创性反映大脑显微结构信息,描述活体大脑结构[9]。DTI中常用的参数为各向异性分数(Fractional anisotropy,FA)和平均弥散率(Mean diffusivity,MD)。因大脑白质中的水不能穿过轴突膜、髓鞘或其他屏障,因此被限制为平行于轴突的方向流动(即各向异性的椭圆形)。FA值可量化水扩散的形状,范围从0(表示完全球形扩散)到1(表示完全线性扩散)。水分子在各个方向上的位移则用MD表示。既往的研究显示,利用DTI技术可较好地鉴别脑肿瘤等级,判断帕金森病患者神经网络是否异常[10-13],且能更直观的显示脑白质纤维束形态,较常规MRI扫描更早、更敏感的发现患者早期脑白质隐匿性损伤。目前有零星的报道提示MRI常规扫描能发现SAE患者的脑干和大脑等部位出现异常表现[14],但对于SAE期间大脑微结构改变的探讨很少,并不清楚MRI常规扫描区域存在怎样的损伤以及其与认知功能及对疾病的预后关系如何。因此,本研究拟基于DTI技术对SAE期间海马微结构的改变进行观察,探讨SAE期间大鼠海马的微结构损伤及ANXA1sp的治疗效果。
1 材料与方法
1.1 实验动物分组 60只SPF级SD雄性大鼠体重约250~350 g,给予12 h/12 h循环光照周期,23~25 ℃生长环境,自由摄食饮水,实验和饲养严格遵守遵义医科大学实验动物伦理与管理准则。大鼠随机分为4组(n=15):Normal组:正常大鼠不做处理;Control组:腹腔注射1 mL生理盐水;SAE组:腹腔注射LPS(4 mg/kg,溶于1 mL生理盐水);ANXA1sp组:腹腔注射ANXA1sp(1 mg/kg)1 h后再行SAE造模。腹腔注射LPS 24 h后对大鼠的神经反射进行评估,评分小于或等于6分表示SAE模型成功[15]。
1.2 Elisa法测定血液IL-6和TNF-α 尾静脉采血约1 mL,于室温静置2 h后离心取上清,按照试剂盒说明书操作建立标准曲线,加样,温育,洗涤,显色后使用酶标仪测定血液IL-6和TNF-α指标。
1.3 水迷宫实验评估大鼠学习记忆能力 建模24 h后进行水迷宫测试,实验过程中保持水温22~24 ℃,固定平台及参照物位置。实验共计5 d,前4 d行定位航行实验:平台置于水下,固定于第一象限。将大鼠面向水池壁,按1~4象限依次放入水池,每次实验时间为90 s,大鼠找到平台后或90 s内未找到平台(逃避潜伏期记为90 s),则由实验者将大鼠引导至平台休息20 s,再进行下一次实验。每只大鼠每天训练4次,两次实验间隔10~20 min。空间探索实验:第5天撤除平台,将大鼠从第3象限放入水中,记录大鼠90 s内游泳路径及穿越目标象限平台所在区域次数。
1.4 旷场实验评估大鼠精神状态 取50 cm×50 cm×40 cm的干净方箱(底部25 cm×25 cm的区域为中央区),实验全程保持安静,将大鼠放入方箱底部,顶部摄像头记录大鼠在箱中的活动情况。记录5 min内大鼠在中央区活动时间占比。
1.5 DTI分析大鼠海马微结构变化 SAE模型建立成功后24 h及给予ANXA1sp 6 h后,将大鼠麻醉,取仰卧位并固定头线圈,使用3.0 T高场核磁共振扫描大鼠大脑,获取结构像与功能像,测量大鼠的海马各向异性分数(Fractional anisotropy,FA)和平均弥散率(Mean diffusivity,MD)。
1.6 统计学分析 采用统计学软件SPSS 18.0对实验数据进行统计学分析,使用单样本Kolmogorov-Smirnov检验定量数据正态性。数据符合正态分布,3组及以上的均数比较采用单因素方差分析;进一步两两比较时,二者方差齐,使用LSD-t检验;二者方差不齐,采用Dunnett’s T3检验,P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠炎性因子表达水平变化 与Normal组相比,SAE 组大鼠血清IL-6及TNF-α水平显著升高;相较于SAE组,ANXA1sp 组血清IL-6及TNF-α 水平明显下降(P<0.05),结果见表1。
2.2 大鼠认知功能变化 相较于Normal组,SAE组大鼠第4天逃避潜伏期明显上升(P<0.05);相较于SAE组,ANXA1sp组大鼠第4天逃避潜伏期明显缩短(P<0.05)。空间探索实验发现,SAE组大鼠穿越平台次数相较于Normal组明显减少(P<0.05),ANXA1sp组大鼠穿越平台次数较SAE组增加(P<0.05),结果(见表2、3及图1)。

表2 大鼠逃避潜伏期

表3 大鼠穿越平台次数
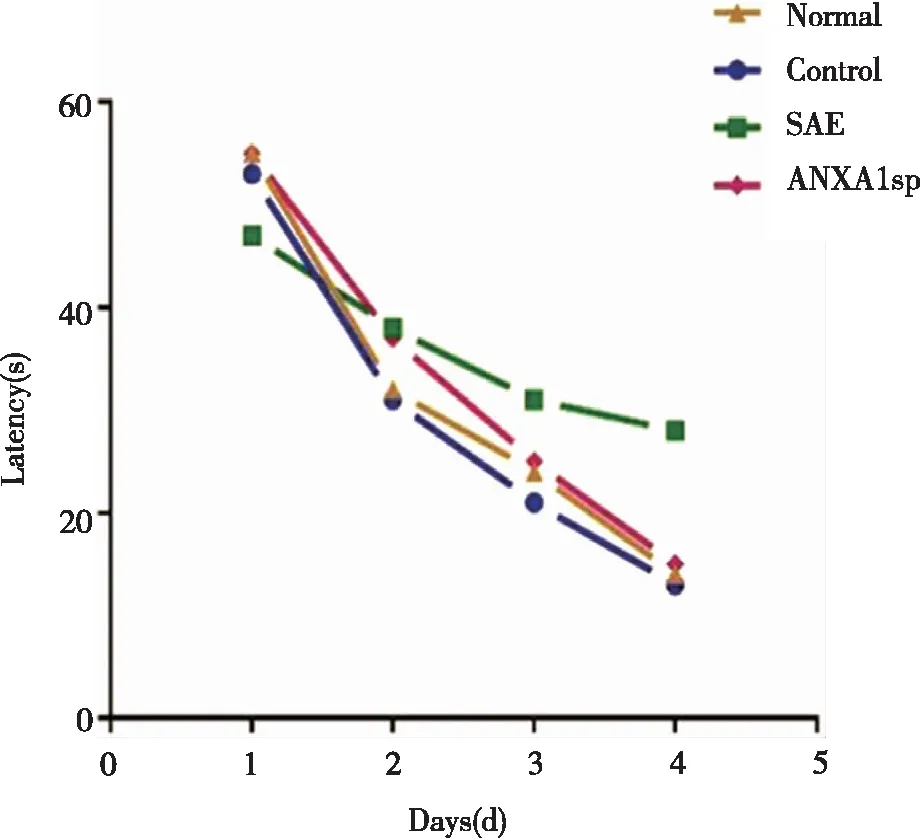
图1 大鼠逃避潜伏期变化趋势
2.3 大鼠精神状态变化 与Normal组相比,SAE组大鼠中央区活动时间显著减少(P< 0.05);与SAE组相比,ANXA1sp组大鼠中央区活动时间明显增加(P<0.05),结果见表4。

表4 大鼠中央区活动时间
2.4 大鼠海马微结构改变 与Normal组相比,SAE组大鼠双侧海马分数各项异性(FA)值减少,平均弥散率(MD)值增加(P<0.05);相较于SAE组,ANXA1sp组大鼠双侧海马FA值升高,MD值降低(P<0.05),结果见图2,表5。

表5 大鼠海马FA和MD测量值

图2 大鼠海马FA和MD值
2.5 海马微结构改变与认知功能变化的相关性 相关分析发现,SAE组大鼠双侧海马FA值与逃避潜伏期负相关(r=-0.689 1,P=0.004 5),与穿越平台次数正相关(r=0.543 9,P=0.036 1);MD值与逃避潜伏期呈正相关(r=0.634 0,P=0.011 1),与穿越平台次数负相关(r=-0.576 9,P=0.024 3)。结果详见图3A~D。

图3 SAE组大鼠海马DTI参数与认知行为的相关性分析
3 讨论
SAE是导致重症监护病房患者死亡的主要原因之一。脓毒症期间内毒素激活炎症反应系统,IL-6、TNF-α等炎症因子直接损伤血管内皮细胞,引起血脑屏障功能障碍,导致脑组织水肿、缺血缺氧以及细胞异常凋亡等[16]。因此,炎症风暴是SAE关键启动机制之一[4]。
本研究发现SAE大鼠的炎症因子显著增加,证实了上述病理生理机制。认知功能和精神状态改变是SAE期间的特征性表现[17],本实验中我们观察到SAE大鼠逃避潜伏期延长、穿越平台次数减少及中央区活动时间明显减少,与Ji等[15]研究结果一致,提示SAE模型建立成功。ANXA1sp为课题组主要成员张志泉教授发现,其结构仅由3个氨基酸构成,具有同ANXA1相同的活性作用,更有利于药物的合成和筛选[18]。ANXA1sp在中枢神经系统中由不同类型的细胞表达,包括神经元、小胶质细胞和星形胶质细胞,且ANXA是保持血脑屏障的关键调节因子。病理条件下,ANXA1sp可通过抑制关键酶磷脂酶A2来抑制炎性细胞因子的分泌及聚集[19-20]。本实验应用ANXA1sp后,SAE大鼠炎症因子产生减少,这与Zhang等[21]研究结果一致。研究表明,SAE期间神经炎症可诱导脑组织中性粒细胞浸润、星形胶质细胞活化、水通道蛋白4表达增多及前列腺素和一氧化氮合成增加,激活下丘脑-肾上腺轴,改变神经递质传递[22-24],导致脑水肿和神经元凋亡,最终造成神经功能损伤和行为变化[25]。实验结果中,ANXA1sp组大鼠炎症因子减少,认知功能和精神状态改善,提示ANXA1sp具有显著的脑保护作用,其机制与抑制SAE期间炎症因子爆发有关。
DTI是一种新兴的神经成像方法,可用于识别大脑的微结构变化,在评估疾病进展及治疗反应引起的脑组织变化方面具有独特的优势。目前,DTI技术广泛应用于中枢神经系统疾病的诊断及鉴别诊断[26]。FA 值是DTI中最广泛使用的标量,与轴突完整性及神经纤维束的走行方向、排列紧密程度密切相关;MD 值为膜密度的反比测量,与方向无关,但对细胞增生、水肿和坏死敏感[27]。研究表明,脑白质纤维束及神经元受损可导致FA值下降[28]。相关研究发现,在脑小血管病患者中,DTI可显示早期脑白质受损情况,其FA值明显减少,且与患者认知功能和受损情况具有显著相关性[29]。本实验结果中SAE大鼠白质纤维束FA值降低,水分子整体弥散水平MD值升高,提示其海马出现组织水肿,神经元受损等改变,外源性给予ANXA1sp后,SAE大鼠FA值上升,MD值下降,表明海马组织水肿减轻。结合Zhang等[21]的研究,ANXA可保护血脑屏障,外源性给予ANXA1sp可促进小胶质细胞中ANXA1的表达,降低大鼠脑内和循环中促炎因子的水平,从而降低神经炎性,达到脑保护作用。因此,我们推测ANXA1sp对海马的保护作用可能是通过下调炎症因子实现的。
随后我们发现FA值与SAE大鼠认知功能表现呈负相关关系,MD值与SAE大鼠认知功能表现呈正相关关系,提示SAE大鼠认知功能障碍与海马微结构区纤维束受损有关。结合Jung提出的额顶整合理论,推测SAE大鼠海马区联络纤维束受损,导致神经网络不能有效传输及加工信息,导致大鼠认知功能障碍[30]。这一结果可为SAE的诊断提供参考作用,同时证实海马损伤在SAE期间的行为及认知功能改变当中的重要性,提示对于海马的治疗可能是治疗SAE的关键途径。
综上所述,SAE大鼠行为及认知功能改变与海马微结构损伤密切相关,DTI技术可直接观察大鼠海马微结构变化,为SAE的诊断提供参考依据;ANXA1sp可通过减少炎症因子、改善海马微结构损伤起到脑保护作用。
