不同氧化/冷冻条件对乳清蛋白结构的影响
2022-08-30张伟伟张紫艺夏大莹汪建明
张 楠,杨 晨,张伟伟,张紫艺,夏大莹,汪建明
(天津科技大学食品科学与工程学院,天津 300457)
乳清蛋白约占乳蛋白的20%,包括β–乳球蛋白、α–乳白蛋白、免疫球蛋白、血清白蛋白、乳铁蛋白、糖巨肽以及酶和生物活性因子等[1],常用于冷冻甜品及香肠等各类食品加工中[2].由于在加工过程中受到许多促氧化剂及受光、热等自然条件的影响,所以乳清蛋白非常容易被氧化,发生断裂和交联及形成碳中心自由基等变化,使其结构性质发生改变.然而这并不是终点,如在冷冻甜品中,氧化后的乳清蛋白又在冷冻条件下进行贮藏、运输,低温诱导下冰晶的形成会进一步改变乳清蛋白的结构及性质,致使食品结构、质地等发生变化[3].因此,探究冷冻对氧化乳清蛋白结构和性质的影响非常必要.
马思丽等[4]研究不同羟自由基氧化体系强度下的牛肌原纤维蛋白结构,发现随着过氧化氢浓度的增加,其羰基含量、二聚酪氨酸含量和表面疏水性指数逐渐增加,而总巯基含量和α–螺旋含量呈下降趋势. Zhang等[5]同样发现了随着羟自由基对肌原纤维蛋白氧化修饰的增强,羰基和二聚酪氨酸的含量以及表面疏水性指数均增加,而总巯基含量和色氨酸荧光强度逐渐降低,二硫键和其他共价键导致蛋白质的交联和聚集,α–螺旋含量减少,β–折叠含量增加.Dorta等[6]发现,超氧自由基诱导肌原纤维蛋白氧化修饰形成羰基和二硫键,导致蛋白质交联和聚合.3mmol/L超氧自由基会诱导蛋白质交联,而5~10mmol/L超氧自由基会诱导肌原纤维蛋白的解折叠和聚集,赖氨酸残基的消耗也证实了这一点.
Yang等[7]研究发现,冷冻过程中形成的冰晶会破坏面团蛋白质中的二硫键和氢键,快速冷冻可以诱导微冰晶的形成,从而减少对蛋白质结构造成的破坏;在缓慢冷冻的面团中观察到更多被破坏的和薄弱的结构,且伴随着β–折叠含量的增加和α–螺旋含量的减少.Wang等[8]研究发现,冷冻加强了蛋黄蛋白质中的二硫键、氢键和疏水相互作用,促进聚集,导致其粒径增大;弛豫时间显示,冷冻使蛋黄中蛋白质的固定水含量增加,游离水含量减少;红外光谱结果表明,冷冻增强了蛋黄内的氢键;扫描电子显微镜结果表明,冷冻促进了蛋黄中蛋白质颗粒的解离.
氧化修饰可以使氨基酸残基侧链和蛋白质多肽主链发生变化,从而导致蛋白质交联[9]、断裂[10-11]、解折叠[12]和构象变化;而蛋白质在冷冻过程中,冰晶也会破坏蛋白质和水的结合而使蛋白质分子间发生相互作用[13],从而导致其构象变化[14].目前文献仅有单纯对蛋白质的氧化现象[15]或是冷冻现象[16]的研究,且主要集中于蛋白质功能性质的表征[17]和优化[18]. 本文将乳清蛋白先进行不同时间的氧化处理,然后再进行不同温度和时间的冷冻处理,通过测定其羰基含量分析其氧化程度和结构变化,利用傅里叶变换红外光谱分析其二级结构的变化,利用扫描电子显微镜再结合浊度、粒径、表面疏水性指数和巯基含量的测定共同表征分析乳清蛋白先氧化再冷冻后的结构和性质变化,旨在为含有或是添加乳清蛋白的食品在加工和低温储运过程中的品质优化提供理论参考.
1 材料与方法
1.1 材料
乳清浓缩蛋白(WPC-70)由山东天博食品配料有限公司提供.
磷酸氢二钠、磷酸二氢钠、三羟甲基氨基甲烷(Tris)、无水乙醇、乙二胺四乙酸(EDTA)、盐酸胍,北京鼎国生物技术有限公司;抗坏血酸(Asc)、浓盐酸、三氯化铁、过氧化氢,天津市北方天医化学试剂厂;尿素、2–硝基苯甲酸(DTNB)、2,4–二硝基苯肼(DNPH)、甘氨酸、三氯乙酸,美国Sigma公司;8–苯胺–1–萘磺酸盐(ANS)荧光探针(优级纯),上海源叶生物科技有限公司.所有试剂均为分析纯试剂.
TG16–WS型高速离心机,长沙湘仪离心机有限公司;SU1510型扫描电子显微镜,日本日立公司;Evolution 300型紫外-可见分光光度计,赛默飞世尔科技公司;iS50型傅里叶变换红外光谱仪,美国尼高利公司;FD–1A–50型冷冻干燥机,北京博医康实验仪器有限公司;RF5301型荧光分光光度计,日本岛津公司;BT–2001型激光粒度仪,丹东百特仪器有限公司;DW–40L92型医用低温保存箱,青岛海尔特种电器有限公司.
1.2 方法
1.2.1 氧化乳清蛋白的制备及其冷冻条件
文章涉及符号及其含义见表1.
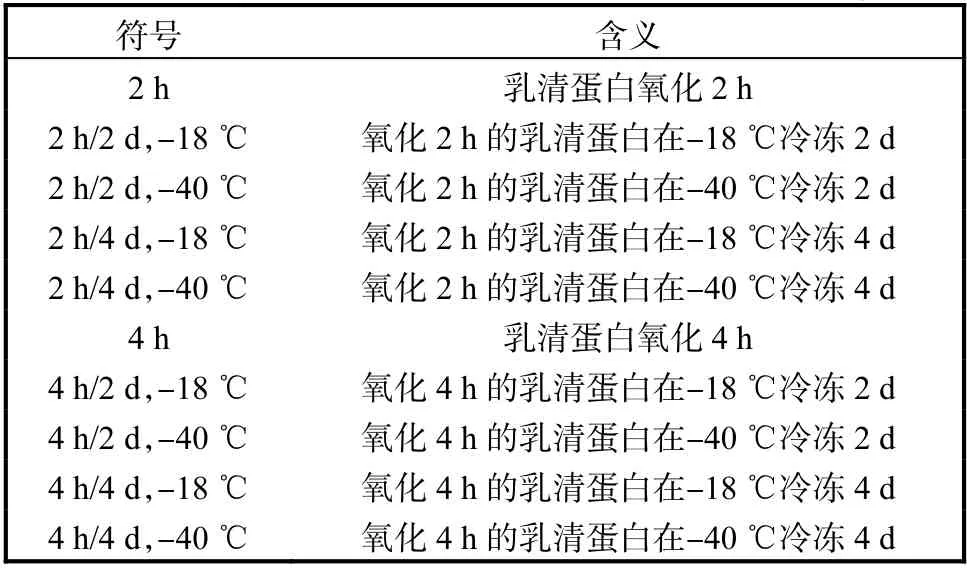
表1 文章涉及符号及其含义 Tab. 1 Symbols in the article and their meanings
乳清蛋白氧化体系参考孔保华等[19]的羟自由基氧化体系(H2O2/FeCl3/Asc)并加以改进.将乳清蛋白置于由20mmol/L H2O2、0.1mmol/L FeCl3和0.1mmol/L Asc组成的氧化体系中,配制成质量浓度为20mg/mL的蛋白质溶液;用磁力搅拌器混匀后调节转速为150r/min,在室温下(23℃)分别氧化2h和4h,结束后加入1mmol/L EDTA终止氧化;10000g离心10min后弃去上清液,再用蒸馏水洗涤沉淀后离心以除去残余试剂;将沉淀均匀分散在与氧化体系等量的蒸馏水中,分别于-18℃和-40℃下冷冻2d和4d.将乳清蛋白置于35℃水浴中解冻,然后在转速为250r/min的条件下搅拌1h,10000g离心10min,取上清液进行冷冻干燥,4℃干燥环境中保存.
1.2.2 乳清蛋白的羰基含量测定
测定方法依照Yang等[20]的DNPH比色法并加以改进.将冻干的改性乳清蛋白溶于pH 7的磷酸盐缓冲液,使其质量浓度为5mg/mL;取0.35mL溶液置于2.0mL离心管内,加入1mL用2mol/L盐酸溶解的10mmol DNPH 溶液,室温避光反应14h;加入0.45mL质量分数为 40%的三氯乙酸溶液反应1h,10000g离心5min,弃去上清液.用1.4mL体积比为1﹕1的乙醇-乙酸乙酯溶液洗涤蛋白质沉淀2次,每次10000g离心5min.将沉淀溶解于0.7mL盐酸胍-磷酸盐缓冲液(盐酸胍6mol/L,磷酸盐缓冲液pH 7),37℃水浴25min,剧烈振荡使其溶解,在368nm波长下测定吸光度,每个样品均用不含DNPH的改性蛋白质溶液经上述步骤处理作为空白对照,以消除盐酸等对实验结果的影响.羰基含量(nmol/mg)按照式(1)计算.

式中:A368为样品在368nm 波长下的吸光度;ρ为样品溶液质量浓度,mg/mL;22000为摩尔吸光系数,L/(mol·cm).
1.2.3 乳清蛋白的巯基含量测定
乳清蛋白巯基含量的测定采用Ellman试剂法,参考DTNB比色法[21]并加以改进.
将5µL的Ellman试剂〔0.008g DNTB溶于2mL Tris-Gly缓冲液(0.52g Tris、0.345g 甘氨酸和0.06g EDTA溶于50mL pH 7.8的磷酸盐缓冲液)〕加到0.1mL的5mg/mL乳清蛋白样品溶液中,在22℃条件下反应50min后于412nm处测定吸光度,以不含乳清蛋白样品溶液的试剂作为空白对照.巯基含量(nmol/mg)按照式(2)计算.

式中:73.53为1×106/(1.36×104),其中1.36×104是Ellman试剂的摩尔吸光系数,L/(mol·cm);A为除去试剂空白后样品的吸光度;D为稀释倍数,15.1;ρ为样品溶液质量浓度,mg/mL.
1.2.4 乳清蛋白的傅里叶变换红外光谱测定
采用KBr压片法[22]进行测定.将1mg冷冻干燥的乳清蛋白改性产物与150mg KBr结晶混合,快速研磨成均一细粉,在压片机上以8×107Pa的压力压 制30s,取出压好的透明薄片;以空气作为采集背景,在傅里叶变换红外光谱仪中进行全波段扫描(400~4000cm-1),分辨率为4cm-1,扫描次数为16次,利用OMNIC软件对酰胺Ⅰ带(1600~1700cm-1)的红外光谱进行分析处理,得到乳清蛋白改性产物二级结构单元含量的变化.
1.2.5 乳清蛋白的粒径测定
乳清蛋白的粒径分布采用BT–2001型激光粒度仪测定.取5mg/mL制备的乳清蛋白样品溶液进行测定,散射角度为90°,测定时间为60s.
1.2.6 乳清蛋白的微观结构
用导电胶将制备好的乳清蛋白样品粘在样品台上,置于离子溅射仪中,使样品表面镀导电金膜,用SU1510型扫描电子显微镜观察.
1.2.7 乳清蛋白的表面疏水性指数测定
采用ANS荧光探针法[23]测定蛋白质的表面疏水性指数. 取1mg制备好的乳清蛋白样品均匀分散在0.01mol/L、pH 7的磷酸盐缓冲液中使其溶解,分别配制成质量浓度为0.1、0.2、0.3、0.4、0.5mg/mL的乳清蛋白待测液;将ANS溶于上述磷酸盐缓冲液中,配制成浓度为8mmol/L的ANS溶液.将4mL乳清蛋白待测液和50µL ANS溶液混合,置于黑暗条件下30min使其充分反应;在激发波长390nm和发射波长470nm的条件下测定荧光强度,狭缝设置为5,灵敏度设置为2.将荧光强度的测定结果与乳清蛋白质量浓度绘制成曲线图,曲线初始斜率即为乳清蛋白的表面疏水性指数.
1.2.8 乳清蛋白的浊度测定
将0.05g的乳清蛋白冻干粉溶解在10mL、pH 7的磷酸盐缓冲液中,在600nm处测定其吸光度,用此吸光度表示浊度.
2 结果与分析
2.1 不同氧化/冷冻条件对乳清蛋白羰基及巯基含量的影响
因羰基含量与蛋白质氧化程度相关,实验中常用其作为表征蛋白质受氧化影响程度的标志性常规指标[24];而蛋白质中的半胱氨酸残基主要以巯基或二硫键的状态存在,二硫键有着稳定蛋白质天然构象的重要作用,使蛋白质肽链空间结构更为紧密.已有实验证明[25],当蛋白质的二硫键还原成巯基时,蛋白质构象变得松散.因此,通过对先氧化后冷冻的乳清蛋白的羰基含量及巯基含量进行分析,辅助表征其结构、性质的变化(图1).

图1 氧化/冷冻条件对乳清蛋白羰基及巯基含量的影响Fig. 1 Effect of oxidation/freezing conditions on the carbonyl and sulfydryl content of oxidized whey protein
由图1可知:乳清蛋白经过2h和4h氧化后与空白相比其羰基和巯基的含量均上升,表明氧化使乳清蛋白结构解构.乳清蛋白氧化2h再冷冻2d后,与空白相比其羰基含量减少,其中-40℃冷冻条件下乳清蛋白的羰基含量更少.这可能是由于更低的冷冻温度使蛋白质的聚集程度更大,更多的羰基无法与DNPH结合[25].继续冷冻至第4天时,-18℃条件下乳清蛋白的羰基含量进一步降低,而-40℃条件下其羰基含量略有上升.当乳清蛋白在冷冻之前经过更长时间的氧化后,在-18℃和-40℃条件下随着冷冻时间的增加,羰基含量均呈现先下降后上升的趋势,其中-18℃条件下乳清蛋白羰基含量的变化程度较-40℃条件下的更大.在先氧化再冷冻的情况下,总体来看,无论是-18℃还是-40℃条件下,均是在经过氧化4h和冷冻2d处理的羰基含量最低.这可能是由于高度羰基化的蛋白质倾向于形成高分子聚集体[26-27],再经过短时间冷冻后进一步聚集,而继续长时间冷冻导致蛋白质部分解聚[28].
经过4h氧化和-18℃冷冻处理的乳清蛋白的巯基含量增加最多,这可能是由于二硫键的断裂或蛋白质结构松散暴露了内部的巯基;而经过4h氧化和 -40℃冷冻处理的乳清蛋白的巯基含量变化不大,说明较低的冷冻温度对蛋白质的结构起到保护作用.
综上所述,氧化后的乳清蛋白再经过冷冻处理,其羰基和巯基的含量与空白组相比均增大.
2.2 不同氧化/冷冻条件对乳清蛋白傅里叶变换红外光谱的影响
在1600~1700cm-1波数范围内的酰胺Ⅰ带在表征蛋白质二级结构上应用最为广泛[29],用OMNIC软件对乳清蛋白样品谱图的酰胺Ⅰ带进行傅里叶去卷积、分峰和高斯峰拟合计算,不同氧化/冷冻条件下乳清蛋白的傅里叶变换红外光谱及二级结构单元含量分别见图2和表2.

图2 不同氧化/冷冻条件下乳清蛋白的傅里叶变换红外光谱 Fig. 2 Fourier transform infrared spectrum of whey proteins with different oxidation/freezing conditions

表2 不同氧化/冷冻条件下乳清蛋白的二级结构单元含量 Tab. 2 Secondary structure unit content of whey proteins with different oxidation/freezing conditions
通过比较经过不同时间氧化处理的乳清蛋白及空白组的二级结构单元可知:β–折叠的含量随氧化时间的增加而增加,而无规则卷曲、α–螺旋和β–转角的含量均随氧化时间的增加而减少,说明氧化作用使蛋白质部分侧链变短.氧化2h的乳清蛋白置于-18℃冷冻2d和置于-40℃冷冻4d后,均出现α–螺旋结构占比增加的现象;而氧化2h的乳清蛋白冷冻4d后,-18℃条件下无规则卷曲结构向β–转角结构转变,-40℃条件下β–转角结构向无规则卷曲结构转变.乳清蛋白经过4h氧化后再经过-18℃冷冻2d,同样是无规则卷曲结构向α–螺旋结构转变,但是比氧化2h的变化量少,冷冻至4d时,无规则卷曲结构数量明显增加;而在-40℃条件下冷冻2d后,无规则卷曲结构向β–转角结构转变,而冷冻至4d时,β–转角结构更大程度地向无规则卷曲结构转变.
2.3 不同氧化/冷冻条件对乳清蛋白粒径的影响
通过对蛋白质粒径的测量分析可以对蛋白质的结构变化进行辅助表征,冷冻对氧化乳清蛋白粒径的影响如图3所示,不同字母表示组间差异显著(P<0.05).
由图3(d)的i、g、k柱形图可知,乳清蛋白在2h和4h氧化处理后,其平均粒径逐步增大;再结合图3(a)可见,随着氧化时间的增加,其大峰逐步变宽,小峰逐步变矮,表明氧化可能使乳清蛋白发生解折叠或交联[30].

图3 冷冻对氧化乳清蛋白粒径的影响 Fig. 3 Effect of freezing on the particle size of the oxidized whey protein
图3(b)为不同温度和时间的冷冻处理对经过2h氧化后乳清蛋白粒径的影响.从冷冻时间来看:乳清蛋白在-18℃下冷冻2d后,其大峰右移变宽,小峰变矮,表明分子可能发生了解折叠和交联;继续冷冻至4d时,粒径主峰左移变窄且由双峰变为三峰,根据其小峰积分面积变大可以判断蛋白质分子可能发生了裂解.在-40℃条件下冷冻2d和4d的乳清蛋白显示出相同的趋势,区别在于冷冻2d后与 -18℃相比其解折叠程度更小,而冷冻4d后其裂解程度更大.从冷冻温度来看:冷冻2d后的蛋白质粒径均呈现双峰,冷冻4d后的蛋白质粒径均呈现三峰,且无论是冷冻2d还是4d,-40℃条件下的峰与 -18℃条件下的峰都向左移,表明更低的温度可能更利于蛋白质结构缩聚.
图3(c)为不同温度和时间的冷冻处理对经过4h氧化后乳清蛋白粒径的影响.总体来看,与氧化2h相比,其粒径变化程度更小,且峰均向右移,粒径变大,说明氧化4h后的乳清蛋白经过不同温度和时间的冷冻处理后其分子构象可能变得松散.氧化4h后在-18℃冷冻2d的乳清蛋白的粒径增加最多,可能是由于冷冻过程使蛋白质在冰-液界面或容器表面吸附,使其部分结构展开,因此导致蛋白质聚集[31].
由图3(d)可以看出:乳清蛋白经过先氧化再冷冻处理后,平均粒径呈现出增大的趋势,而经过2h氧化处理后再经过-18℃冷冻4d的乳清蛋白的平均粒径增加最多.乳清蛋白粒径的分散指数均大于0.25,可以看出其粒径分布基本是双峰甚至三峰分布,较为分散.
2.4 不同氧化/冷冻条件对乳清蛋白微观结构的 影响
用扫描电子显微镜可以直观地从微观形态上分析不同氧化/冷冻条件对乳清蛋白的影响(图4).由图4可以看出:未处理的空白组乳清蛋白表面光滑平整,形状规则;经过氧化后结构形态明显改变,并显 示出不规则的交联;再经过冷冻后的蛋白质表面呈现出更多的、大小不一的孔洞.总体来看,经过氧化后再置于-18℃冷冻的乳清蛋白形态较-40℃条件下显示出更大的形变. 这可能是由于更大的温差使冷冻速率变快,水分子形成更大的、对蛋白质分子产生破坏作用的冰晶更少.

图4 不同氧化/冷冻条件下乳清蛋白的微观结构 Fig. 4 Microstructure of whey proteins under different oxidation/freezing conditions
2.5 不同氧化/冷冻条件对乳清蛋白表面疏水性指数的影响
表面疏水性指数可以显示出蛋白质的氨基酸残基的分布特点,是表征蛋白质结构变化的重要指标. 不同氧化/冷冻条件下乳清蛋白的表面疏水性指数见表3.

表3 不同氧化/冷冻条件下乳清蛋白的表面疏水性指数Tab. 3 Surface hydrophobicity index of whey protein under different oxidation/freezing conditions
氧化后再置于-18℃下冷冻2d后的乳清蛋白表面疏水性指数增加较多,结合其粒径大幅度的增加进行分析,可能是乳清蛋白经过氧化后再置于-18℃下冷冻2d使其结构松散舒展,内部疏水基团暴露更 多[32]. 而其冷冻至4d或是置于-40℃处理后的蛋白质表面疏水性指数降低,结合其粒径减小进行分析,可能是更长时间和更低温度的冷冻使蛋白质结构缩紧变得更加致密[33],从而减少了表面的疏水基团.
2.6 不同氧化/冷冻条件对乳清蛋白浊度的影响
浊度取决于溶液中不溶性聚集体的含量和大小,可以在一定程度上反映蛋白质分子的聚集情况[34]. 不同氧化/冷冻条件对乳清蛋白浊度的影响如图5 所示.
由图5可知,乳清蛋白经过先氧化再冷冻处理后,浊度均有不同程度的增加.乳清蛋白经过氧化2h或4h处理后,浊度略有下降,结合粒径和表面疏水性指数分析,可能是由于长时间的氧化导致蛋白质分子结构的变化,其粒径更小、表面疏水性指数更低,使蛋白质溶解性增强,进而显示出更低的浊度[35]. 乳清蛋白经过2h氧化处理再置于-18℃冷冻2d后浊度升高,而在同样条件下-40℃冷冻的蛋白质溶液浊度降低,这个变化与表面疏水性指数变化一致,随着蛋白质分子表面亲水基团和疏水基团数量的变化而变化;当继续冷冻至4d时,浊度随着冷冻温度的降低而降低,这可能是由于冷冻引发分子聚集效 应[36],从而对光线表现出更多的散射作用.乳清蛋白经过4h氧化处理后再置于-18℃和-40℃冷冻2d后,浊度变化不大;继续冷冻至4d时,浊度明显增加.其中-18℃条件下的蛋白质浊度大幅度上升,表明此条件处理后的乳清蛋白结构可能发生了较大改变. 总体来看,-18℃比-40℃对蛋白质浊度的影响更大. 结合上述实验结果可以证实,-18℃的冷冻条件比-40℃对乳清蛋白结构的影响更大,使其分子结构的打开度更大.

图5 不同氧化/冷冻条件对乳清蛋白浊度的影响 Fig. 5 Effect of turbidity of whey proteins under different oxidation/freezing conditions
3 结 论
通过对不同氧化/冷冻条件下的乳清蛋白进行结构表征和分析发现,乳清蛋白经过先氧化再冷冻处理,其羰基含量、巯基含量和浊度均有所增加,且粒径变大;再结合粒径和表面疏水性指数的结果可知:经过4h氧化再置于-18℃冷冻2d后的处理对乳清蛋白结构的改变最为严重;红外光谱结果显示,此条件处理后的乳清蛋白二级结构中的无规则卷曲结构向β-折叠结构转变.扫描电子显微镜结果显示,经过氧化再置于-18℃冷冻的乳清蛋白形态较-40℃条件下发生了更大的形变;同样,-18℃条件下乳清蛋白的浊度也较-40℃条件下更大.这说明缓慢冷冻时,冰晶对蛋白质结构的破坏更易导致乳清蛋白结构的打开.
