花生不同组织内生真菌群落多样性及其生态功能结构分析
2022-08-30李亮亮王继雯刘德海甄静慕琦李磊雷高杨文玲
李亮亮,王继雯,刘德海,甄静,慕琦,李磊,雷高,杨文玲
(河南省科学院生物研究所有限责任公司/河南省微生物工程重点实验室,河南 郑州 450008)
植物内生真菌是指生活史的某一段时期定殖在植物体内且不会引起寄主植物明显病害的一类真菌[1,2]。 研究表明几乎所有植物体内都有内生真菌的存在[3-5]。 由于植物内生真菌代谢产物中存在丰富多样的活性物质包括植物生长调节剂类、抗生素类、抗肿瘤活性类等[6],在农业、医药方面具有重要应用价值。 因此植物内生真菌已成为发现高效、低毒的天然活性物质的重要生防资源。
植物内生真菌种类繁多,对其多样性研究一般采用组织分离法。 徐祥林等[7]从罗汉果植株中分离到150 株内生真菌,经鉴定大都属于子囊菌门。 施文广等[8]从檀香紫檀的不同组织中分离到337 株内生真菌,其中根部99 株、茎部66株、叶部172 株,结合形态学和ITS-rDNA 序列分析,发现这些真菌主要隶属于15 个属。 由于自然界中仅有少量微生物可以进行体外培养[9],所以通过组织分离法研究植物内生真菌多样性具有较大局限性。 随着近年来高通量测序技术的发展,植物内生真菌多样性的研究进入了一个新的发展阶段。 与传统的组织分离法相比,高通量测序技术具有测序基数大、测序深度广等优点[10],可提供更加全面准确的植物内生真菌多样性信息。 目前高通量测序技术已在刺槐[11]、杜仲[12]、白及[13]、铁皮石斛[14]等多种植物内生真菌多样性的研究中得到应用。
花生(Arachis hypogaeaLinn.)是我国大面积种植的油料作用,具有重要的经济价值。 目前关于花生内生真菌种群多样性的高通量测序研究还未见报道。 因此本试验利用高通量测序技术研究盛花期健康花生植株根、茎、叶、花不同部位内生真菌的种群多样性及其生态功能群结构,以期为进一步利用花生内生真菌资源奠定理论基础。
1 材料与方法
1.1 花生样品采集
花生植株样本于2020年7月30 日采自河南省汝南县三桥镇(114°21′51′′E,32°49′43′′N)。选择3 个样方,每个样方随机选取5 株盛花期健康植株,保持根系完整,立即放入冰盒中带回实验室。 用大量无菌水对花生植株表面泥土进行冲洗后,再用无菌剪刀将不同样品按根、茎、叶、花组织分开。 每个样方5 株花生不同组织的混合样品作为一个生物学重复,共设3 个重复,一共12 个样品,分别为根(R):R1、R2、R3;茎(S):S1、S2、S3;叶(L):L1、L2、L3;花(F):F1、F2、F3。
1.2 花生样品表面消毒
首先用无菌水将花生不同组织样本冲洗30 s,随后用75%乙醇冲洗2 min,接着置于2.5%次氯酸钠溶液(含0.1%吐温80)中浸泡5 min,再用无菌水冲洗3 次。 取最后一次冲洗液经平板涂布检测无菌后进行后续试验。
1.3 花生样品基因组DNA 提取及PCR 扩增
使用FastDNA Spin Kit(MP Biomedicals)试剂盒提取花生不同组织总DNA。 用NanoDrop 2000检测DNA 纯度和浓度,1%琼脂糖凝胶电泳检测DNA 完整性。 DNA 样品经检测合格后进行PCR扩增和高通量测序。 PCR 扩增引物为ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA- 3′;ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′。 反应体系(20 μL):10×FastPfuBuffer 2 μL,dNTPs(2.5 mmol/L)2 μL,上下游引物(5 μmol/L)各0.8 μL,rTaqPolymerase 0.2 μL,DNA 模板(10 ng/μL) 1 μL,BSA 0.2 μL,补ddH2O 至20 μL。 扩增条件:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,共27 个循环;72℃延伸10 min。 扩增产物经2%琼脂糖凝胶电泳检测合格后,通过Illumina公司MiSeq 测序平台进行高通量测序。
1.4 数据处理
基于有效序列,利用Uparse 软件(http:/ /www.drive5.com/uparse/)在97%相似水平下进行OTU 聚类[15]。 为了得到每个OTU 对应的物种分类信息,采用RDP classifier 贝叶斯算法对97%相似水平的OTU 代表序列进行分类学分析,并分别在Kingdom(界)、Phylum(门)、Class(纲)、Order(目)、Family(科)、Genus(属)统计各样本的群落物种组成,选用的比对数据库为真菌ITS 数据库UNITE(https:/ /unite.ut.ee/)。 利用Mothur(https:/ /mothur.org/wiki/Down)和Qiime(http:/ /qiime.org/install/index.html)软件计算花生不同器官内生真菌基于OTU 分类水平的Alpha 多样性指数,主要包括反映群落丰富度的Ace 指数,反映群落多样性的Shannon 指数和Simpson 指数以及反映群落覆盖度的指数Coverage[16]。 为研究花生不同组织内生真菌群落结构的相似性或差异关系,对样本群落进行聚类分析和主成分分析。 最后通过FUNGuild 软件按照对环境资源的吸收利用上采取的方式差异将花生内生真菌进行生态功能群分类。
2 结果与分析
2.1 花生不同组织内生真菌测序统计及其多样性分析
经高通量测序共从花生不同组织得到有效序列763200 条,其中根部186492 条,茎部157447条,叶部199978 条,花部219283 条。 在97%相似水平下共获得的OTU 数量为308,根部、茎部、叶部和花部的OTU 数量分别为208、126、84 和77(表1),表明花生内生真菌具有丰富的种群多样性。 从图1 可以看出,花生不同组织共有的OTU数是35,根部、茎部、叶部和花部独有的OTU 数分别是120、52、23 和20。 根部和茎部共有的OTU数目最多(70),说明两个组织含有的相似或相同物种较多。
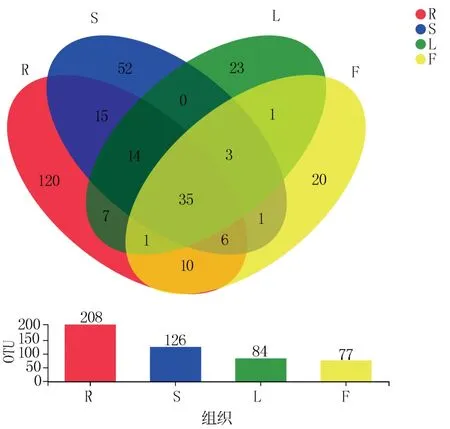
图1 花生不同组织内生真菌Venn 分析

表1 花生不同组织内生真菌Alpha 多样性指数
基于有效序列和OTU 水平分析花生不同组织内生真菌的种群多样性和丰富度,由表1 可知,根部内生真菌的多样性和丰富度均最高,茎部和叶部次之,花部最低。 对序列进行随机抽样,以抽到的序列数与其对应的多样性指数构建稀释曲线。 12 个样本的Sobs 稀释曲线(图2)随着抽样读取数的增加趋向平坦,说明测序数据量合理。Shannon 稀释曲线(图3)表明随着抽样读取数的增加,12 个样本的Shannon 指数近似一条直线,说明本次测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息。
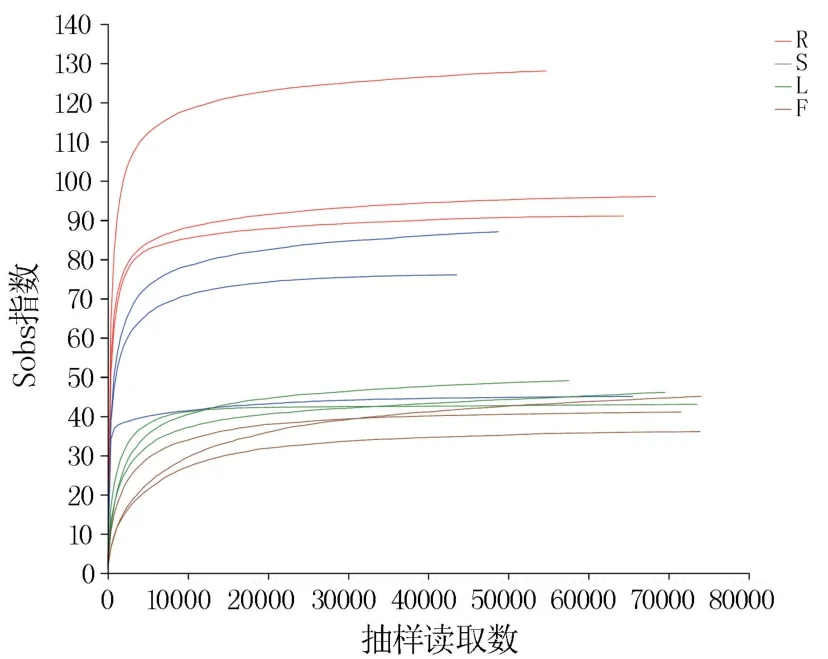
图2 Sobs 稀释曲线
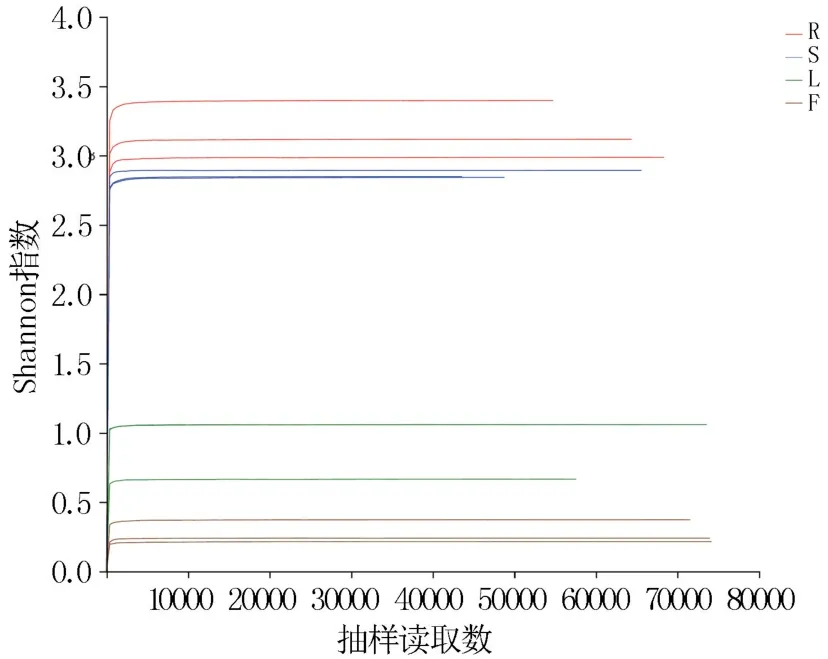
图3 Shannon 稀释曲线
2.2 花生不同组织内生真菌群落结构及丰度分析
种群分类学分析表明,花生内生真菌一共包括9 个门,25 个纲,51 个目,107 个科,155 个属。花生根、茎、叶、花不同组织包含的内生真菌分类阶层如表2 所示,其中根部内生真菌种群多样性最为丰富,茎部和花部次之,叶部最低。
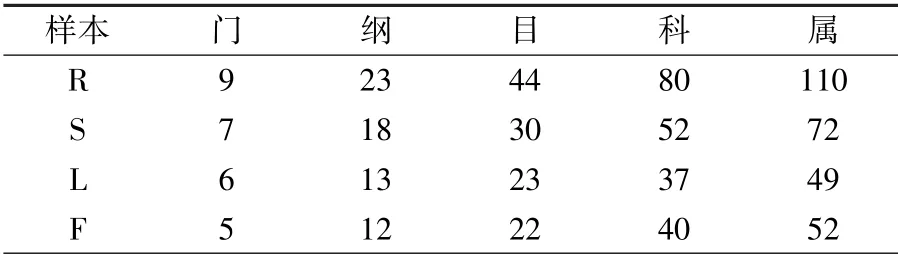
表2 花生内生真菌物种分类阶层统计
在门、纲和属分类水平上对花生不同组织内生真菌群落和丰度进行分析。 将样本中相对丰度>5.00%的菌群定义为优势菌群。
花生根部内生真菌覆盖9 个门,其中子囊菌门(Ascomycota)丰度最高,达到65.82%,其次为担子菌门(Basidiomycota),丰度为25.28%,另有未分类真菌门6.59%。 包含23 个纲,优势纲为粪壳 菌 纲( Sordariomycetes,28. 71%)、 银 耳 纲(Tremellomycetes,20.27%)和散囊菌纲(Eurotiomycetes,18.27%)。 包含110 个属,优势菌属有镰刀菌属(Fusarium)、曲霉属(Aspergillus)、丝孢酵母属(Trichosporon)、Apiotrichum和篮状菌属(Talaromyces),丰度分别为13.35%、10.74%、8.32%、6.29%和5.09%。 此外,丰度>1.00%的属还有Oliveonia(2.80%)、Setophoma(2.60%)、皮状丝孢酵母属(Cutaneotrichosporon,2.58%)、Papiliotrema(2.48%)、威克汉姆酵母属(Wickerhamomyces,2.18%)、被孢霉属(Mortierella,1.52%)、木霉属(Trichoderma,1.37%)、Acidomelania(1.28%)和孢子丝菌属(Sporothrix,1.25%)。 另有未分类真菌属6.59%、丛赤壳科下未分类属6.35%、子囊菌门下未分类属4.52%、圆盘菌科下未分类属2.61%、毛球壳科下未分类属1.15%(图4a)。
花生茎部内生真菌覆盖7 个门,其中以担子菌门(Basidiomycota)和子囊菌门(Ascomycota)为主,丰度分别为43.39%和35.50%,另有未分类真菌门19.85%。 包含18 个纲,优势纲包括银耳纲(Tremellomycetes,42.26%)和散囊菌纲(Eurotiomycetes,12.53%)。 包含72 个属,优势真菌属有Apiotrichum、丝孢酵母属(Trichosporon)、皮状丝孢酵母属(Cutaneotrichosporon)和曲霉属(Aspergil-lus),丰度分别为17.99%、13.81%、7.60%和5.92%。此外,丰度>1.00%的属还有嗜热子囊菌属(Thermoascus,4.86%)、Papiliotrema(2.74%)、Cyberlindnera(1.63%)、Rasamsonia(1.49%)、暗球腔菌属(Phaeosphaeria,1.23%)和假丝酵母属(Candida,1.16%)。 另有未分类真菌属19.85%、子囊菌门下未分类属12.72%(图4b)。

图4 属水平花生不同组织内生真菌群落组成分析
花生叶部内生真菌包含6 个门,以子囊菌门(Ascomycota)为主,丰度为97.08%。 包含13 个纲,优势纲为座囊菌纲(Dothideomycetes,94.52%)。包含49 个属,优势菌属为小光壳属(Leptosphaerulina)和暗球腔菌属(Phaeosphaeria),丰度分别为65.64%和27.18%。 此外,丰度>1.00%的还有Didymellaceae 下未分类属1.58%、子囊菌门下未分类属1.15%(图4c)。
花生花部内生真菌包含5 个门,其中子囊菌门(Ascomycota)占绝对优势,丰度达到98.95%。包含12 个纲,主要以座囊菌纲(Dothideomycetes,97.98%)为主。 包含52 个属,优势真菌属为小光壳属(Leptosphaerulina),丰度达到95.45%。 此外,丰度>1.00%的属还有Didymellaceae 下未分类属(2.40%,图4d)。
2.3 花生不同组织内生真菌物种多样性比较
花生根、茎、叶、花不同组织在门分类水平上比较相似,均以子囊菌门(Ascomycota)和担子菌门(Basidiomycota)为主,但在纲和属分类水平上差异较大。 花生根部和茎部丰度>1.00%的纲分别有9 个和5 个,且茎部包含的5 个纲均是两者共有,说明根部和茎部含有的内生真菌在物种多样性上比较接近。 叶部和花部均以座囊菌纲(Dothideomycetes)为主,丰度分别达到94.52%和97.98%,物种多样性略显单一。 在属水平,花生根部和茎部丰度>1.00%且能准确分类的属分别有14 个和10 个,显示了丰富的种群多样性,而叶部和花部分别只有2 个和1 个。 基于属水平的样本层级聚类分析(图5)显示根部和茎部聚在一起,叶部和花部聚在一起,表明根部和茎部、叶部和花部含有的内生真菌物种具有较高的相似性。主成分分析(PCA)同样表明根部和茎部内生真菌具有较高的相似度,两者分布在第四象限且有明显的聚集,叶部和花部分别分布在第二、第三象限(图6)。
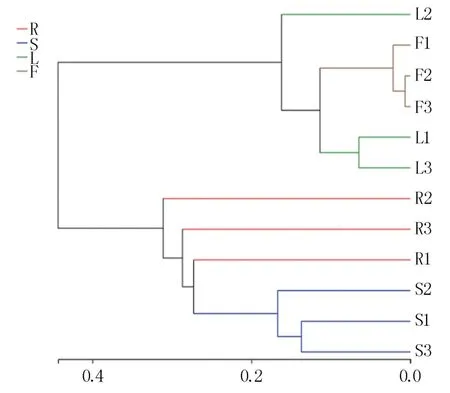
图5 花生不同组织内生真菌层级聚类分析
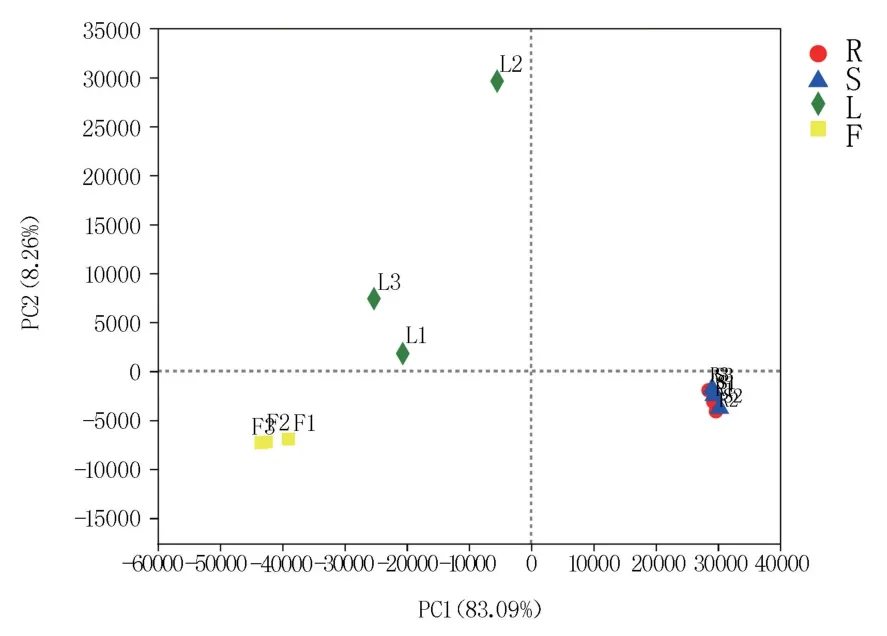
图6 花生不同组织内生真菌PCA 分析
2.4 花生不同组织内生真菌功能分析
基于FUNGuild 数据库解析花生内生真菌的生态功能类别。 仅选择可信等级为很可能(probable) 和极可能(highly probable)的OTU 和分类单元进行分析。 从表3 可知,花生内生真菌可分为8 个生态功能群,分别为地衣共生真菌(lichenized)、未定义腐生菌(undefined saprotroph)、动物病原菌(animal pathogen)、内生菌(endophyte)、木腐菌(wood saprotroph)、植物病原菌(plant pathogen)、粪生菌(dung saprotroph)、丛枝菌根真菌(arbuscular mycorrhizal)。 此外还有9 种混合营养生态功能群,分别为植物病原菌-未定义腐生菌(plant pathogen-undefined saprotroph)、动物病原菌-内生菌-植物腐生菌-土壤腐生菌(animal pathogenendophyte-plant saprotroph-soil saprotroph)、动物内共生菌-未定义腐生菌(animal endosymbiontundefined saprotroph)、粪生菌-植物腐生菌(dung saprotroph-plant saprotroph)、动物病原菌-未定义腐生菌(animal pathogen-undefined saprotroph)、粪生菌-植物腐生菌-木腐菌(dung saprotroph-plant saprotroph-wood saprotroph)、动物内共生菌-动物病原菌-内生菌-植物病原菌-未定义腐生菌(animal endosymbiont-animal pathogen -endophyte -plant pathogen-undefined saprotroph)、粪生菌-未定义腐生菌(dung saprotroph-undefined saprotroph)、内生菌-植物病原菌(endophyte-plant pathogen)。

表3 花生不同组织内生真菌生态功能群
以上17 种生态功能群中,花生根、茎、叶、花不同组织共有的功能群有2 个,分别为未定义腐生菌,分类属为Rasamsonia;动物病原菌,分类属为被毛孢属(Hirsutella)。 不同组织样本独有功能群差异较大,其中根部独有功能群最多,包括未定义腐生菌的Oliveonia、篮状菌属(Talaromyces)、内隔孢属(Endophragmiella)、新赤壳属(Neocosmos-pora)、线黑粉酵母属(Filobasidium)、拟暗球腔菌属(Phaeosphaeriopsis)、锥盖伞属(Conocybe),动物病原菌的无柄霉属(Acaulopage),内生菌的Acidomelania、烧瓶状霉属(Lecythophora),木腐菌的柱顶孢霉属(Scytalidium),植物病原菌的螺旋聚孢霉属(Clonostachys),粪生菌的裂壳菌属(Schizothecium),动物病原菌-内生菌-植物腐生菌-土壤腐生菌中的孢子丝菌属(Sporothrix),粪生菌-植物腐生菌的光黑壳属(Preussia),丛枝菌根真菌的Rhizophagus,粪生菌-植物腐生菌-木腐菌的鬼伞属(Coprinopsis),粪生菌-未定义腐生菌的粪裸盘菌属(Coprotus),内生菌-植物病原菌的炭疽菌属(Colletotrichum)。 叶部独有的功能群最少,仅有未定义腐生菌的Leuconeurospora,植物病原菌的孢丛竿霉属(Passalora)以及动物内共生菌-未定义腐生菌的毕赤酵母属(Pichia)。
3 讨论与结论
本试验通过高通量测序技术研究了花生内生真菌的多样性,突破了植物体内很多厌氧微生物不能体外分离培养的技术瓶颈[17,18],全面覆盖了整个植株体内的微生物多样性信息。 结果表明,花生内生真菌隶属于9 个门,25 个纲,51 个目,107 个科,155 个属,表现出丰富的种群多样性。Alpha 多样性指数显示,花生根部内生真菌在多样性和丰富度上均是最高,茎部和叶部次之,花部最低。 从门的分类水平来看,花生内生真菌以子囊菌门和担子菌门为主,这和陶刚[19]通过组织分离法研究白及内生真菌种群多样性的结果一致。子囊菌门是花生体内的绝对优势菌门,在根、茎、叶和花不同部位的丰度分别为65.82%、35.50%、97.08%和98.95%。陈泽斌等[14]通过高通量测序技术研究了铁皮石斛叶片内生真菌种群多样性,发现铁皮石斛叶片内生真菌主要隶属于子囊菌门,丰度达到99.97%,与本研究花生叶片所含内生真菌分类结果相似。 除子囊菌门外,根部和茎部还有较高比例的担子菌门,丰度分别为25.28%和43.39%;叶部和花部担子菌门占比较低,丰度分别为2.08%和0.71%。 根部优势真菌属为镰刀菌属(Fusarium)、曲霉属(Aspergillus)、丝孢酵母属(Trichosporon)、Apiotrichum和篮状菌属(Talaromyces),与熊丹等[20]研究发现不同区系杜鹃根部优势真菌属为青霉属(Penicillium)、木霉属(Trichoderma)和拟盘多毛孢属(Pestalotiopsis)的结论相差较大。 其原因可能是某些真菌在不同寄主的定殖情况不同或者是生境差异造成了内生真菌种群结构的多样化。 此外,在花生根部和茎部还发现了一定比例的曲霉属(Aspergillus)真菌,丰度分别为10.74%和5.92%。 曲霉属真菌是一类重要的生防微生物,在植物促生和抗病方面有重要的利用价值。 如泡盛曲霉(Aspergillus awamori)能产生促进植物生长的吲哚乙酸(IAA)[21];分离自苦楝树(Melia azedarach)的一株内生真菌Aspergillussp.能产生多种抑制植物病原菌如小麦赤霉(Gibberella saubinetti)、灰葡萄孢霉(Botrytis cinerea)生长的抗菌物质[22]。
利用FUNGuild 软件将花生内生真菌进行生态功能群分类,一共获得17 种功能群。 花生不同组织共有的生态功能群有两个。 不同组织样本独有功能群数量有较大差异,其中根部独有功能群最多,茎部和花部次之,叶部最少。 值得注意的是,FUNGuild 分析结果仅将丝孢酵母属(Trichosporon)、被毛孢属(Hirsutella)、绿僵菌属(Metarhizium)、无柄霉属(Acaulopage)4 个属定义为动物病原菌。 已有研究表明部分动物病原菌能够跨界侵染不同生物寄主[23],如花生内生真菌未定义腐生菌群中的篮状菌属(Talaromyces)可导致人类感染暗色丝孢霉病[24],所以该菌株应该同时被定义为动物病原菌群。 此外,炭疽菌属(Colletotrichum)被定义为内生菌-植物病原菌混合功能群,说明内生真菌是一个在发育学上不稳定的阶段,其致病性可在整个生活史中相互转化[25]。 如镰刀菌一般被认为是植物病原菌,但内生镰刀菌却能增加玉米对黑斑病的抗性[26]。
本试验通过高通量测序技术,研究了花生根、茎、叶、花不同部位中的内生真菌种群多样性及其生态功能群结构,为研究内生真菌与花生互作关系,以及其在花生病害生物防治领域的应用奠定了基础。
