长清茶新梢中细胞色素P450 基因CYP94B3 的季节表达响应
2022-08-30宋来超刘芳彬王晨羽丁兆堂孙海伟马青平
宋来超,刘芳彬,王晨羽,丁兆堂,孙海伟,马青平
(1. 聊城大学农学院,山东 聊城 252000;2. 山东省农业科学院茶叶研究所,山东 日照 276800;3. 泰安市农业科学研究院茶叶研究所,山东 泰安 271001)
细胞色素P450 (cytochrome P450,简称CYP450)为一种B 族细胞色素,其辅基为血红素,属于强大的超基因家族蛋白酶之一,内质网与线粒体内膜是真核生物中CYP450 存在的主要场所。 CYP450 最早发现于大鼠肝微粒体中,1969年Frear 等[1]从棉花(Gossypium hirsutumL.)中发现了CYP450,这是首次发现植物细胞中存在CYP450。 随后,人们分别从拟南芥(Arabidopsis thalianaL.)[2]、水稻(Oryza sativaL.)[3]、小麦(Triticum aestivumL.)[4]等植物中发现了CYP450的存在。
不同家族CYP450 的氨基酸序列具有一定的保守性,即CYP450 在不同物种之间具有同源性,其三级结构均由N 端的β 折叠和C 端的α 螺旋构成。 在所有CYP450 的典型保守结构域中,C末端血红素的结合域含有FXXGXRXCXG 保守序列,这是鉴定CYP450 的主要特征结构,其中的半胱氨酸(Cys)具有完全保守性;K 螺旋区域中具有保守序列EXXR,其中谷氨酸(Glu)和精氨酸(Arg)完全保守;PDR 结构域中具有保守序列PXRX。
CYP450在植物不同组织、不同发育时期及不同胁迫条件下的表达存在较为明显的差异。F3′H基因属于CYP75B2 家族基因,茶树F3′H基因在第一叶、第二叶、第三叶、第四叶、嫩茎、根、老叶中的表达水平依次降低,在根和老叶中几乎不表达[5]。 崔会婷[6]研究发现蒺藜苜蓿叶中的Mt-CYP450基因表达量最高,且从嫩苗期到结果期呈先上升后下降的趋势。 茶树CYP71A26与CYP71B34基因受虫害胁迫时分别表现为上调和下调表达,而受冷热胁迫时则分别表现为下调和上调表达[7];受干旱、高温、氮胁迫、盐胁迫的影响,高羊茅P450 基因的表达表现为上调趋势[8]。
CYP450 在植物体内起重要作用,主要分为两类:一是参与多种植物内源性物质的代谢与合成,在苯丙烷代谢产物木质素、黄酮、异黄酮等物质的合成过程中发挥重要作用,且其在黄酮生物合成中的作用底物广泛,对同一位点结构相似的化合物能够同时进行催化[9]。 研究表明,盐和植物根际促生菌(PGPR) 接种联合处理诱导的CYP94B3基因可参与茉莉酸(JA)代谢[10];烟草香气物质西柏三烯二醇的合成受CYP71D16基因的催化[11];CYP71AU87可催化萜类的合成与代谢过程[12];肉桂酸羧化酶(C4H)属于CYP450 家族酶系,滇水金凤(Impatiens uliginosaFranch)的C4H1、C4H2基因可催化反式肉桂酸转化为香豆酸[13];紫苏和蝴蝶草的CYP93B1、CYP93B2基因可参与黄酮合成酶Ⅱ的合成并发挥最重要的作用,其中黄酮合成酶Ⅱ属于CYP93 亚家族,是黄酮类化合物合成过程中的关键酶;花青素、缩合单宁化合物的合成离不开CYP75 的参与,CYP75 对黄酮化合物的C3′位、C5′位上的羟基化具有催化作用[14];CYP93B 亚家族能够催化黄酮类化合物C2 位羟基化并使其脱水,形成C =C[15],如CYP93B10 和CYP93B11 可将黄酮类物质转化为2-羟基黄酮。 二是参与生物体代谢解毒。 植物生长过程中常会受到多种病虫的侵害或化学药品的毒害,细胞色素P450 作为解毒过程中的关键酶能将除草剂、杀虫剂等外源化学物质转化为无毒物质。 研究发现,棉铃虫CYP9A 亚家族6 个成员及CYP6B 亚家族四个成员能代谢杀虫剂菊戊酸酯[16],多个细胞色素P450 的过表达可使致倦库蚊(Culex quinquefasciatus)种群对氯菊酯类杀虫剂的抗性增强[17]。
茶树[Camellia sinensis(L.) O. Kuntze]是山茶科山茶属中种植最为广泛的植物,也是三大饮品之一。 黄酮类化合物是它的次生代谢产物之一,其骨架为C6-C3-C6,主要包括黄酮、异黄酮、花青素等天然化合物。 黄酮类化合物在茶叶中含量丰富,可影响茶叶的品质、滋味以及色泽等,其中黄酮醇类物质可增强咖啡碱的苦味,同时使茶汤干燥柔和,有更好的收敛感[18],其含量决定着绿茶的汤色。 CYP450 作为“万能生物催化剂”,可参与黄酮类化合物的生物合成,间接影响茶叶的品质。
本试验以不同季节的长清茶叶片为材料提取RNA,反转录合成cDNA,通过转录组分析(登录号PRJNA830980)筛选得到CsCYP94B3基因,将茶树及与其同源性较高的26 个物种的CYP94B3进行蛋白序列比对并构建系统进化树,运用实时荧光定量PCR 技术测定不同季节CsCYP94B3的相对表达量,以期为长清茶采摘及品质提高提供一定的理论依据。
1 材料与方法
1.1 植物材料
长清茶鲜叶采自济南市长清区立泰山、圣虎山、南湖玉露3 个茶园中,采摘时间均为2020年春季(5月)、夏季(7月)和秋季(9月)晴朗无风天气的9 时,采摘的叶片均为一芽二叶、长势良好、生长均匀、无病虫害。 叶片采摘后用2 mL 离心管封存,立即于液氮中速冻,然后置于-80℃冰箱中保存备用,样品设置3 次生物学重复。
1.2 试剂与设备
华越洋快速通用植物RNA 提取试剂盒、Thermo Scientific RevertAid First Strand cDNA Synthesis Kit、2000 DNA Marker、2×TaqPlus Master Mix (Dye Plus)、5×DNA Loading buffer、Biomarker 2×SYBR Green Fast qPCR Mix、琼脂糖,PCR 仪、离心机、高通量组织研磨仪、紫外透射仪、金属浴、涡旋振荡器、超微量紫外分光光度计。
1.3 总RNA 提取与第一链cDNA 合成
使用高通量组织研磨仪将经过液氮速冻的长清茶叶片研磨成粉末,按照华越洋快速通用植物RNA 提取试剂盒说明书的操作步骤提取总RNA。总RNA 在1%琼脂糖凝胶电泳上检测完整度,并使用超微量紫外分光光度计测其浓度和纯度。 吸取1 μg RNA,用Thermo Fermentas 反转录试剂盒K1622 合成第一链cDNA。 逆转录的反应条件为42℃温育60 min,70℃反应5 min(此步反应目的为使逆转录酶失活),反应结束后将制备好的cDNA 置于-20℃冰箱保存备用。
1.4 CYP94B3 生物信息学分析
将通过转录组分析(登录号PRJNA830980)筛选得到的CsCYP94B3基因,通过NCBI 中的BLAST 进行CsCYP94B3基因的同源性比对,获得与该基因同源性较高的榴莲(Durio zibethinus)、葡萄(Vitis vinifera)、银白杨(Populus alba)、柑橘(Citrus sinensis)、欧洲木犀榄(Olea europaeasubsp.europaea)、小果咖啡(Coffea arabica)、番茄(Solanum lycopersicum)、野生烟草(Nicotiana attenuata)、可可树(Theobroma cacao)等26 个物种的蛋白序列,并将CsCYP94B3基因序列通过DNAMAN 软件翻译成蛋白序列。 使用ExPASy 网站分析CYP94B3 氨基酸的组成、理化性质及疏水性。 选取葡萄、榴莲、可可树3 个代表性物种与茶树的CYP94B3 蛋白序列使用DANMAN 软件进行多重序列比对。 将茶树与其他26 个物种的CYP94B3 蛋白序列使用MEGA-X 中的邻位相连法(Neighbor-joining)-泊松模型构建系统进化树。
1.5 实时荧光定量PCR
利用实时荧光定量PCR 测定CsCYP94B3基因在春、夏、秋季茶叶中的表达量。 PCR 总体系20 μL:cDNA 2 μL,10 μmol/L 上下游引物各0.5 μL (F:5′-AGCACATTCTCAAGACCAACTTC-3′,R:5′-ACTCGTGACTCGCTAACTTCC-3′),无菌水7 μL,Biomarker 2×SYBR Green Fast qPCR Mix 10 μL。 反应程序为:95℃3 min;95℃5 s,60℃30 ~40 s,共45 个循环。CsGAPDH基因为内参基因,CsCYP94B3基因的相对表达量用2-ΔΔCt法计算,统计分析使用SPSS 18.0 和Microsoft Excel 2010 软件进行,差异显著性分析基于Duncan’s 多重比较的单因素方差分析进行,P<0.05 表示两两之间差异显著。
2 结果与分析
2.1 茶树CYP94B3 蛋白理化性质及疏水性分析
根据ExPASy 网站分析结果,CsCYP94B3 的蛋白质分子量为58.79 kDa,理论等电点为8.76;氨基酸残基数为518 个,碱性氨基酸的平均含量为15%,酸性氨基酸的平均含量为10%,芳香族氨基酸约占10%,杂环族氨基酸约占9%,脂肪族氨基酸约占81%;不稳定指数为41.51,属于不稳定蛋白;总平均疏水性-0.052,为可溶性蛋白。 疏水性分析(图1)发现,CsCYP94B3 蛋白疏水性在第16 位亮氨酸(Ile)具有最大值2.900,在第32位组氨酸(His)具有最小值-3.411,为亲水蛋白。
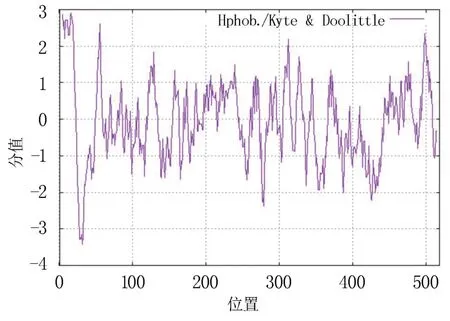
图1 茶树CYP94B3 蛋白疏水性分析
2.2 不同物种CYP94B3 蛋白多重序列比对分析
多重序列比对(图2)发现,茶树CYP94B3 蛋白序 列 与 葡 萄、 榴 莲、 可 可 树3 个 物 种 的CYP94B3 蛋白序列一致性为80. 41%,且其CYP94B3 蛋白序列都含有PDR 结构域(PXRX)、K 螺旋(EXXR)以及C 末端的血红素结合域(FXXGXXXCXG),其中血红素结合域是鉴别细胞色素P450 基因的主要特征结构,因此,茶树、葡萄、榴莲、可可树的CYP94B3基因均为细胞色素P450 亚家族基因。
2.3 茶树与其他物种的CYP94B3 进化树构建
将茶树与欧洲木犀榄、小果咖啡、烟草等26个物种的CYP94B3 蛋白序列使用MEGA-X 软件中的邻位相连法(Neighbor-joining)-泊松模型构建系统进化树,结果(图3)显示,茶树与中华猕猴桃、大桉、欧洲木犀榄、小果咖啡、番茄、野生烟草6 个物种的亲缘关系较近,与其他20 个物种的亲缘关系较远。

图3 茶树及其他物种CYP94B3 的系统进化树分析
2.4 CsCYP94B3 在不同季节长清茶新梢中的表达变化
CsCYP94B3基因在3 个茶园长清茶树的春、夏、秋新梢中均可表达,但不同季节、不同地理条件间存在差异(图4)。 在立泰山、圣虎山、南湖玉露3 处茶园茶树中,CsCYP94B3基因在夏季茶树新梢中的相对表达量明显高于春秋两季,且与圣虎山茶园春季、南湖玉露茶园春秋两季差异达显著水平。 圣虎山和南湖玉露茶园的茶树新梢中CsCYP94B3基因相对表达量秋季略高于春季,但差异不显著;立泰山茶园茶树新梢中CsCYP94B3基因相对表达量春秋两季相当。 表明CsCYP94B3基因的表达与环境条件有关,可响应季节变化,表现为夏季上调表达。
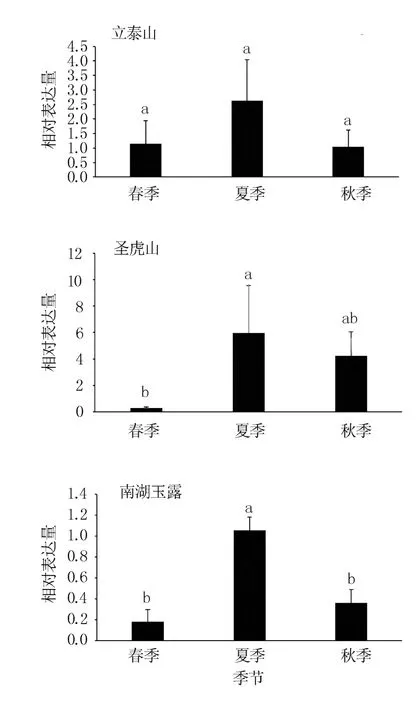
图4 不同茶园不同季节长清茶中CYP94B3基因的相对表达量
3 讨论与结论
P450 广泛存在于动植物等细胞中,同一种植物的不同组织中都有分布但含量各不相同,其基因的表达量受到不同外界因素的调控[19]。 本研究结果表明,茶树与中华猕猴桃、大桉、欧洲木犀榄、小果咖啡、番茄、野生烟草的CYP94B3 亲缘关系较近,而与其他20 个物种亲缘关系较远,这种现象可能与细胞色素P450 碱基易突变有关。 前人研究发现,CYP704B2基因在第4 个外显子处常发生多对碱基的替换或缺失,从而造成氨基酸的转变或缺失[20]。 因此,不同物种CYP94B3 常在系统进化树上发生分离。
本试验通过实时荧光定量PCR 分析了不同茶园不同季节长清茶CYP94B3基因的相对表达量,结果发现,3个茶园的长清茶CYP94B3基因均在夏季表达量最高,推测夏季温度高、光照强,长清茶生长代谢最旺盛,需要更多的细胞色素P450参与多种内源物质的合成与代谢反应。
综上所述,茶树CYP94B3基因的表达受季节因素调控,夏季上调表达,且南湖玉露和圣虎山的CsCYP94B3基因表达量夏季明显高于春秋季。 这将为长清茶采摘及品质提高提供一定的参考,并为通过人工干预给茶树创造适宜的生长环境以提高茶叶品质和产量奠定基础。
