丛枝菌根真菌(AMF)对盐碱地花生根系土壤微生物的影响
2022-08-30康佳梁夕金杨文龙钟怀荣宣宁耿耘孙秀芹岳寿松陈高
康佳,梁夕金,杨文龙,钟怀荣,宣宁,耿耘,孙秀芹,岳寿松,陈高
(1. 山东省农业科学院农作物种质资源研究所/山东省作物遗传改良与生态生理重点实验室,山东 济南 250100;2. 诸城市密州街道文体中心,山东 诸城 262234)
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是土壤中十分重要的一类微生物,可与80%以上陆生维管植物形成互惠共生体[1]。 借助庞大的菌丝网络,AMF 帮助宿主植物吸收营养物质,并提高宿主对生物和非生物胁迫的抗性,在拮抗土传病原物、提高植物抗病性方面有显著的作用效果。 AMF 已经被广泛用作微生物制剂,可以有效改善根际微环境,增加植物营养物质摄取和胁迫耐受能力。 在土壤中施加AMF 菌剂不仅可以增加有益微生物数量,还可以降低土传病原菌的丰度[2]。
研究表明,微生物菌群可以影响植物和病原物之间的相互作用,有益微生物能够促进植物生长,同时增加植物对非生物胁迫的耐受性[3]。 Wu等[4]研究发现接种AMF 后植株根长、根表面积、根体积等增加,从而促进植物的养分吸收和生长发育;黄京华等[5]发现丛枝菌根真菌与玉米形成菌根后,玉米植株总根长、根表面积和根体积均明显增加;Wu 等[6]研究发现接种AMF 后,柑橘根系直径的降低使根系能够深入到较小的土壤空隙中吸收养分;刘荣林等[7]也发现,丛枝菌根真菌能提高植物根系活力,促进养分吸收。
我国待开发利用的盐碱地大部分分布在黄河流域及长江以北。 山东省不同程度盐碱化耕地,主要分布在滨州、德州、潍坊和东营[8]。 6.67×106hm2盐碱地具有良好农业利用潜力,其中有2.33×106hm2经治理改良后可实现较大幅度增产,有4.33×106hm2未被农业利用的盐碱地经开发改造后可实现农业生产[9]。 目前对盐碱地改良研究主要包括各种节水减肥和盐碱障碍消减的物理、化学、生物、水利工程等方法。 在生态环境脆弱及地下水位高的轻、中度盐渍土改良中,一般认为生物改良措施是能长期“治标亦治本”的方法[10]。从生物进化角度来看,盐碱土中的菌根真菌与植物的共生关系有利于双方在盐碱环境中的生存,在促进植物生长和提高植物产量中发挥重要作用[11]。 陶蕾等[12]对复合微生物菌剂进行研究表明,接种生物菌剂是降低土壤盐碱度、增加土壤肥力的有效手段。 本试验以花生品种“花育25”为研究对象,通过接种AMF 菌剂研究花生根系土壤微生物多样性和群落结构变化,以明确AMF 对盐碱地花生土壤微生物的影响,为进一步深入研究AMF 在盐碱地改良及农业生产中的应用提供理论依据。
1 材料与方法
1.1 试验地点与处理
试验在山东省东营市山东省农业科学院黄河三角洲现代农业试验示范基地进行。 土壤为滨海盐碱土,0 ~20 cm 土层总盐含量为0.28%。 AMF菌剂成分为异形根孢囊霉(Rhizophagus irregularisSA) 和摩西管柄囊霉(Funneliformis mosseaeBEG95),比例为(w/w)1∶1,粉状,由捷克Symbiom公司提供。
试验处理为AMF 菌剂0.5 g 施于花生种子下方0.5 cm 处,对照(CK)不施用AMF 菌剂。 供试花生品种为“花育25”。 田间随机区组设计,3 次重复。 小区面积8 m × 5 m。 单粒种子点播,行距50 cm,株距10 cm,肥水和其它管理措施同常规大田。
1.2 试验方法
1.2.1 土壤样品采集 花生出苗30 d 取样,采集AMF 菌剂处理及对照的根外(距离植株20 ~30 cm 处的土壤)、根围(距离植株0.5 ~1.0 cm 处的土壤)、根表(将根放入盛有PBS 的无菌管中,用超声波对其进行二次冲洗,冲洗液作为根表微生物样本)、根际(距离植株2 ~3 mm 处的土壤)和根内(根用无菌水冲洗,超声20 min,摇床振荡1 h;纱布过滤后液体经4000 r/min离心10 min,收集菌体)区域样本。 将土壤及花生根部样品分别放入无菌采样袋中,每个样本5 个重复,送杭州联川生物技术股份有限公司进行16S rRNA/ITS 扩增子测序。
1.2.2 基因组提取和高通量测序 用E.Z.N.A.®Stool DNA Kit(D4015,Omega,Inc. US)提取样品总DNA,正向引物341F(5′-CCTACGGGNGGCWGCAG-3′)和反向引物805R (5′-GACTACHVGGGTATCTAATCC-3′)扩增16S rRNA 基因的V3 - V4 区; 正 向 引 物 ITS1 (5′ - GTGARTCATCGAATCTTTG-3′)和反向引物ITS2(5′-TCCTCCGCTTATTGATATGC-3′)对真菌ITS 可变区进行扩增。 PCR 反应体系:模板DNA 1 μL、PCR Premix 12.5 μL、上游引物2.5 μL、下游引物2.5 μL、ddH2O 补充至25 μL。 扩增程序:98℃预变性30 s;98℃变性10 s,54℃退火30 s,72℃延伸45 s,共32 个循环;72℃延伸10 min,4℃保存。 用2%琼脂糖凝胶电泳检测PCR 扩增产物,用AMPure XT beads (Beckman Coulter Genomics,Danvers,MA,USA)纯化PCR 产物,并用Qubit(Invitrogen,USA)进行定量。 采用Agilent 2100 生物分析仪(Agilent,USA)和Illumina(Kapa Biosciences,Woburn,MA,USA)文库定量试剂盒评估扩增子文库的大小和数量。 利用NovaSeq PE250 平台进行库排序。
1.2.3 数据处理 上机测序完成后,得到原始的下机数据,利用overlap 将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的cleandata。利用DADA2 去噪,之后用ASVs(Amplicon Sequence Variants)构建类OTU(Operational Taxonomic Units)表,获得最终的特征表以及特征序列,进一步进行多样性分析、物种分类注释和差异分析等。 对细菌和真菌群落进行Alpha 多样性分析(Chao 1 指数、ACE 指数、Shannon 指数、Simpson 指数),其中Chao 1 指数和ACE 指数用于表征微生物群落丰富度,Shannon 指数和Simpson 指数用于表征微生物群落多样性。 通过R 语言工具绘制Shannon 指数稀释曲线。 使用R 语言vegan 软件包进行NMDS(Nonmetric Multidimensional Scaling)分析和作图。
2 结果与分析
2.1 微生物多样性
Shannon 指数稀释曲线可反映样本在不同测序数量时的微生物多样性。 结果(图1)表明,供试样品的稀释曲线已趋于平稳,表明样品测序数据量足够大,能客观反映花生根系微生物群落的真实情况,可进行数据分析。
Alpha 多样性指数分析(表1)表明,接种AMF 菌剂样品16S rDNA 和ITS Chao 1 指数和ACE 指数均增加,说明接种AMF 菌剂可提高花生根系土壤中细菌和真菌的物种丰富度。16S rDNA的Shannon 指数稍有增加而Simpson 指数没有变化,说明AMF 处理对根及土壤的细菌群落多样性影响较小。ITS 的Shannon 指数减小,Simpson 指数变化较小,说明AMF 处理降低了花生根及土壤真菌多样性。
2.2 AMF 对细菌和真菌群落结构的影响
接种AMF 菌剂和对照组优势细菌均为13种,但优势菌群丰度不同。 与对照相比,接种AMF 菌剂可增加放线菌门(Actinobacteria,10% vs 12%)、变形杆菌门(Proteobacteria,35% vs 36%)、绿弯菌门(Chloroflexi,5% vs 6%)的丰度;丰度减少的有芽单胞菌门(Gemmatimonadetes,8% vs 7%)、厚壁菌门(Firmicutes,7% vs 6%)、疣微菌门(Verrucomicrobia,4% vs 3%)、蓝细菌门(Cyanobacteria,3% vs 2%,图2A、2B)。 说明施用AMF菌剂影响根和土壤中细菌类群的结构组成,其中比例增加最大的为放线菌门。
接种AMF 菌剂和对照组优势真菌均为7 种。与对照相比,接种AMF 菌剂子囊菌门(Ascomycota,71% vs 83%)丰度明显增加,接合菌门(Zygomycota,8% vs 3%)、Fungi -unclassfied(6% vs 3%)、球囊菌门(Glomeromycota,5% vs 3%)、壶菌门(Chytridiomycota,2% vs 1%)、unclassfied(2%vs 1%)丰度减少(图2C、2D)。 说明施用AMF 菌剂影响根和土壤中真菌类群的结构组成,其中比例增加最大的为子囊菌门。 AMF 处理种群比例真菌差异幅度比细菌更大,可能与AMF 是真菌制剂有关。

图2 不同处理下门水平细菌、真菌群落丰度变化
2.3 根系不同部位微生物群落结构差异
对AMF 菌剂处理和对照土壤细菌和真菌群落结构进行NMDS 分析,结果表明,在细菌群落中,根外、根围和根际聚类位置比较近,但与根表和根内的聚类位置较远,并且在接种菌剂后,根表和根内聚类位置有较大变化(图3A)。 在真菌群落中各样点聚类位置都有一定的距离,而且在接种菌剂后,根表和根内聚类位置变化更大(图3B)。 以上结果说明,AMF 菌剂主要影响根内和根表微生物群落结构,而且对真菌的影响更大。
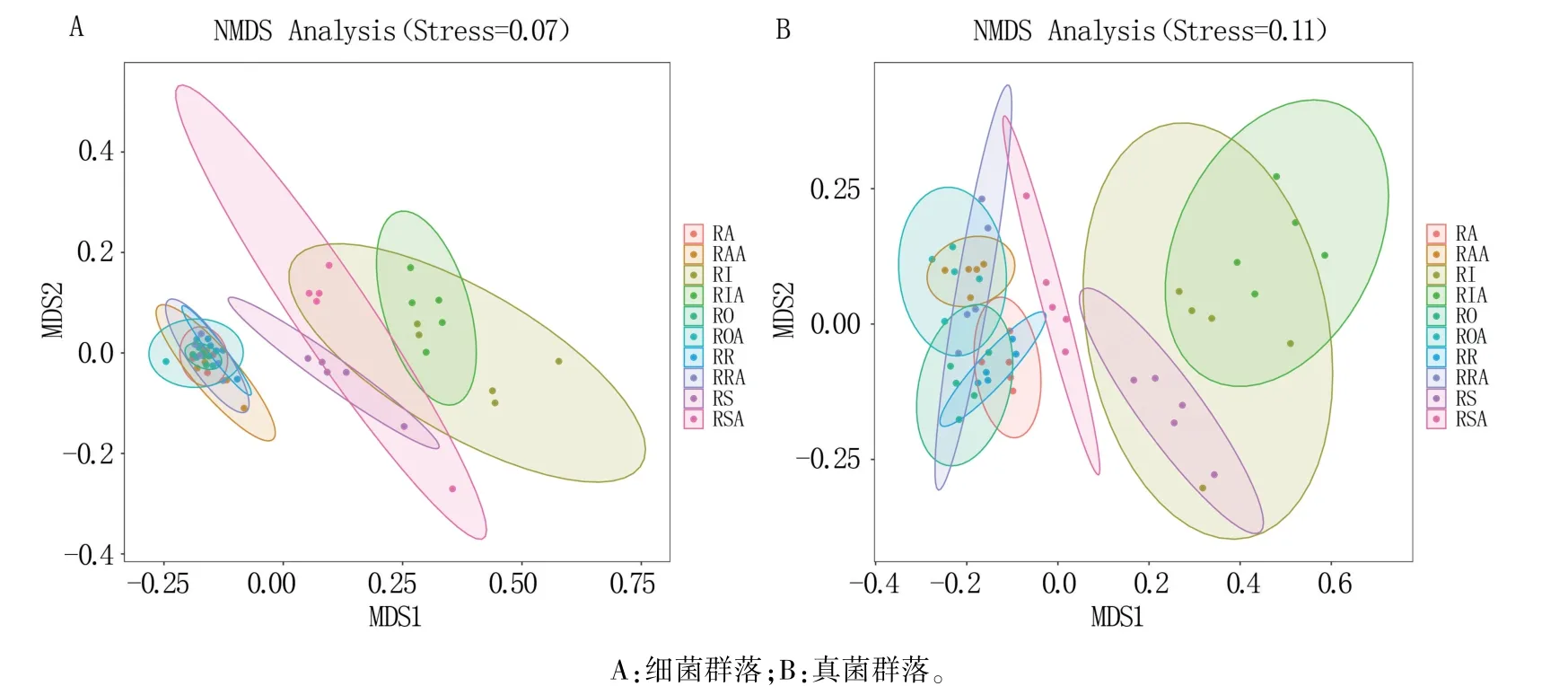
图3 基于Bray-Curtis 距离的非度量多维尺度(NMDS)分析
2.4 AMF 对特征细菌和真菌类群的影响
通过LEfSe 线性判别分析(linear discriminant analysis,LDA)检测不同处理土壤微生物差异。柱形图的长短表示具有显著差异物种的影响大小(图4)。

图4 细菌、真菌LDA 柱形图
对照有显著差异的细菌有芽单胞菌属(Gemmatimonas)、不可培养的鞘脂单胞菌属(unculturedSphingomonas)、 鞘 脂 单 胞 菌 属(Sphingomonas)、鞘脂单胞菌科(Sphingomonadaceae)、鞘脂单胞菌目(Sphingomonadales) 和Microscillaceae;AMF 组有显著差异的为变形菌纲(Deltaproteobacteria)和黏球菌目(Myxococcales)。
对照有显著差异的真菌有接合菌门(Zygomycota)、毛霉亚门(Mucoromycotina)、被包霉科(Mortierellaceae)、球囊菌门(Glomeromycota);AMF 有显著差异的为子囊菌门(Ascomycota)、篮状菌属(Talaromyces)、青霉菌属(Penicillium pinophilum)、发菌科(Trichocomaceae)、散囊菌纲(Eurotiomycetes)、火丝菌科(Pyronemataceae)。
图5A 表明,有20 个细菌类群表现出显著差异。 对照样品中起重要作用的微生物主要为鞘脂单胞菌属(Sphingomonas);接种AMF 菌剂处理的样品中起重要作用的微生物主要为放线菌门的分支杆菌属(Mycobacterium)、丙酸杆菌(Propionibacteriales)、微单孢菌科(Micromonosporaceae);变形菌门的Caulobacterales、变形菌门的红螺菌目(Rhodospirillales)、变形菌纲(Deltaproteobacteria)、变形菌门的Steroidobacteraceae、黏球菌目(Myxococcales)。 放线菌、鞘脂单胞菌和变形菌是细菌群落关键差异物种,其中放线菌和变形杆菌是有益微生物菌群,对植物生长有良好促进作用。鞘脂杆菌目中的部分细菌可参与铁代谢以及少量钾和硫的代谢,影响植物的生理代谢,增强植物抗病和抗虫能力[13]。
由图5B 可知,有49 个类群表现出显著差异。对照样品中起重要作用的微生物主要有壶菌门(Chytridiomycota)、球囊霉门(Glomeromycota)、根霉属(Rhizophagus)、担子菌门粪锈伞科(Bolbitiaceae)。 接种AMF 菌剂样品中起重要作用的真菌有子囊菌门(Ascomycota)、散囊菌纲(Eurotiomycetes)、担子菌门银耳纲(Tremellomycetes)、球囊菌目(Glomerales)、黄丝曲霉属(Talaromyces)。
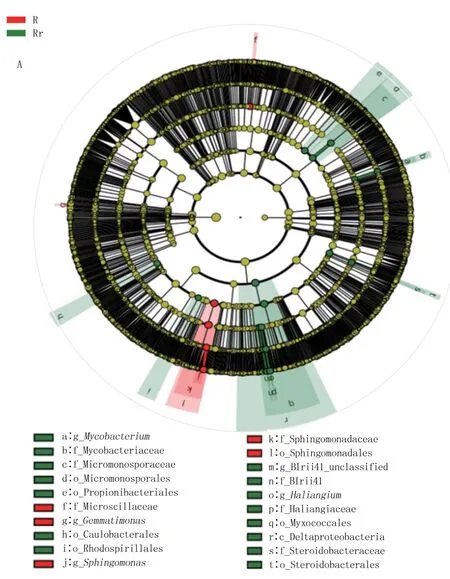
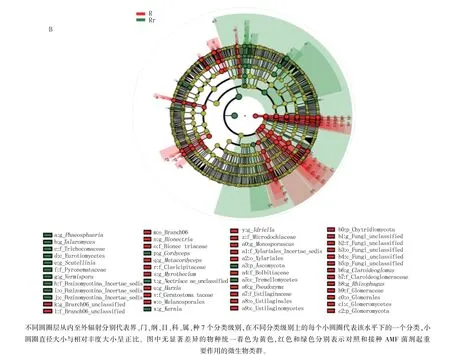
图5 细菌、真菌LEfSe 分析图
3 讨论与结论
植物根系是植物-微生物互作的重要场所[14],接种AMF 后可改善作物根系形状,从而提高作物对养分的吸收[15]。 AMF 在维持根际微生物生态平衡、协调植物生长发育与营养物质的摄取等方面具有重要作用[16]。 16S rRNA 基因和ITS 高通量测序技术可以根据微生物的丰度信息计算根系土壤样品中微生物的多样性指标,对土壤中的优势菌群进行鉴定,以此来全面反映土壤样品中微生物的组成和分布规律。
本研究结果表明,接种AMF 菌剂后花生土壤细菌和真菌的群落结构发生了显著变化。 AMF在一定程度上改变了土壤微生物的群落组成。 细菌群落的Chao 1 指数和Shannon 指数均增加,说明AMF 增加了细菌群落多样性,提高了土壤微生物群落的丰富度。 真菌群落Chao 1 指数增加,说明AMF 具有增加真菌群落丰富度的作用,其引起花生根及环境真菌多样性变化的机理有待进一步研究。 放线菌门是农田土壤中典型的有益微生物种群,是最丰富、最重要的微生物种类之一,也是抗生素(包括农用抗菌素)和众多次级代谢产物主要微生物资源[17]。 放线菌门含有大量植物促生功能菌、病原拮抗菌等,可提高植物获取营养物质的效率,促进植物生长,同时抑制土传病原微生物侵染。 本研究表明放线菌是花生土壤中门水平下的最优势菌(图2)。 厚壁菌门对外界有害条件的抵抗力强,能产生抗菌物质防止多种作物病害。酸杆菌门在细菌群落的相对丰度在10%以上,在土壤细菌群落中普遍存在。 在细菌微生物群落中(图2),随着离根越近,变形杆菌的相对丰度明显增加,变形杆菌门中有多种植物根际有益促生菌,对植物生长有良好促进作用。 如假单胞菌,其营养要求简单,许多研究表明,这类微生物能有效分泌铁载体,促进植物正常生长,对防治花生黄化病有重要意义。 变形菌在土壤的碳、硫、氮循环中起着关键作用[18]。 本研究中,放线菌门、变形杆菌、厚壁菌门、酸杆菌门为花生根系微生物的优势菌门,这与唐杰等[19]的研究结果一致。
综上所述,花生种子接种AMF 菌剂影响根系和土壤中细菌和真菌类群的多样性,明显改变细菌和真菌群落显著差异物种。 本研究可为盐碱地土壤中相关功能微生物分离、进一步筛选优良菌根菌、制备优良复合生物菌剂提供理论基础。
