基于透析法的亚硝基血红蛋白稳定性及机制研究
2022-08-27袁江兰
郭 婧,袁江兰,康 旭,范 超
(湖北工业大学生物工程与食品学院,湖北武汉 430068)
我国畜禽血液资源丰富,尤其是猪血,年产量可达300 万吨左右,但其加工利用却非常有限,目前主要通过干燥制成各种蛋白粉,用作动物饲料,还有相当一部分血液被当作废弃物直接排放,不仅浪费资源,而且污染环境。因此,畜禽血液深加工具有重要意义。
畜禽血液中血红蛋白(Hemoglobin,Hb)约占全血总蛋白的80%。将Hb 亚硝基化制成鲜红色的亚硝基血红蛋白(Nitrosohemoglobin,HbNO),可以替代亚硝酸盐用于肉制品发色,这一直是畜禽血液深加工研究的热点。一般认为,Hb 的亚硝基化是通过亚硝基(-NO)与Hb 分子中的Fe形成了第6 个配位键而实现的,从而生成鲜红色的HbNO。HbNO能赋予肉制品良好的色泽,且具有抗氧化和防腐等作用,因此,期待其在肉品加工领域发挥重要作用。然而,HbNO 很不稳定,光照、氧气等均会使其色泽发生劣变,所以国内一直未有生产应用。目前,关于HbNO 的研究主要集中在其合成与应用方面,对其稳定性及机制的研究却鲜有涉及。透析法是定量分析蛋白质与小分子相互结合的经典方法,具有操作简单、条件易于控制、设备成本低等优点。通过透析可以将与蛋白质结合的小分子和游离小分子分离。小分子与蛋白质形成的复合物被保留在透析袋中,而游离的小分子可以在半透膜内外自由穿过,二者结合作用越弱越易通过透析而解除结合,透析法结合光谱技术可用于分析蛋白质与小分子结合的稳定性及结合机制。目前没有关于透析法用于研究亚硝基血红蛋白的报道。
本文以猪Hb(PHb)为原料,首先对PHb 纯度、结构和等电点等进行表征,然后将PHb 亚硝基化而制备出PHbNO,再以四种光谱学方法作为PHbNO结构表征的手段,利用透析法研究PHbNO 的稳定性及机制,为PHbNO 的进一步研究和应用提供理论依据和数据支持。
1 材料与方法
1.1 材料与仪器
猪血红蛋白粉 襄阳维恩生物科技有限公司;血红蛋白标品(来源于猪血) 源叶生物科技有限公司;亚硝酸钠、异抗坏血酸钠、柠檬酸、柠檬酸三钠国药集团化学试剂有限公司;所有试剂均为国产分析纯。
SCIENTZ-10DN 冷冻干燥机 宁波新芝生物科技股份有限公司;Bio-Rad Mini-PROTEAN Tetra Cell 蛋白电泳装置 美国伯乐公司;Nano ZS+MPT-2 纳米粒度及电位分析仪 英国马尔文公司;UV-2600 紫外可见分光光度计 日本岛津有限公司;F-7000 荧光分光光度计 日立高新技术公司;Mettler-Toledo DSC1 差式扫描量热仪、FE 28 型pH 计 梅特勒-托利多仪器有限公司;Thermo Scientific Nicolet iN10 傅里叶变换红外光谱仪 赛默飞世尔科技公司;J-1500 圆二色谱仪 日本JASCO。
1.2 实验方法
1.2.1 PHb 的纯化 参考文献[13]方法进行蛋白纯化。将猪血红蛋白粉溶解在超纯水(UP)中制备成10%(w/v)的蛋白悬液,25 ℃、350 r/min 磁力搅拌5 h,然后置于4 ℃冰箱过夜,以使蛋白充分溶解并水化。最后,8000 r/min 离心10 min,收集上清液,并于-80 ℃冻结后冷冻干燥,冻干粉密封后于4 ℃避光保存。
1.2.2 PHb 结构和性质测定
1.2.2.1 SDS-PAGE 分析 参考文献[14]方法,将纯化的PHb 配制成2 mg/mL(w/v)的溶液,与上样缓冲液按1:1 混合,煮沸5 min,冷却至室温后上样,上样量为10 μL。浓缩胶浓度为4%(w/v),分离胶浓度为12%(w/v)。浓缩胶中电压控制在70 V,进入分离胶电压增加至110 V。以PHb 标品为对照。
1.2.2.2 紫外-可见光谱分析 利用紫外-可见分光光度计测定蛋白的光谱特征。将样品配制成1.0 mg/mL(w/v)的溶液,稀释100 倍后,室温下扫描250~700 nm 的吸收光谱。
1.2.2.3 热稳定性 利用差示扫描量热仪(DSC)分析PHb 的热稳定性。取3~5 mg 样品于坩埚中密封,以10 ℃/min 的速度从30 ℃升温至180 ℃,密封的空坩埚作对照。
1.2.2.4 等电点(pI)测定 利用纳米粒度电位仪测定Z-电位,电荷为0 时的pH 即为蛋白的pI。将纯化的PHb 配制成1.0%(w/v)的溶液,稀释10 倍后,再将pH 分别调至2.0、3.0、4.0、5.0、6.0、7.0、8.0,然后在室温下测定Z-电位。
1.2.3 PHbNO 结构稳定性及机制
1.2.3.1 PHbNO 的制备 按照文献[16]中的方法,优化反应条件后制备PHbNO。优化的反应条件为:纯化的PHb 溶解于UP 水,持续搅拌过夜,用1.0 mol/L 柠檬酸调节pH 至5.0,然后加入NaNO和异抗坏血酸钠溶解,控制反应体系中PHb 为0.1 mmol/L、NaNO为5.0 mmol/L、异抗坏血酸钠为10.0 mmol/L,溶解后充入N,25 ℃避光条件下反应1 h。反应后样品分为三份,参考文献[13]的方法分别进行不同透析处理:a.不透析,记为未透析PHbNO;b.用截留分子量为7 kDa 的透析袋4 ℃避光透析5 h,期间不换水,记为部分透析PHbNO;c.用截留分子量为7 kDa 的透析袋4 ℃避光透析48 h,期间换水12 次以上,记为彻底透析PHbNO。三份样品分别于-80 ℃冻结后冻干,4 ℃避光密封保存备用。
1.2.3.2 紫外可见-吸收光谱特征 用紫外-可见分光光度计测定PHb 和未透析、部分透析、彻底透析PHbNO 的紫外吸收光谱,保持恒温25 ℃,在350~450 nm 和450~700 nm 范围内扫描的样品浓度分别为0.01 和0.1 mg/mL。
1.2.3.3 荧光光谱特征 采用荧光分光光度计测定荧光光谱特征。参考文献[17]的方法,样品浓度均为2.0 mg/mL,激发波长为280 nm,扫描的发射波长范围为300~400 nm,激发和发射狭缝均为5 nm,电压400 V,扫描速度1200 nm/min,检测器灵敏度为中等。
1.2.3.4 傅里叶红外光谱(FTIR)特征 样品冻干粉以溴化钾压片,置于红外光谱仪中,在500~4500 cm频率范围内扫描32 次。
1.2.3.5 圆二色谱(CD) 利用J-1500 圆二色谱仪测定样品溶液的CD 谱。参考文献[18]的方法,待测样品溶液的浓度均为0.2 mg/mL,测定温度为20 ℃,扫描的波长范围为240~190 nm,分辨率1.0 nm,扫描速率为100 nm/min,比色皿光径0.1 cm。
1.3 数据处理
所有样品均做3 个平行,结果表示为平均值±标准差(SD)。数据统计采用SPSS 23 的Duncan 检验对实验数据进行统计分析,差异显著性水平为<0.05,采用Origin7.0 进行数据整理和作图。
2 结果与分析
2.1 PHb 的结构和性质
2.1.1 PHb 亚基组成和纯度 PHb 分子由两个亚基和两个亚基组成。每个亚基由一条肽链和一个血红素分子构成,其中肽链盘绕、折叠成球形将血红素分子包在里面。
从图1 可知,在SDS-PAGE 中,PHb 主要以分子量约14.0 kDa 的单亚基形式存在,经image Lab软件进行分析后得到表1,PHb 标品含量为46.78%,PHb 含量为50.72%;此外,尚有部分由亚基和亚基组成的二聚体存在,PHb 标品含量为9.30%,PHb 含量为9.61%。显然,纯化的PHb 纯度高于PHb标品。

图1 PHb 的SDS-PAGEFig.1 SDS-PAGE of PHb

表1 SDS-PAGE 中与血红蛋白相关的各条带相对含量Table 1 The relative content of each band related to hemoglobin in SDS-PAGE
2.1.2 PHb 的紫外-可见光谱 PHb 的紫外-可见吸收光谱见图2,包括2 个强吸收峰,分别为蛋白质在280 nm 附近的吸收峰和血红素分子中卟啉环在405 nm 附近的特征吸收峰。原料PHb 的紫外-可见特征吸收光谱与PHb 标品没有明显差异,表明二者结构基本相同。

图2 PHb 的紫外-可见光谱Fig.2 UV-Vis spectra of PHb
2.1.3 PHb 的基本性质 PHb 的热稳定性如图3A所示。蛋白质受热至一定程度,结构发生变化,蛋白质结构发生变化的温度即为变性温度,在DSC 测定的热特性曲线中,蛋白质在其变性温度附近会形成明显的吸热峰。变性温度与蛋白质热稳定性呈正相关,变性温度越高,蛋白的热稳定性也越好。纯化后的PHb 变性温度为80 ℃,略低于PHb 标品(84.97 ℃),与宋璇在文献中报道的PHb 变性温度为82.62 ℃相近。
蛋白质分子所带净电荷为零时的pH 为蛋白质的等电点(pI)。由图3B 中可知,PHb 的pI 为6.8 左右,与李晓静等报道的等电点范围6.8~7.2 一致。

图3 PHb 的基本性质Fig.3 Basic properties of PHb
2.2 PHbNO 稳定性及机制分析
2.2.1 透析对PHbNO 紫外-可见光谱的影响 PHb和PHbNO 在可见光区有强吸收,且吸收光谱有明显差异,暗示着其结构特征存在明显不同,因此可通过测定PHb 特征吸收峰的变化检测PHbNO 的形成。PHb 在420 nm 附近的强吸收峰称为Soret 带,属于卟啉化合物的特征吸收峰,500~750 nm 的若干个弱吸收峰称为Q 带,与PHb 中Fe 的第6 个配位键有关,通常Soret 带的吸光系数约是Q 带的10~20 倍。由图4A 可见,PHb 发生亚硝基化反应后,Soret 带和Q 带均发生明显变化,表明PHbNO 的形成对PHb分子中卟啉的结构产生了影响,并且可能与Fe中第6 个配位键的形成有关,推测反应位点与卟啉相关。据文献报道,NO 可通过配位键与卟啉Fe结合,最终生成PHbNO,从而改变了PHb 的结构,并使其紫外-可见光谱特征发生相应变化。
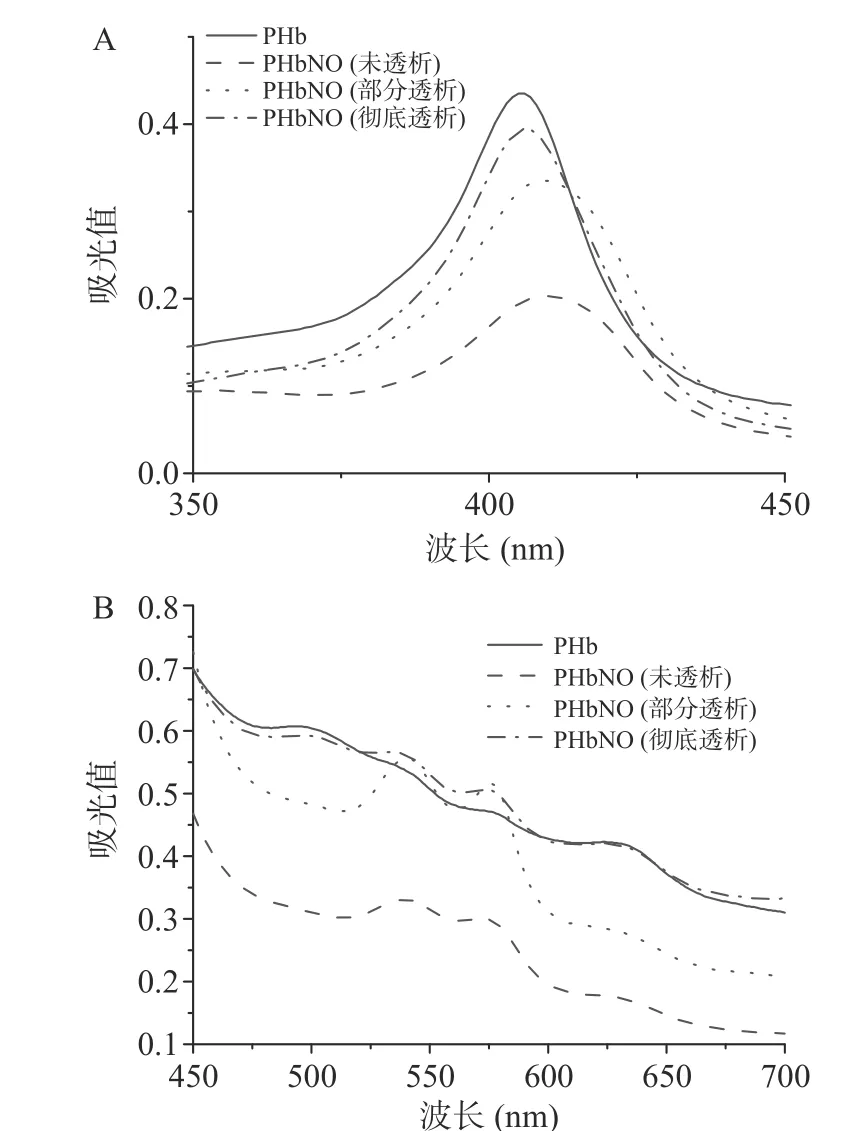
图4 透析对PHbNO 紫外-可见光谱的影响Fig.4 Effect of dialysis on UV-Vis spectrum of PHbNO
观察Soret 带可知,PHb 亚硝基化后,其Soret带的最大吸收峰由406 nm 处红移至412 nm 处,并且峰强度明显降低,这可以通过比较PHb 和未透析的PHbNO 得知。同时Q 带也发生明显变化,494 和630 nm 处的两个吸收峰基本消失,而540 和575 nm处的两个吸收峰明显增强。对PHbNO 体系进行部分透析和彻底透析后,随着体系中NaNO浓度的降低,Soret 带和Q 带又逐渐与PHb 的特征趋于一致,表明体系中PHbNO 又逐渐变为PHb。肌红蛋白与NO结合后的Soret 带和Q 带也有相似的变化规律。由此推测PHb 的亚硝基化反应可能属于可逆反应,PHb 与NO 的配位结合受体系中NO 浓度的影响,当体系中NO 浓度降低时,亚硝基化反应平衡逆向移动,当NO 浓度为0 时,PHbNO 也全部逆向反应生成PHb。
2.2.2 透析对PHbNO 荧光光谱的影响 蛋白质具有内源荧光,经一定波长的紫外光激发后可发射出荧光,其荧光发射光谱特征与该蛋白结构相关,荧光光谱的变化可反映出蛋白质结构变化或蛋白质分子中芳香族氨基酸残基周围微环境的变化。图5 表明,PHb 在280 nm 激发时,可在338 nm 处产生一个很强的荧光发射峰,由色氨酸和酪氨酸残基共同产生。显然,PHb 发生亚硝基化后,在280 nm 的紫外光激发后所发射的荧光强度大幅减弱,可能的原因是,PHb 与NO 发生配位反应后,引起PHb 分子结构发生改变,且发色团周围微环境也发生相应变化,导致PHb 荧光量子产量降低或转移。随着透析处理的进行,荧光强度逐渐增加,表明PHbNO 逐步转变为PHb,PHb 结构和色氨酸和酪氨酸周围微环境又逐步得到恢复,又进一步表明PHb 与NO 的结合为可逆反应。

图5 透析对PHbNO 荧光光谱的影响Fig.5 Effect of dialysis on fluorescence spectra of PHbNO
2.2.3 透析对PHbNO 红外光谱的影响 由图6 可知,彻底透析的PHbNO 与PHb,二者的红外吸收特征光谱基本相同。AmideⅠ带和AmideⅡ带分别为1600~1700 cm和1500~1600 cm范围内的吸收光谱,是蛋白质的特征吸收,这两个谱峰的偏移,特别是AmideⅠ带的偏移,表明蛋白质结构的变化。表2 分析结果表明,彻底透析的PHbNO 与PHb 的AmideⅠ带和AmideⅡ带相同,表明二者蛋白质结构相同。而未透析PHbNO 和部分透析PHbNO 的AmideⅠ带均发生明显偏移,且偏移程度随着透析处理而逐渐减弱,直至彻底透析后又与PHb 一致。
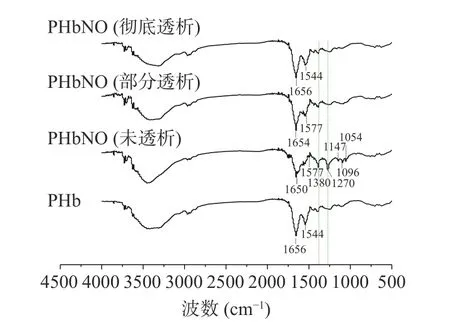
图6 不同透析处理PHbNO 的傅里叶红外光谱Fig.6 Fourier infrared spectra of PHbNO after different dialysis

表2 AmideⅠ、AmideⅡ带分析Table 2 Analysis of Amide I and Amide II bands
图6表明未透析PHbNO 在1054、1096、1147、1270、1380 cm处有明显吸收,其中,1380 cm处为典型的游离NO 的特征吸收峰,而1054、1096、1147、1270 cm左右的峰则是配位NO 的特征峰。显然,透析处理过程中NO 的这些特征峰逐渐消失,至彻底透析时,特别是配位NO 的四个峰全部消失,光谱特征与PHb 一致,表明PHbNO 分子中配位结合的NO 经过彻底透析后已经全部被除去,进一步表明PHb 的亚硝基化为可逆反应,需要一定浓度的NaNO才能维持可逆平衡,保证一定浓度PHbNO的存在。
2.2.4 透析对PHbNO 的CD 谱的影响 图7 表明,PHbNO 和PHb 二级结构存在明显差异,而随着透析处理,这种差异又逐渐减小,直至彻底透析后与PHb 基本相同。表3 中对二级结构的分析表明,彻底透析的PHbNO 与PHb 仅-螺旋存在显著差异(<0.05),其它三种结构无显著差异(>0.05)。未透析和部分透析的PHbNO 与PHb 相比较,-折叠均显著增加(<0.05),-螺旋显著减少(<0.05),转角结构消失,无规卷曲结构增加,且透析程度越高,-折叠含量越低,-螺旋含量越高,至彻底透析时,各二级结构含量又恢复至与PHb 基本一致。PHb 亚硝基化后二级结构的组成和含量变化显著(<0.05),表明硝基化反应后,PHb 高级结构发生了显著变化。-螺旋结构被破坏,蛋白伸展,而无规卷曲增多,则表明加入NaNO以后Hb 的结构变松散,可能是由于PHb 亚硝基化反应后,通过配位键结合在PHb 分子上的亚硝基存在强烈的反位效应,使PHb 分子上与血红素Fe轴向配位的His 部分脱离,Fe 原子轨道能量改变,引起相邻氨基酸相互作用的变化,从而引起PHb 立体结构的改变。PHbNO 彻底透析后二级结构基本恢复,表明在透析过程中随着NaNO的除去,配位平衡被打破,NO 逐渐从PHb 分子上脱离,从而使PHbNO 转变为PHb。再次印证了PHb与NO 的结合是可逆的,与体系中NO 的浓度正相关,因此,PHbNO 的存在需要体系中存在一定浓度的NO。
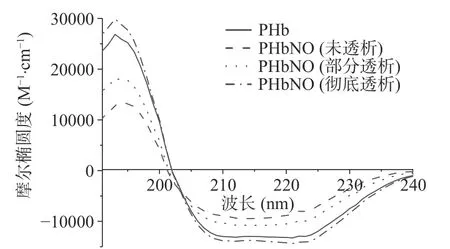
图7 PHbNO 的圆二色谱Fig.7 Circular dichromatogram of PHbNO
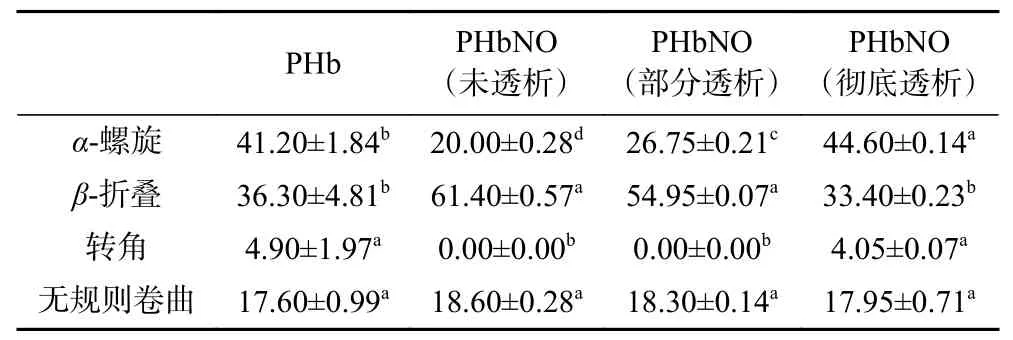
表3 PHbNO 二级结构分析Table 3 Analysis on secondary structure of PHbNO
2.2.5 PHbNO 结构稳定性机制 天然PHb 的每个血红素中含有1 个Fe,Fe位于血红素卟啉环的中心。PHb 血红素的结构直接与PHb 的呈色相关。血红素的卟啉Fe可形成6 个配位键,其中,4 个配位键由卟啉中4 个吡咯环氮原子与Fe构成,第5 个配位键由珠蛋白第93 位组氨酸残基中吲哚侧链上的氮原子提供孤对电子而形成,而第6 可配位轨道处于开放状态,能与很多配体结合,对PHb 呈色具有重要作用。当PHb 发生亚硝基化反应时,NO 与PHb 分子中血红素Fe的第6 个空轨道进行配位键合,引起相邻Fe-His 键的变化,从而引起结构变化,因此呈色也发生相应变化。
根据高铁肌红蛋白活性中心与NO 的配位反应机制和对以上实验结果的综合分析,推测PHb 与NO 的配位反应属于可逆反应。NO 与血红素活性中心Fe发生配位反应后,PHb 结构发生明显的变化。而透析除去或部分除去反应物NaNO,使化学平衡发生逆向移动,从而使已经生成的产物PHbNO浓度逐渐降低,直至彻底透析时,PHbNO 浓度也趋近于0。据此推断PHbNO 的稳定性机制如图8。
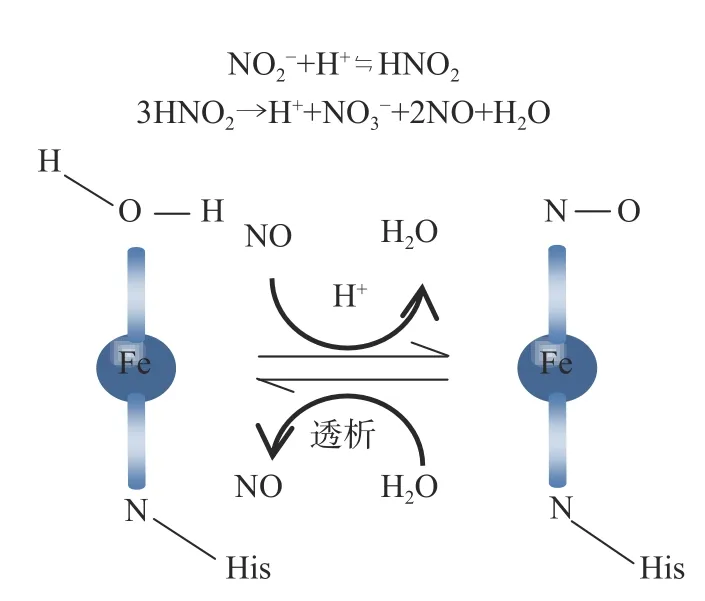
图8 PHbNO 的稳定性机制Fig.8 Stability mechanism of PHbNO
NaNO在酸性条件下释放出NO,NO 以其N 原子进攻卟啉环中的Fe,O 原子受水合形式的影响,与HO 中H 结合成氢键,使水分子的O 与Fe 的配位减弱,最终脱去1 分子的HO,NO 取代HO 生成PHbNO。透析过程中,NO 的浓度减小,处于溶液状态下PHbNO 络合物Fe-N 配位键在HO 的进攻下,NO 又慢慢地脱离,蛋白重新生成PHb。
3 结论
本研究利用透析法,通过对不同透析程度PHbNO 的结构分析,确定了PHb 亚硝基化反应的基本类型和产物PHbNO 的不稳定性及机制。实验结果表明:PHb 发生亚硝基化反应后,Soret 带和Q 带均发生明显变化,在280 nm 的紫外光激发后所发射的荧光强度大幅减弱,红外光谱和CD 光谱表明其二级结构发生明显变化,然而透析后PHbNO 结构与PHb 结构基本一致。显然,PHb 亚硝基化反应为可逆反应,其反应物和产物之间存在化学平衡,产物PHbNO 的稳定性依赖于反应物NaNO的存在,因此在制备和生产PHbNO 作为肉制品发色剂时,还需同时存在一定量的NaNO。本文仅利用光谱学方法对PHbNO 的结构稳定性及机制进行了初步研究,并结合肌红蛋白亚硝基化机制推测出NO 和PHb 的结合结构和稳定性机制,对于PHb 与NO 结合的精确结构还有待于进一步验证。本研究为PHbNO 的合成方法及其在肉制品中的应用提供了参考。
