藏绵羊KLF7基因表达特征分析及其过表达对前脂肪细胞增殖分化的影响
2022-08-23张雪萍石斌刚金夏阳王向彦兰丽娟祁有鹏赵世杰李少斌
张雪萍,石斌刚,金夏阳,王向彦,兰丽娟,时 钰,祁有鹏,赵世杰,李少斌,胡 江
(甘肃农业大学动物科学技术学院,甘肃省草食动物生物技术重点实验室,兰州 730070)
脂肪组织主要分布在动物皮下、内脏及肌肉间等部位,可调节动物机体能量平衡和脂质代谢[1]。动物脂肪代谢过程受到多种转录因子调控,如过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)、CCAAT增强子结合蛋白(CCAAT/enhancer binding protein,C/EBP)、固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBPs)、叉头框蛋白家族(Fork head box,Fox)[2]、锌指蛋白家族2(GATA-binding protein 2,GATA2)和锌指蛋白家族3(GATA-binding protein 3,GATA3)[3]及Krüppel样因子(Krüppel-like factors,KLFs)家族等。
KLFs是一类广泛分布于真核生物体内的转录因子[4],KLFs家族包括17个成员,转录调节细胞增殖、分化和胚胎发育等生物学过程[5]。据报道,KLFs家族多个成员在脂肪细胞分化中发挥重要作用[6],其中KLF4、KLF5、KLF6和KLF15正向调控脂肪细胞分化,而KLF2、KLF3和KLF7则负向调控脂肪细胞分化[7]。KLF7基因也称为UKLF,在动物体多个组织中广泛表达,参与调节神经系统发育、Ⅱ型糖尿病发生及脂质代谢等多种生物学过程[8-11]。研究表明,过表达KLF7基因可抑制C2C12成肌细胞、髓前体细胞增殖[12-13];人和小鼠中过表达KLF7基因会抑制脂肪细胞分化和脂质生成关键基因的表达[10];miR-146b可下调KLF7基因表达并促进人内脏脂肪分化[14];KLF7基因突变与鸡血浆极低密度脂蛋白(very low-density lipoprotein,VLDL)含量、腹脂重等脂肪性状相关[15]。
藏绵羊是中国三大原始绵羊品种之一,目前存栏量约2 500万只,主要分布在海拔3 000 m以上的青藏高原及其毗邻地区[16]。藏绵羊适应青藏高原严酷的环境条件,耐寒、耐粗饲能力强,羊肉纤维致密,细嫩多汁,且具有高蛋白、低脂肪的特点[17],是当地牧民重要的生活资源。脂肪沉积与绵羊生产性能(如肉品质)及饲料报酬等密切相关,但目前对藏绵羊脂肪沉积机制的分子遗传研究相对较少。基于KLF7基因在动物机体脂质代谢中的重要作用,本研究拟检测KLF7基因在藏绵羊各组织及成脂诱导分化不同阶段脂肪细胞中的表达水平,构建pcDNA3.1-KLF7过表达载体,探究过表达KLF7基因对前脂肪细胞增殖及分化的影响,以期为深入了解KLF7基因在藏绵羊脂肪生成中的调控机制提供参考资料。
1 材料与方法
1.1 材料
1.1.1 样品采集 于甘肃省甘南藏族自治州选取饲养条件相同的3月龄健康藏绵羊公羊3只,屠宰后采集皮下脂肪、肾脏、瘤胃、背最长肌、大脑、睾丸、回肠等组织样,同时每只藏绵羊采集腹股沟处约1 cm3皮下脂肪组织样,立刻投入液氮中,带回实验室-80 ℃保存,用于组织表达谱分析及真核过表达载体构建,皮下脂肪样品用含双抗的PBS缓冲液清洗3遍,用于前脂肪细胞增殖分化研究。
1.1.2 主要试剂及仪器 DL2000 DNA Marker、1 kb DNA Marker、Trizol Reagent试剂盒和SYBR Green ProTaqHS预混型qPCR试剂盒均购自艾科瑞生物公司;限制性核酸内切酶KpnⅠ和XhoⅠ均购自TaKaRa公司;大肠杆菌Trans5α感受态细胞购自北京全式金生物科技有限公司;胎牛血清购自Invitrogen公司;PBS缓冲液、双抗和DMEM培养基均购自HyClone公司;反转录试剂盒和HiScript Ⅲ 1st Strand cDNA Synthesis Kit均购自诺唯赞生物科技有限公司;BeyoClickTMEdU-555细胞增殖检测试剂盒购自上海碧云天生物技术有限公司;INVI DNA RNA Transfection ReagentTM转染试剂和CCK-8试剂盒均购自Invigentech公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;油红O染色液购自索莱宝生物科技有限公司。
超微量分光光度计(NanoDropTMOne)、Varioskan LUX酶标仪均购自Thermo Scientific公司;IX53型荧光倒置显微镜购自Olympus公司。
1.2 方法
1.2.1 藏绵羊前脂肪细胞的分离培养 采用酶消化法分离培养藏绵羊前脂肪细胞[18],具体为:脂肪组织去除肉眼可见的血管和筋膜后,用含1%双抗的PBS缓冲液清洗3次后,剪至1 mm3大小的微粒状,加入0.1%中性蛋白酶Ⅱ和Ⅳ型胶原酶,放置摇床消化90 min;加入等体积含10%胎牛血清的DMEM培养基终止消化,用200目的细胞过滤筛,反复过滤消化液,1 500 r/min离心10 min,弃上清;加入1 mL红细胞裂解液,吹打数次,室温静止5 min,1 500 r/min离心5 min。离心结束后弃上清,用含10%胎牛血清的DMEM培养基重悬细胞,并将细胞接种至T25细胞培养瓶中,培养24 h弃上清,细胞长满后进行传代及冻存。
1.2.2 总RNA提取及cDNA合成 根据Trizol Reagent试剂盒说明书分别提取藏绵羊不同组织总RNA,用1.5%琼脂糖凝胶电泳检测RNA完整性,用超微量分光光度计评估RNA纯度和浓度。检测合格的总RNA使用反转录试剂盒反转录为cDNA,-20 ℃保存备用。
1.2.3 PCR扩增与测序 根据GenBank中公布的绵羊(Ovisaries)KLF7基因mRNA序列(登录号:XM_027965128),应用Primer Premier 3.0在线软件设计引物P1(表1),用于藏绵羊KLF7基因CDS区扩增。引物由杨凌天润奥科生物科技有限公司合成。PCR反应体系20 μL:高保真Taq酶10 μL,脂肪组织cDNA(100 ng/μL)0.8 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 7.6 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸10 min;4 ℃保存。PCR扩增产物经1.5%琼脂糖凝胶电泳检测后送杨凌天润奥科生物科技有限公司进行测序。
1.2.4 藏绵羊KLF7基因组织表达差异分析 根据绵羊KLF7基因mRNA序列(GenBank登录号:XM_027965128),应用Primer Premier 3.0在线软件设计引物P2(表1),用于实时荧光定量PCR检测KLF7基因在藏绵羊大脑、皮下脂肪、肾脏、背最长肌、瘤胃、睾丸和回肠中的相对表达量,以β-tubulin为内参基因,对应引物P9(表1)。引物均由杨凌天润奥科生物科技有限公司合成。PCR反应体系20 μL:2×SYBR qPCR MasterMix 10 μL,上、下游引物(10 μmol/L)各0.4 μL,cDNA(100 ng/μL) 2 μL,ddH2O补足体系。PCR反应条件:95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火32 s,72 ℃延伸30 s,共40个循环。每个样品设置3个重复。
1.2.5KLF7基因在藏绵羊脂肪细胞不同分化期的表达 复苏藏绵羊前脂肪细胞,将前脂肪细胞接种于12孔板,加入适量基础生长培养基(10%胎牛血清、90% DMEM基础培养基、0.1%双抗)培养;待细胞汇合度至90%时,用MDI(DMEM基础培养基+胰岛素+地塞米松+3-异丁基-1-甲基黄嘌呤)诱导分化培养基培养至第8天。按照1.2.2方法分别从分化第0、2、4、8天的脂肪细胞提取总RNA并反转录为cDNA,按照1.2.4方法使用P2引物检测诱导分化不同阶段脂肪细胞中KLF7基因的表达量。

表1 引物信息
1.2.6 过表达载体构建及测序 将1.2.3测序正确的KLF7基因PCR扩增产物纯化后,使用KpnⅠ和XhoⅠ限制性核酸内切酶37 ℃酶切30 min,酶切产物再次纯化;将纯化产物与Solution Ⅰ连接酶混合均匀,连接至pcDNA3.1(+)真核表达质粒,转化大肠杆菌Trans5α感受态细胞,涂布于含有氨苄青霉素的LB固体培养板上,于摇床中倒置培养过夜;次日挑取单克隆菌落于LB液体培养基中摇至浑浊有明显沉淀后,利用pcDNA3.1(+)通用引物(T7-BGH)进行菌液PCR扩增鉴定,经1.5%琼脂糖凝胶电泳检测后,采用质粒提取试剂盒提取质粒并送测序,重组质粒命名为pcDNA3.1-KLF7,-20 ℃保存备用。
1.2.7 藏绵羊前脂肪细胞增殖及活力检测 取出冻存的藏绵羊前脂肪细胞,37 ℃水浴锅解冻复苏后接种于12孔板内,培养24 h待细胞汇合度达到50%左右,将pcDNA3.1-NC(对照组)和pcDNA3.1-KLF7质粒转染至12孔板内,48 h后按照1.2.2方法提取细胞总RNA。应用实时荧光定量PCR检测KLF7和增殖标志基因CDK4、CyclinB1和CyclinD1的mRNA表达量,以β-tubulin为内参基因,相应基因的引物分别为P3、P4、P5和P9(表1),PCR反应体系及程序同1.2.4。按照BeyoClickTMEdU-555细胞增殖检测试剂盒处理步骤,对转染pcDNA3.1-NC和pcDNA3.1-KLF7质粒48 h后的脂肪细胞进行EdU染色处理,染色后放置荧光显微镜观察染色结果并拍照。采用CCK-8试剂盒检测前脂肪细胞活力,将pcDNA3.1-NC和pcDNA3.1-KLF7过表达质粒转染至96孔板,48 h后每孔加入10 μL的CCK-8试剂,并在37 ℃孵育1 h后,VarioskanTMLUX酶标仪测定每个样品在450 nm波长的光密度值。
1.2.8 藏绵羊前脂肪细胞的转染、诱导分化及油红O染色 取出冻存的前脂肪细胞,接种于12孔板,培养24 h后,按照INVI DNA RNA Transfection ReagentTM转染试剂盒说明书将pcDNA3.1-NC和pcDNA3.1-KLF7质粒分别转染至细胞内,基础生长培养基培养24 h后,替换为MDI(DMEM基础培养基+胰岛素+地塞米松+3-异丁基-1-甲基黄嘌呤)诱导分化培养基继续培养2 d,8 d后收集细胞,按照1.2.2方法提取总RNA。用实时荧光定量PCR检测KLF7基因及脂肪细胞分化标志基因PPARγ、Glut4和ELOVL6的mRNA表达情况,以β-tubulin为内参基因,相应基因的扩增引物分别为P6、P7、P8和P9(表1),PCR反应体系及程序同1.2.4。此外,检测转染pcDNA3.1-NC和pcDNA3.1-KLF7质粒后脂肪细胞脂滴着色情况,即4%多聚甲醛固定脂肪细胞30 min,PBS清洗3遍,油红O染色液染色1 h,置于荧光倒置显微镜观察着色脂滴并拍照。
1.2.9 数据统计分析 使用2-ΔΔCt法计算相对表达量。利用SPSS 26.0软件进行显著性分析,使用Image J软件统计脂肪细胞中脂滴含量和EdU阳性细胞数目,利用GraphPad Prism 8.0绘图。结果以平均值±标准差表示,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 KLF7基因在藏绵羊不同组织及不同分化期脂肪细胞中的表达特性
KLF7基因在藏绵羊不同组织及不同分化期脂肪细胞中的表达谱见图1。由图1A可知,KLF7基因在藏绵羊不同组织中均有表达,且有明显的组织特异性,以回肠表达水平为参照,KLF7基因在藏绵羊大脑、皮下脂肪和肾脏中表达量较高,且显著高于背最长肌、瘤胃、睾丸和回肠(P<0.05)。由图1B可知,以分化第0天的脂肪细胞表达水平为参照,KLF7基因在成脂分化第2天的脂肪细胞中表达水平最高,且显著高于第0、4和8天(P<0.05);在成脂分化第0天最低,且显著低于第4和8天(P<0.05)。
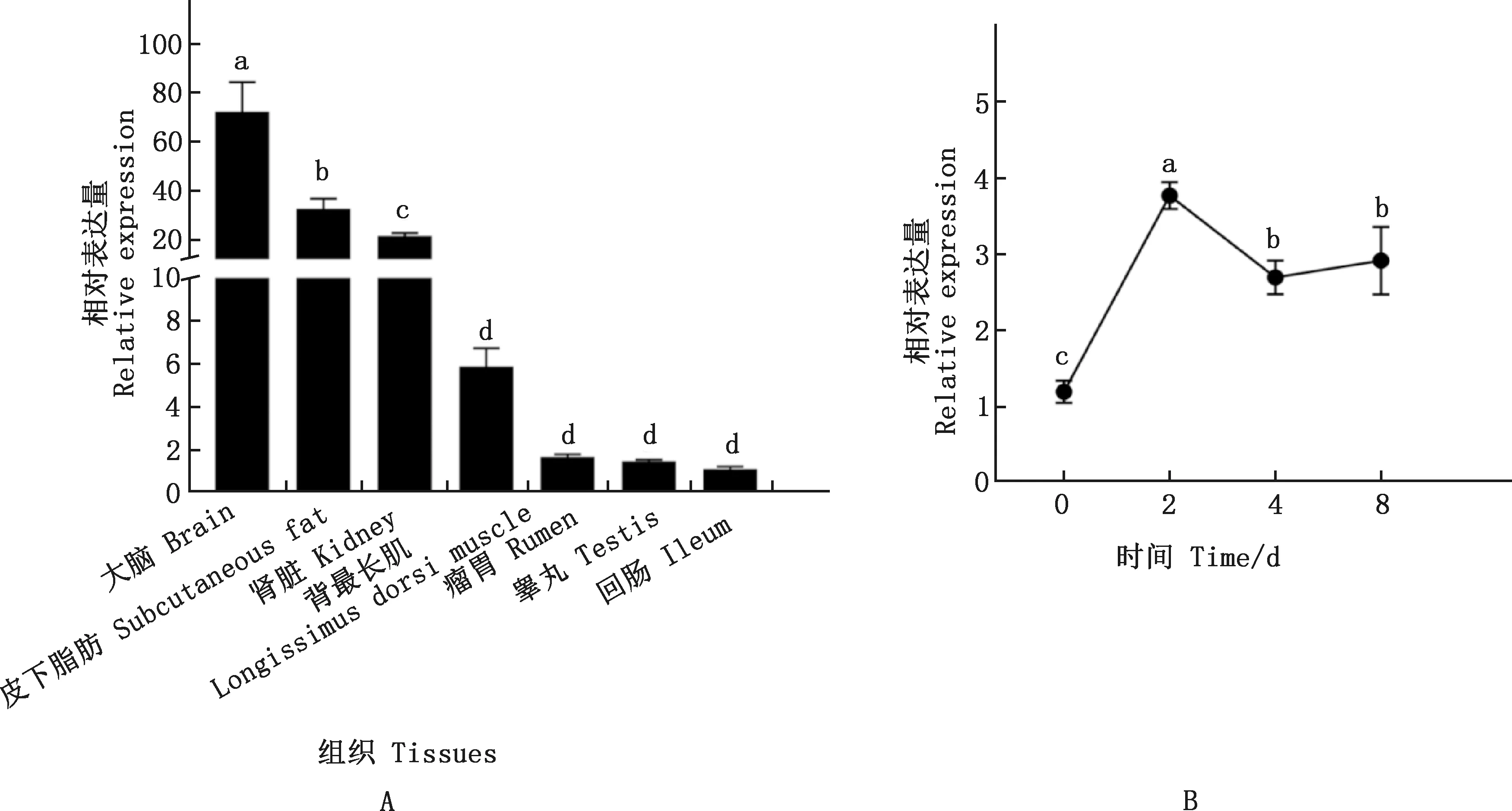
肩标不同字母表示差异极显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)Values with different letter superscripts mean extremely significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05)图1 KLF7基因在藏绵羊不同组织(A)及不同分化期脂肪细胞(B)中的表达Fig.1 Expression of KLF7 gene in different tissues (A) and adipocytes at different differentiation stages (B) of Tibetan sheep
2.2 KLF7基因真核过表达载体鉴定
对藏绵羊KLF7基因真核过表达载体(pcDNA3.1-KLF7)进行鉴定,结果显示,片段大小为1 143 bp(图2),与预期相符。取鉴定正确的菌液提取质粒并测序,结果与GenBank中绵羊KLF7基因CDS序列(登录号:XM_027965128)相一致,表明成功构建了藏绵羊KLF7基因真核过表达载体。
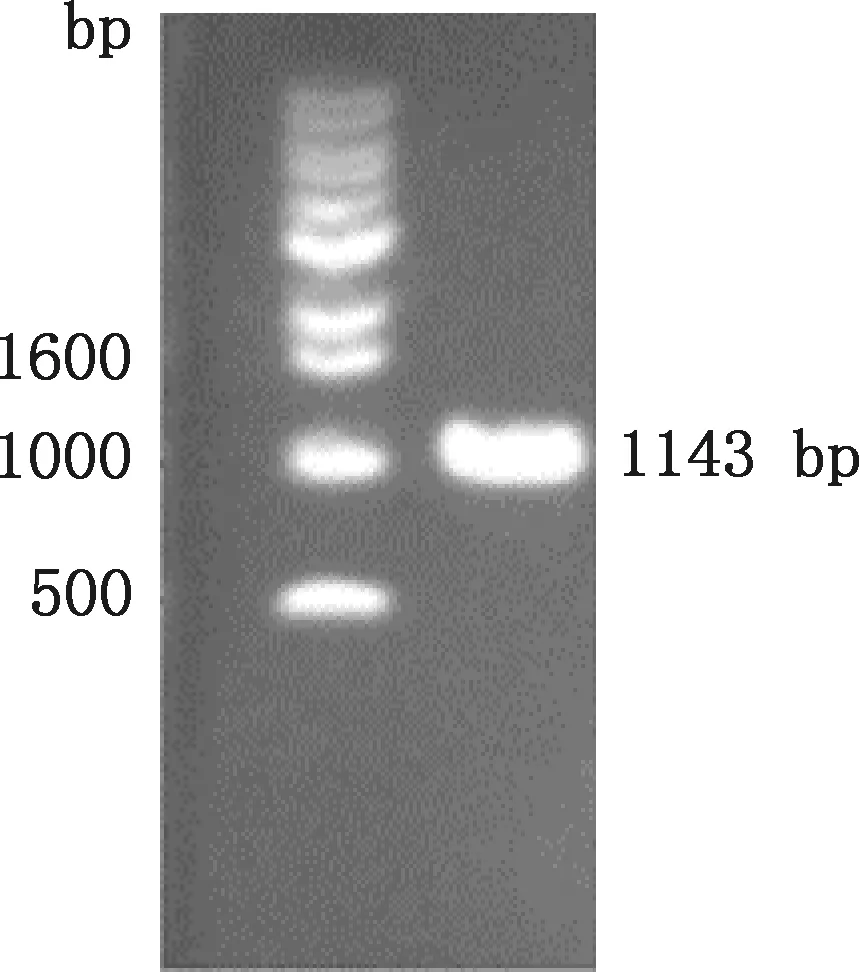
图2 藏绵羊KLF7基因过表达载体PCR扩增电泳图Fig.2 Agarose gel electrophoresis of PCR amplification of KLF7 gene overexpression vector in Tibetan sheep
2.3 过表达KLF7基因对藏绵羊前脂肪细胞增殖的影响
2.3.1 细胞增殖标志基因mRNA表达 过表达
KLF7基因对藏绵羊前脂肪细胞增殖的影响见图3。由图3A可知,前脂肪细胞转染pcDNA3.1-KLF7质粒48 h后,KLF7基因的表达水平较pcDNA3.1-NC提高了67倍以上(P<0.01),表明KLF7基因成功过表达。由图3B可知,细胞增殖标志基因CDK4、CyclinB1及CyclinD1表达水平比对照组显著或极显著下调(P<0.05;P<0.01)。表明过表达KLF7基因抑制了藏绵羊前脂肪细胞增殖标志基因的表达。

*,差异显著(P<0.05);**,差异极显著(P<0.01)。下同*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01).The same as below图3 藏绵羊前脂肪细胞KLF7(A)及增殖标志基因(B)mRNA相对表达量Fig.3 The mRNA relative expression of KLF7 (A) and proliferation marker genes (B) in preadipocytes of Tibetan sheep
2.3.2 过表达KLF7基因对前脂肪细胞EdU阳性细胞数量的影响 转染pcDNA3.1-NC和pcDNA3.1-KLF7质粒48 h后,前脂肪细胞EdU染色及阳性细胞比例见图4。由图4可知,过表达KLF7基因极显著下调了EdU阳性细胞数量(P<0.01),表明过表达KLF7基因可抑制新生成的前脂肪细胞数目,即抑制前脂肪细胞的增殖。

A,EdU染色图(40×);B,EdU阳性细胞比例A,EdU staining chart (40×);B,Percentage of EdU positive cells图4 前脂肪细胞过表达KLF7基因后EdU阳性细胞数量Fig.4 Number of EdU positive cells after overexpression of KLF7 gene in preadipocytes
2.3.3 过表达KLF7基因对前脂肪细胞活力的影响 转染pcDNA3.1-NC和pcDNA3.1-KLF7质粒48 h后,采用CCK-8检测前脂肪细胞活力,结果显示,过表达KLF7基因极显著降低了前脂肪细胞活力(P<0.01,图5)。
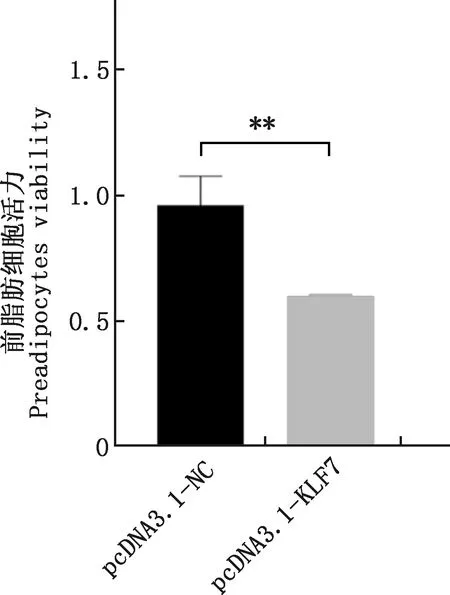
图5 过表达KLF7基因后对前脂肪细胞活力的影响Fig.5 Effect on cell viability after KLF7 gene overexpression in preadipocytes
2.4 过表达KLF7基因对藏绵羊前脂肪细胞分化的影响
2.4.1 细胞分化标志基因mRNA的表达 过表达KLF7基因藏绵羊前脂肪细胞分化标志基因的表达水平见图6。由图6A可知,转染pcDNA3.1-KLF7质粒后KLF7基因表达量极显著高于pcDNA3.1-NC(P<0.01),即KLF7基因成功过表达。由图6B可知,过表达KLF7基因后脂肪细胞分化标志基因PPARγ、Glut4和ELOVL6的mRNA相对表达水平均显著或极显著低于pcDNA3.1-NC组细胞(P<0.01;P<0.05),表明脂肪细胞过表达KLF7基因后抑制了脂肪细胞分化标志基因的表达。
2.4.2 脂肪细胞过表达KLF7基因对脂滴含量的影响 过表达KLF7基因的前脂肪细胞油红O染色和脂滴生成量测定结果见图7。由图7可知,前脂肪细胞过表达KLF7基因后,脂滴生成量极显著减少(P<0.01),表明过表达KLF7基因极显著下调了前脂肪细胞内的脂滴含量。

图6 脂肪细胞过表达后KLF7(A)和分化标志基因(B)mRNA相对表达量Fig.6 The mRNA relative expression of KLF7 (A) and adipogenic marker genes (B) after overexpression in adipocytes
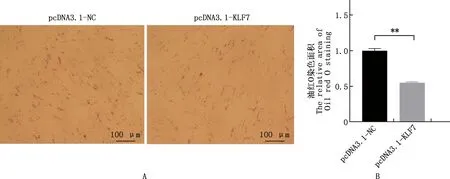
图7 油红O染色的前脂肪细胞(A)及其脂滴含量(B)Fig.7 Oil red O staining (A) and amount of lipid droplets (B) in preadipocytes
3 讨 论
3.1 藏绵羊KLF7基因表达特性分析
KLF7基因广泛存在于海胆、鱼、两栖类、鸟类、爬行类、哺乳类和人等动物的多种组织中,对神经系统发育和脂肪形成发挥着重要作用。本研究发现,藏绵羊KLF7基因在大脑组织中表达量最高,其次是皮下脂肪和肾脏,而在背最长肌、瘤胃、睾丸和回肠中的相对表达水平较低。基因在动物不同组织中的表达量与其功能息息相关,KLF7基因在藏绵羊大脑中的高表达可能与其脑神经发育相关。研究证实,KLF7基因在小鼠脊索、大脑皮层及小脑等部位均表达,参与哺乳动物神经系统发育,促进轴突生长和神经元分化[19];KLF7基因可调控鸡腹脂重及血浆中VLDL含量[15,20],且在多个物种脂肪组织中高度表达,如牦牛[21]、黄牛[22]、猪[23]及高腹部脂肪肉鸡[24]。本研究中,KLF7基因在藏绵羊脂肪组织中高表达,推测该基因与藏绵羊脂肪沉积密切相关,这一结果也为进一步研究过表达KLF7基因对前脂肪细胞增殖和分化的影响奠定了基础。
前脂肪细胞分化受许多转录因子协同作用,对动物脂肪沉积有重要影响。研究表明,KLFs参与调控动物前脂肪细胞分化[25-26]。KLF7基因在藏绵羊前脂肪细胞分化过程中的时序表达表明,在未分化的前脂肪细胞中KLF7基因表达量较低,分化早期(第2天)的脂肪细胞表达量最高。KLFs家族成员在脂肪细胞分化过程中存在时序表达,前脂肪细胞中KLF2基因表达量较高,分化状态下KLF3、KLF4、KLF5和KLF7基因表达量较高,且随着分化时间延长其表达量逐渐下降[7]。朱江江等[27]研究发现,KLF7基因在山羊脂肪细胞诱导分化第0天表达量极低,第3天达到最高峰,从5天开始逐渐下降。Li等[28]研究表明,KLF7基因在山羊皮下脂肪细胞诱导分化第2天的表达量最高,与本研究结果一致。但Zhang等[24]研究表明,鸡前脂肪细胞中KLF7基因诱导分化的0 h表达量最高,第1、2天表达量著降低,而第3天又上升到峰值,其时序表达结果与藏绵羊及山羊有所不同,这可能与物种有关。
3.2 过表达KLF7基因抑制藏绵羊前脂肪细胞增殖
前脂肪细胞的增殖是脂肪组织发育过程中的关键事件,研究证实,KLF7基因参与调控细胞的增殖[29],但有关藏绵羊前脂肪细胞增殖的功能研究较少。本研究通过检测前脂肪细胞增殖标志基因、EdU染色及细胞活力发现,过表达KLF7基因可显著抑制前脂肪细胞增殖。细胞增殖过程受众多细胞周期调节因子调控,如CDKs、Cyclins及CKI,其中CDK4、CyclinB1和CyclinD1基因可加速细胞G1期到S期过渡,从而正向调节细胞增殖[30]。王小斌[12]研究表明,过表达KLF7基因可抑制C2C12成肌细胞增殖;Schuettpelz等[13]报道,过表达KLF7基因可抑制髓前体细胞增殖;Li等[29]研究发现,miR-103通过靶向KLF7基因促进非小细胞肺癌增殖,推测过表达KLF7基因可抑制脂肪细胞增殖;但Zhang等[24]研究表明,过表达KLF7基因可促进鸡前脂肪细胞增殖,可能是KLF7基因在不同物种中表达规律具有差异性,具体原因尚需进一步研究。
3.3 过表达KLF7基因抑制藏绵羊前脂肪细胞分化
前脂肪细胞分化是不同分化标志基因时序表达的过程。PPARγ、Glut4、ELOVL6等基因在脂肪细胞分化过程中发挥重要作用,检测此类标志基因有助于深入了解脂肪细胞中脂质代谢。PPARγ是脂肪沉积关键转录因子,其表达被抑制后导致脂质分解,脂肪酸合成减少[31]。研究表明,PPARγ与视黄醛X受体结合形成异源二聚体,并与其他核受体共同作用进而调控下游靶基因脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)和脂蛋白脂酶(lipoprotein lipase,LPL)表达,最终导致脂肪沉积[32];Glut4主要分布于脂肪、骨骼肌和心肌组织细胞内,是哺乳动物最主要的葡萄糖转运体,在小鼠脂肪和肌肉组织中表达量较低[33-34];ELOVL6在白色脂肪和小肠中表达量较高[35],可影响单不饱和脂肪酸的延长,生成油脂[36]。据报道,KLF7基因可负向调控脂肪细胞分化,并结合其靶基因PPARγ的启动子,抑制PPARγ基因启动子活性,最终抑制一些脂质生成关键基因如Glut2、Glut4和脂肪酸合成酶(fatty acid synthase,FASN)等表达,从而负向调控脂肪细胞分化[7]。本研究发现,藏绵羊前脂肪细胞过表达KLF7基因后PPARγ、Glut4和ELOVL6基因表达量显著降低。Kawamura等[10]及Zhang等[24]报道,过表达KLF7基因可抑制人及鸡前脂肪细胞分化;Sun等[37]研究证实,KLF7基因可调控GATA3基因转录,抑制鸡脂肪细胞分化;金钊等[38]研究表明,KLF7基因可调控低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)转录,进而抑制脂肪组织发育;但Li等[28]研究表明,KLF7基因敲低则抑制山羊肌内脂肪及皮下脂肪细胞分化,与本研究结果不同,推测可能是细胞类型不同或细胞在体内具有复杂的调控机制导致,具体原因仍需进一步研究。
4 结 论
KLF7基因在藏绵羊大脑、皮下脂肪、肾脏、背最长肌、瘤胃、睾丸和回肠中广泛表达,且大脑、皮下脂肪及肾脏中表达量较高;诱导分化后的脂肪细胞表达量显著高于分化前,且分化第2天表达量最高;KLF7基因参与藏绵羊脂肪细胞增殖分化过程,其过表达可抑制前脂肪细胞的增殖及分化。研究结果为进一步探究藏绵羊脂肪沉积的分子调控机制提供参考。
