基于高通量测序技术解析中高温制曲细菌群落的演替规律
2022-08-20葛向阳张龙云李燕荣贾亚伟
杨 勇,葛向阳,2,张龙云,李燕荣,贾亚伟
(1.江苏洋河酒厂股份有限公司,江苏宿迁 223800;2.宿迁学院,江苏宿迁 223800)
作为中国传统固态发酵蒸馏酒的重要物质保障,大曲具有糖化、发酵、生香等功能,直接决定了酒的风格及档次。俗话说“曲定酒型”“曲乃酒之骨”,作为绵柔特色开创者的洋河绵柔型白酒,自然离不开制曲。作为一种富含多酶多菌的微生态制品,制曲过程中可培养微生物的消长及生化指标的变化规律已有研究,然而,大量微生物无法培养,传统的培养方法只能在某一特定的培养条件下培养,条件单一,难以全面地反映微生物群落的多样性及其结构组成。
随着分子生物学的发展,基于免培养的高通量测序技术越来越广泛地应用于微生物群落结构的解析中。苏葛等利用高通量测序技术在不同大曲等级判定中进行了应用,揭示了洋河中高温大曲独特的微生物群落多样性;吴树坤利用高通量测序比较分析四川不同地区浓香型大曲的微生物群落结构,发现不同地区大曲的微生物多样性存在差异;李静心等采用高通量测序技术对白酒高温大曲和中高温大曲进行分析,比较了2 种大曲真菌结构的差异。目前对于大曲的研究多集中在成品曲的微生物群落结构,根据Li对不同工艺的中、低温大曲的微生物群落变化的研究,发现在不同环境作用下,微生物群落结构会发生改变。
本试验以中高温大曲为研究对象,首次采用高通量测序技术对培菌发酵几个主要阶段的细菌群落进行分析,研究各阶段优势微生物的分布、丰度及其演替规律,为进一步剖析制曲发酵机理提供可靠的微生物信息。
1 材料与方法
1.1 材料、仪器
大曲样品:中高温大曲培养过程中入房(编号:RF,发酵0 d)、并房(编号:BF,发酵5 d)、上架(编号:SJ,发酵9 d)、大火(编号:DH,发酵15 d)、下架(编号:XJ,发酵21 d)、出房(编号:CF,发酵35 d)时各个阶段的混合样,分别粉碎、混匀、装袋后,于-80 ℃保存备用。
仪器设备:Novaseq 6000 PE250 平台、美国Bio-Rad Laboratory S1000型PCR仪。
1.2 实验方法
1.2.1 DNA提取
使用MOBIO PowerSoil® DNA Isolation Kit 进行基因组DNA 抽提后,利用Thermo NanoDrop One 检测DNA的纯度和浓度。
1.2.2 PCR扩增及产物电泳检测
以基因组DNA 为模板,根据测序区域的选择,使用带barcode 的特异引物及TaKaRa Premix Taq® Version 2.0(TaKaRa Biotechnology Co.,Dalian,China)进行PCR扩增。
1.2.2.1 引物对应区域
16S V4 区引物(515F 和806R):鉴定细菌多样性;扩增区域还包括:16S V3-V4/16S V4-V5;古菌16S V4-V5;功能基因对应引物等。
1.2.2.2 PCR反应体系(表1)

表1 PCR反应体系列表
1.2.2.3 PCR 反应条件

每个样本进行3 个重复,并将同一样本的PCR产物进行混合。
1.2.2.4 PCR 产物电泳检测
用1 %琼脂糖凝胶电泳检测PCR 产物的片段长度和浓度,主带长度在正常范围内(例如16S V4:290-310 bp/16S V4-V5:400-450 bp 等)的样品可用于进一步的实验。
1.2.3 Pooling及切胶纯化
利 用 GeneTools Analysis Software (Version4.03.05.0,SynGene)对PCR 产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各PCR 产物进行混合。使用E.Z.N.-A.® Gel Extraction Kit(Omega,USA)凝胶回收试剂盒回收PCR 混合产物,TE缓冲液洗脱回收目标DNA片段。
1.2.4 建库及测序
按照NEBNext® Ultra™II DNA Library Prep Kit for Illumina®(New England Biolabs,USA)标准流程进行建库操作。使用Illumina Nova 6000 平台对构建的扩增子文库进行PE250 测序。
2 结果与分析
2.1 测序有效性分析
图1 是以richness 指数来反映本实验中不同培养阶段大曲样本的稀释曲线,richness 指数常用来估计物种丰富度。本实验对6 个不同培养阶段的大曲进行测序,由图1 可以看出,随着测序深度的增加,richness 指数曲线都呈现先增加后逐步趋于平缓的趋势,说明测序数据量渐进合理,本实验各个样本的测序数据量足够大,可以反映样本中绝大多数微生物的物种信息。
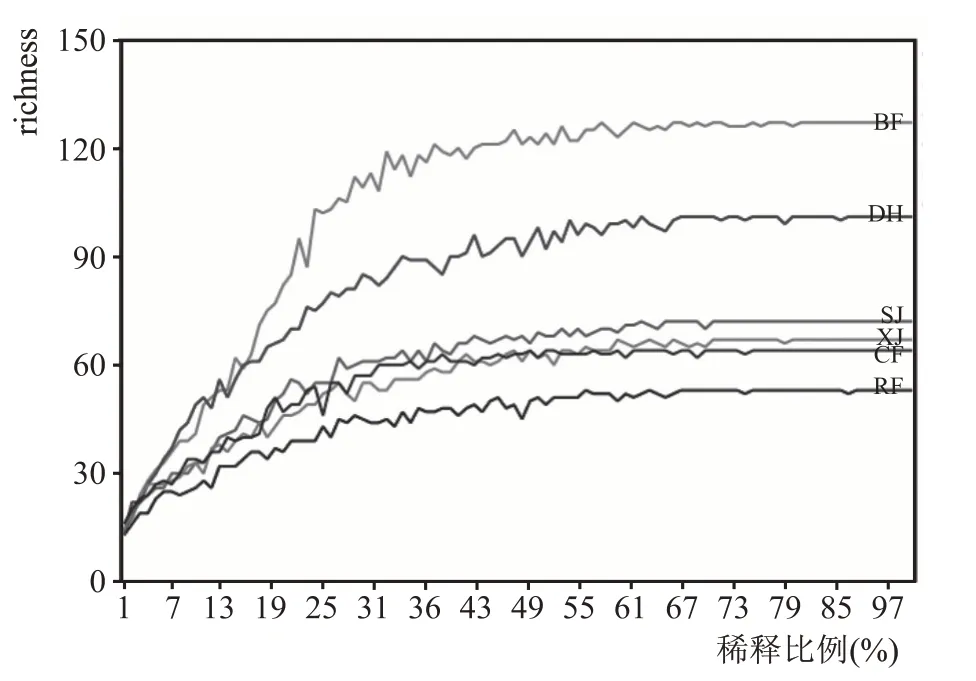
图1 大曲培养各阶段样品的richness曲线
2.2 Alpha多样性分析
OTU 是在系统发生学或群体遗传学研究中,为便于分析,通过归类操作,将序列相似性大于等于97 %分归为同一OTU。Chao1 和Ace 指数是用于计算群落丰度的指数,其值越大说明样品中物种丰度越高。Simpson 指数是计算菌群多样性的指数,其值越大说明群落多样性越低。指数Coverage 用于表征各样本文库的覆盖率,反映测序深度是否能覆盖整个微生物群落,是否能代表样本中所有微生物的真实情况。
由表2 可知,所有样品的序列覆盖度(coverage)均大于0.99,证明本次测序的结果能够真实的反映所有样本细菌微生物的菌群结构。中高温大曲刚入房时,细菌丰度最低、菌群多样性居中,说明通过自然接种的微生物数量有限;主发酵期,营养水分充足,环境适宜,细菌大量增殖,并房时细菌丰度与菌群多样性都迅速升高,细菌丰度升至最高;进入潮火期,随着曲心温度进一步升高,常温细菌逐渐不适应高温环境而消亡,耐高温细菌进一步生长繁殖,上架时细菌丰度开始降低但菌群多样性升高;随着曲心温度保持60 ℃左右进入大火期,耐热的芽孢杆菌逐渐开始占据优势,淘汰大量不耐热的细菌,细菌丰度开始升高但菌群多样性降低;经过大火期的高温驯化与淘汰,下架时的细菌丰度与菌群多样性都较大火期降低;此后进入养曲期,曲心水分进一步降低,干燥缺水的环境逐渐不适合微生物的生长繁殖,出房时,细菌丰度进一步降低但菌群多样性升至最高。
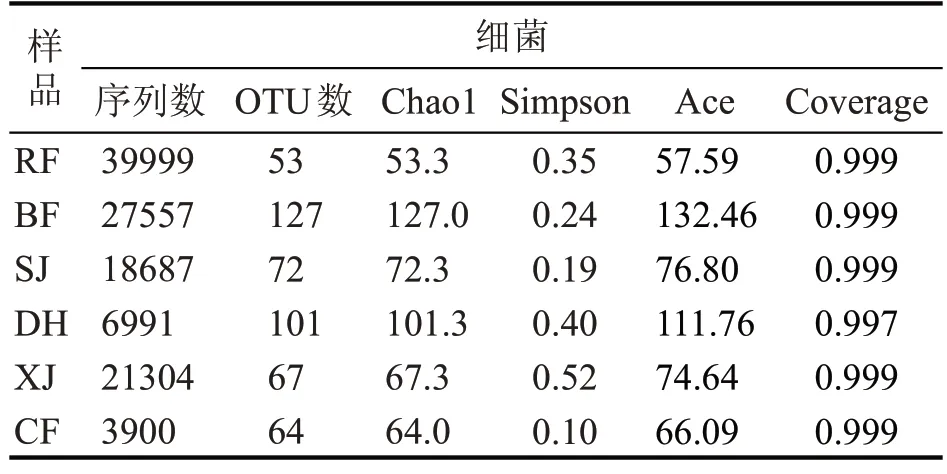
表2 大曲培养各阶段样品细菌Alpha多样性指数
2.3 OTU分布Venn分析
对中高温大曲不同培养阶段获取的细菌OTU进行统计分类,对不同样品之间相对共有的以及独有的OTU 数进行叠加,得出OTU 分布Venn 图,比较OTU数目组成相似性及重叠情况。
如图2 所示,细菌有19 个OTU 是中高温大曲培养各阶段所共有的,共有种群数量的占比达到23.18%~86.36%。就独有的OTU 数而言,并房阶段高达63,不仅远高于共有OTU 数,也远高于其他发酵阶段,充分显示了主发酵阶段对菌群多样性的的重要性;大火阶段,独有OTU 数为25;入房阶段,独有OTU 数为15;出房、上架与下架阶段的独有OTU数较少,相差不大。

图2 大曲培养各阶段OTUs交叠Venn图
2.4 不同分类水平的物种变化
在了解每个OTU 对应的物种后,由于存在同一个物种具有多个不同的OTU 的情况。通过合并相同物种分类的OTU,从门、纲、目、科、属不同分类水平,统计平均含量前15 的物种,其余的物种归于others 中,根据百分比绘制细菌的分布柱状图,结果分别见图3—图6。
从图3 中可以看出,在门与纲水平上,不同培养阶段大曲中的细菌都是以厚壁菌门中的芽孢杆菌纲为主,占比64%以上,此外还有变形菌门中的变形菌纲,放线菌门中的放线菌纲。变形菌纲在入房时占比达到35 %,其他门与纲水平的细菌都很少,占比小于1 %。随着发酵的进行,门与纲水平的细菌占比变化趋势相同,芽孢杆菌纲所占比例呈先增加、后减少、而后波动变化的趋势;变形菌纲呈先快速减少后缓慢增加的趋势;放线菌纲则主要在大火期出现,占比7 %左右,而后先缓慢减少再缓慢增加。
图3 大曲培养各阶段细菌在门与纲水平上的分布变化
目水平上,如图4 所示,从入房到大火阶段,以芽孢杆菌纲中的乳杆菌目为主,此外还有少量的肠杆菌目、芽孢杆菌目、假诺卡氏菌目,其他目水平上的微生物占比都小于1%;乳杆菌目占比在64%~94%范围之间先增长后下降,芽孢杆菌目则从入房时的不足1%缓慢增长至大火时的10%;肠杆菌目在入房时占比35%,而后快速下降,大火时回升至6%;放线菌纲中的假诺卡氏菌目仅在大火阶段出现,占比5 %左右。下架至出房时,芽孢杆菌纲中的芽孢杆菌目与乳杆菌目变化剧烈,芽孢杆菌目下架时占比增长至74%,出房时又回落至33%;乳杆菌目下架时下降至16%,出房时回升至52%;假诺卡氏菌目先下降至2.8%后回升至3.2%;肠杆菌目保持缓慢下降趋势,由5.7 %缓慢下降至4.5 %;出房时还有占比5.3%的放线菌纲未知目。
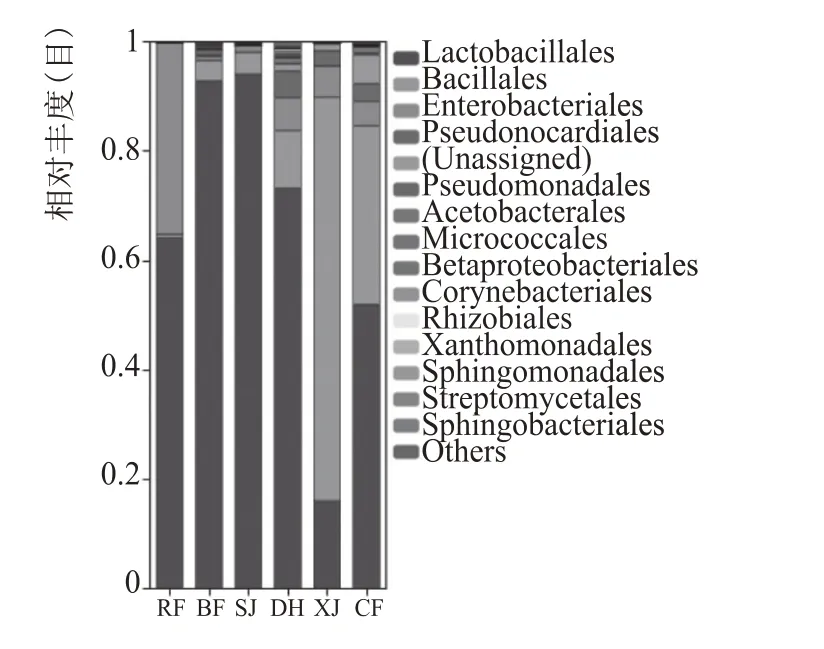
图4 大曲培养各阶段细菌在目水平上的分布变化
从科水平看,如图5 所示,中高温大曲以乳杆菌科、明串珠菌科、芽孢杆菌科、肠杆菌科、葡萄球菌科为主。入房时以乳杆菌科、明串珠菌科、肠杆菌科为主,占比分别为46%、18%、35%;并房和上架时则以明串珠菌科与乳杆菌科为主,其中明串珠菌科先增长至58 %后缓落至28 %,乳杆菌科则先缓落至34 %后迅速增长至65 %,此外还出现葡萄球菌科,占比分别为3.4%、2.5%;大火期则以明串珠菌科为主,占比高达65 %,此外还有乳杆菌科、芽孢杆菌科、肠杆菌科、伪诺卡氏菌科、葡萄球菌科,占比分别为7.5 %、6.1 %、6.0 %、4.8 %、2.4 %;下架时则以芽孢杆菌科为主,占比高达72%,此外还有少量的明串珠菌科、肠杆菌科、伪诺卡氏菌科、乳杆菌科,占比分别为13.9%、5.7%、2.8%、2.0%;出房时微生物趋于均衡,主要以明串珠菌科、乳杆菌科、葡萄球菌科、芽孢杆菌科、肠杆菌科、伪诺卡氏菌科为主,占比分别为29.7 %、21.2 %、12.2 %、7.5%、4.5%、3.2%。
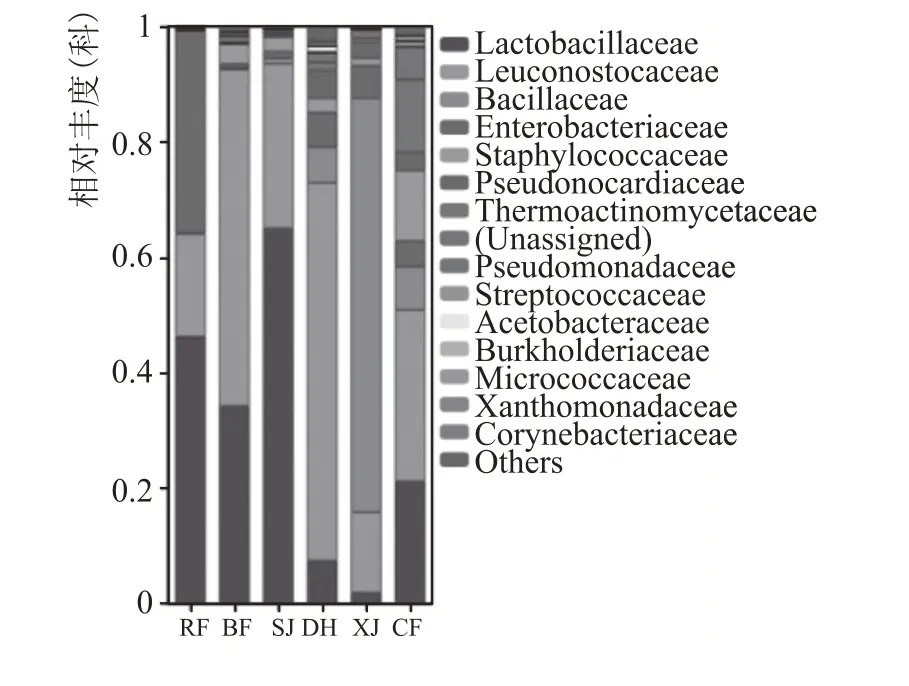
图5 大曲培养各阶段细菌在科水平上的分布变化
在属分类水平上,结果如图6。入房时以乳杆菌属、肠杆菌科未知属、魏斯氏菌属为主,占比分别为46.11%、35.30%、16.59%;并房和上架时都以乳杆菌属、魏斯氏菌属、明串珠菌属、片球菌属、葡萄球菌属为主,并房时占比分别为27.95%、43.95%、14.33 %、6.35 %、3.42 %,上架时分别为56.52 %、21.68%、6.78%、8.63%、2.53%;大火期,乳杆菌属大幅降低至6.84 %,魏斯氏菌属则大幅增加至62.81 %,此外还有8.68 %的肠杆菌科、5.28 %的芽孢杆菌属、2.65 %的明串珠菌属、2.40 %的葡萄球菌属、4.13%的糖多孢菌属;下架时,芽孢杆菌属占比大幅增长至71.16 %,魏斯氏菌属大幅降低至11.46 %,此外还有3.75 %的肠杆菌科、2.46 %的明串珠菌属、4.06 %的科萨克氏菌属、2.44 %的糖多孢菌属;出房时,各类微生物占比趋于均衡,以乳杆菌属、魏斯氏菌属、芽孢杆菌属、明串珠菌属、片球菌属、葡萄球菌属、克罗彭斯特菌属、高温放线菌属为主,占比分别为14.33 %、24.02 %、6.05 %、5.64%、6.92%、12.15%、5.46%、7.10%,此外还有12.44%的肠杆菌科未知属。

图6 大曲培养各阶段细菌在属水平上的分布变化
2.5 OTU系统进化关系
在各分类水平(门、纲、目、科、属及OTU)下,选取总体相对丰度排在前20 的序列,构建系统发育树,结合样本于各分类水平下相对丰度及物种注释的可信度信息进行可视化展示,结果如图7 和表3。可以看出,中高温大曲中排名前10 的物种大多为厚壁菌门芽孢杆菌纲水平下的乳杆菌目与芽孢杆菌目;就科水平而言,大多为乳杆菌目水平下的乳杆菌科与明串珠菌科,芽孢杆菌目水平下的芽孢杆菌科与葡萄球菌科;就属水平而言,则是乳杆菌科水平下的乳杆菌属与片球菌属、明串珠菌科水平下的魏斯氏菌属与明串珠菌属、芽孢杆菌科水平下的芽孢杆菌属、葡萄球菌科水平下的葡萄球菌属。排名前10 的物种还有一个是变形菌门γ-变形菌纲肠杆菌目肠杆菌科。此外,由图7 可以看出,中高温大曲的细菌物种在培养各阶段明显不同,受生物与非生物因素的驱动,最终趋向于物种更加丰富、占比更加均衡。

表3 大曲培养各阶段丰度排名前10的物种
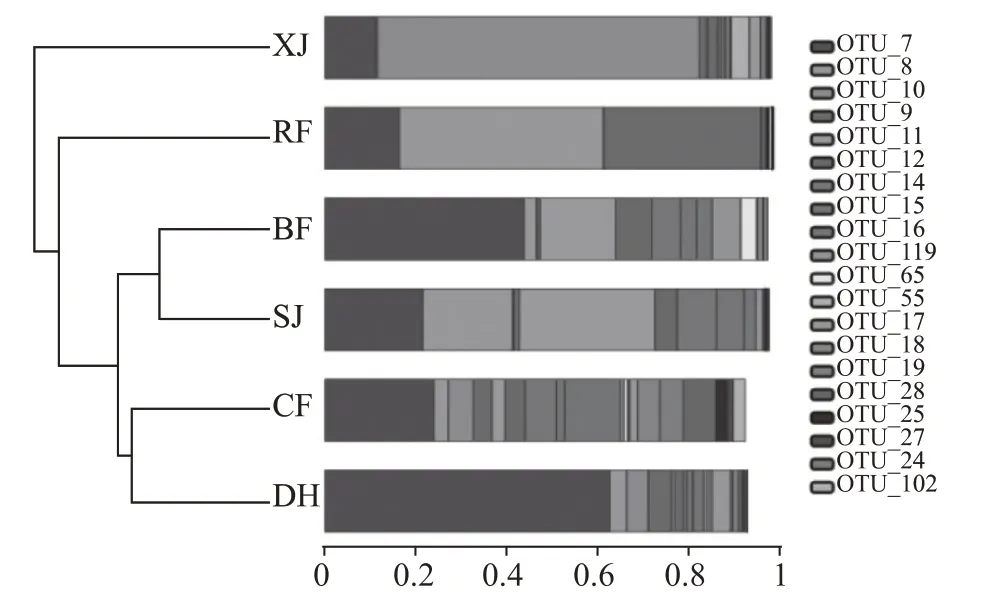
图7 大曲培养各阶段细菌OTU进化关系
2.6 群落分布特征
通过PCoA 主坐标分析与丰度聚类热图研究中高温制曲各阶段细菌群落分布特征,结果如图8和图9所示。
结合图8 和图9 可知,大曲发酵各个阶段细菌的菌群结构均存在一定差异,PCoA 分析显示分布于四个象限,通过丰度聚类热图可将物种变化趋势的类型分为五类。入房阶段位于第一象限,上架阶段位于第二象限,以乳杆菌属、肠杆菌科、片球菌属、链球菌属构成的菌群(Ⅰ)主要在入房和上架阶段;并房阶段位于第三象限,以明串珠菌属、假单胞菌属为代表的菌群(Ⅱ)主要在并房阶段;大火阶段与出房阶段在第三象限,二者距离较近,其中以魏斯氏菌属、醋酸杆菌属、糖多孢菌属、链霉菌属为代表的菌群(Ⅲ)主要在大火阶段,以海洋芽孢杆菌属、葡萄球菌属、乳球菌属、高温放线菌属为代表的菌群(Ⅴ)主要在出房阶段;下架阶段位于第四象限,以芽孢杆菌属和科萨克氏菌属构成的菌群(Ⅳ)主要在下架阶段。从图9 也可以看出,变化趋势相似的菌群在进化关系上遗传距离也较为接近。
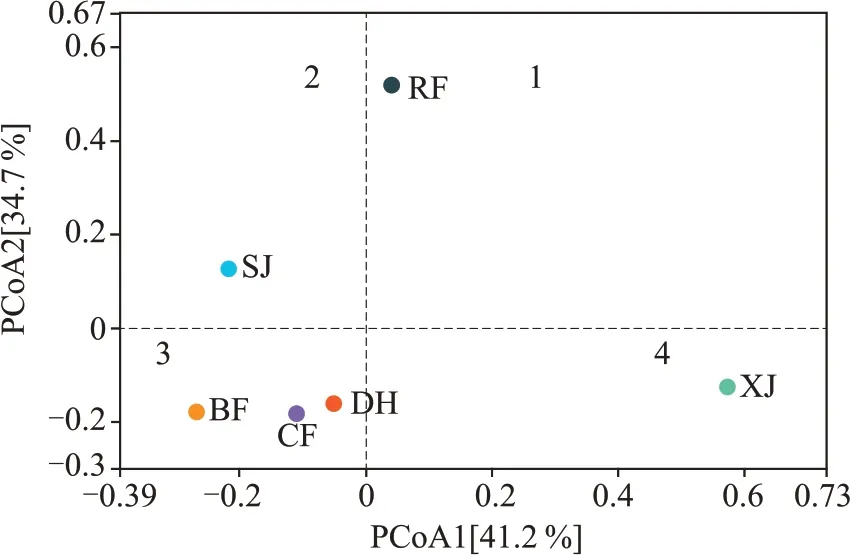
图8 大曲培养各阶段细菌主坐标分析图
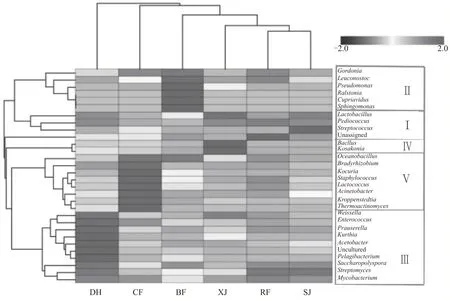
图9 大曲培养各阶段细菌群落丰度聚类热图
由图8 可知,不同发酵阶段样品分布较为分散,其中入房、下架与其他阶段距离较远,表明这两个阶段的细菌菌群结构差异较大。因此,可将中高温大曲的细菌群落结构演替分为四个阶段:(1)大曲刚入房时,细菌群落主要来自于原辅料及环境中网罗的微生物;(2)并房至大火阶段,伴随温湿度等环境因子的变化,大曲中水分营养充足,微生物结构不断进行适应性调整;(3)下架后,经过高温的长期驯化,大量不耐热的微生物被淘汰,细菌群落结构变化巨大;(4)随着品温等环境渐趋温和,微生物利用曲心残留的水分和营养进行生长繁殖,细菌多样性增加。
2.7 细菌群落与理化因子关联分析
理化因子关联分析后发现:二维排序轴RDA1和RDA2 解释种群与理化的累计变化率分别为58.3 %和21.52 %,两轴和为79.82 %(图10),说明RDA1 和RDA2 能较好地反映大曲细菌群落与理化因子之间的内在关联。各理化因子与群落结构的相关性大小依次为酸度、水分、酯化力、糖化力、发酵力,其中酸度和水分与细菌群落结构的关联性较大,发酵力与细菌群落结构的关联性较小,说明细菌群落主要受大曲酸度与水分的影响,发酵力则与细菌基本无关联性。就主要优势属看,水分和糖化力与乳杆菌属、肠杆菌正相关,说明这两个菌属对大曲水分和糖化力有较大影响;酸度则与魏斯氏菌属、明串珠菌属、片球菌属和葡萄球菌属正相关,以葡萄球菌属表现尤为显著;酯化力与芽孢杆菌属、科萨克氏菌属、糖多孢菌属、放线菌纲正相关,尤以放线菌纲表现尤为显著。
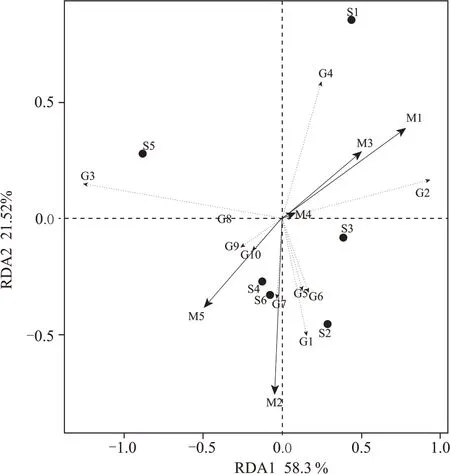
图10 理化因子与细菌优势属的RDA分析
3 总结与展望
3.1 总结
本研究首次采用高通量基因测序技术对大曲培养各阶段细菌不同分类水平的组成与丰度进行了系统的研究,结果表明,中高温大曲的优势细菌为乳杆菌属、魏斯氏菌属、芽孢杆菌属、明串珠菌属、片球菌属、葡萄球菌属,都属于厚壁菌门芽孢杆菌纲水平下乳杆菌目与芽孢杆菌目的细菌种属,此外还有变形菌门γ-变形菌纲肠杆菌目肠杆菌科。这些优势细菌群落在张会敏、张倩、谭崇尧、王涛等的研究结果中也有所报道,种类和丰度有明显差异,这是由于大曲是开放式生产、自然接种,原料、环境、工艺对大曲微生物区系均有直接影响。
各类优势细菌的分布和丰度在发酵各阶段具有明显区别。大曲刚入房时,细菌丰度最低,菌群多样性居中,种类以乳杆菌属、肠杆菌科、魏斯氏菌属为主;并房后,菌群多样性提高,丰度升至最高,种类以魏斯氏菌属、乳杆菌属、明串珠菌属为主;上架后,丰度开始降低但菌群多样性继续升高,种类以乳杆菌属、魏斯氏菌属为主;大火中期,丰度开始升高但菌群多样性降低,种类以魏斯氏菌属为主;下架后,菌群多样性降至最低,丰度也降低,芽孢杆菌属占据绝对优势,兼有一定占比的魏斯氏菌属;出房后,丰度进一步降低但菌群多样性升至最高,以魏斯氏菌属、乳杆菌属、葡萄球菌属、肠杆菌科为主,还有占比5%以上的高温放线菌属、片球菌属、芽孢杆菌属、明串珠菌属、克罗彭斯特菌属,物种最趋丰富,占比更趋均衡。
此外,本研究还首次采用Venn 图分析比较不同发酵阶段OTU 数目组成相似性及重叠情况,从物种和样本两个层面对不同发酵阶段OTU 进行聚类并绘制热图,选取总体相对丰度排在前20 的序列构建了OTU 进化图,并通过PCoA 对不同发酵阶段微生物结构的相似性与差异性进行了分析。结合大曲理化因子的关联性分析,结果表明酸度和水分与细菌群落结构的关联性较大,细菌种属对大曲酶活也有一定的影响。
3.2 展望
高通量测序技术可以全面反映样本中微生物的物种组成及丰度,为充分认识不可培养微生物并从完整的群落水平上研究微生物活动提供了可能,已成为微生物宏基因组学研究中的重要手段。高通量测序技术是以微生物DNA 作为检测基础,无法区分死菌与活菌,需要结合传统纯培养鉴定方法进行补充。
本试验仅对中高温大曲中的细菌群落演替进行了分析,需要结合真菌群落来分析中高温大曲中微生物的演替规律,并结合众多生物与非生物因素进行关联性分析,如温度、湿度、氧气、门窗管控等,以全面准确地研究中高温大曲微生态演变的内在驱动力。
