大肠杆菌表达类黄酮O-甲基转移酶合成槲皮素甲基化衍生物
2022-08-17田苗苗郭佳婧
田苗苗, 郭佳婧*, 刘 娟, 单 杨*
(1. 湖南省农业科学院 农产品加工研究所/果蔬贮藏加工与质量安全湖南省重点实验室/湖南省果蔬加工与质量安全国际科技创新合作基地,湖南 长沙 410125;2. 湖南大学 隆平分院,长沙 410082)
柑橘是世界上产量最大的水果之一,我国柑橘种植面积位居世界前列,柑橘因具有丰富的营养价值和独特口感而广受欢迎[1]。 类黄酮是柑橘中一种重要的次生代谢产物,其中槲皮素(3′,4′,3,5,7-五羟基黄酮,又名栎精、槲黄素)是柑橘类黄酮中重要的一种组分,具有抗菌[2]、抗炎[3]和抗氧化[4]等生物学活性,并且在预防和治疗各种慢性疾病方面具有广泛的应用前景[5]。 但是,由于槲皮素水溶性和脂溶性较差,导致其在人体小肠表面不易被吸收、生物利用度较低,从而限制了其广泛应用[6]。
研究表明,甲基化修饰可以提高槲皮素分子的代谢稳定性和脂溶性,进而提高其生物利用度[7];4′-O-甲基槲皮素(柽柳黄素)的抗氧化活性是槲皮素糖苷的3 倍, 且与槲皮素相比其抗炎活性提高了80%[8];3′-O-甲基槲皮素(异鼠李素)可以通过抑制脂多糖诱导的活性氧蛋白的产生而防止细胞死亡和炎症反应[9],Ader 等通过在猪体内进行实验,证明异鼠李素比槲皮素更有利于肠道吸收,生物利用度由原来的0.54%提高到17.00%[10]。 但是槲皮素甲基化衍生物在植物中含量极少,目前主要通过化学合成和微生物合成两种方式获取,其中化学合成需要高温高压等反应条件并伴有有毒副产物的产生[11],微生物合成由于生产周期较短、生产过程绿色安全且有利于大规模生产等多种优势而备受关注[12]。
在植物体内, 类黄酮的O-甲基化主要通过类黄酮O-甲基转移酶(FOMT) 催化甲基从S-腺苷-L-甲硫氨酸(SAM)向类黄酮羟基的转移[13]。 不同来源的FOMT 可以催化合成不同的甲基化类黄酮,如杨树来源的POMT7 可以催化芹菜素合成7-O-甲基芹菜素[14],大豆来源的SOMT2 可以催化柚皮素合成异樱花素等[15]。 同时不同来源的FOMT 可甲基化不同位点合成不同的甲基化类黄酮,如槲皮素可在F4′-OMT、F7-OMT、F3′-OMT 和F3-OMT 的催化下分别合成柽柳黄素、鼠李素、异鼠李素和3-O-甲基槲皮素 (见图1)。 作者筛选出11种不同来源的FOMT,并根据催化位点对其进行分类,将其分别导入大肠杆菌中构建相应的工程菌,以槲皮素为底物进行发酵,合成槲皮素甲基化衍生物。
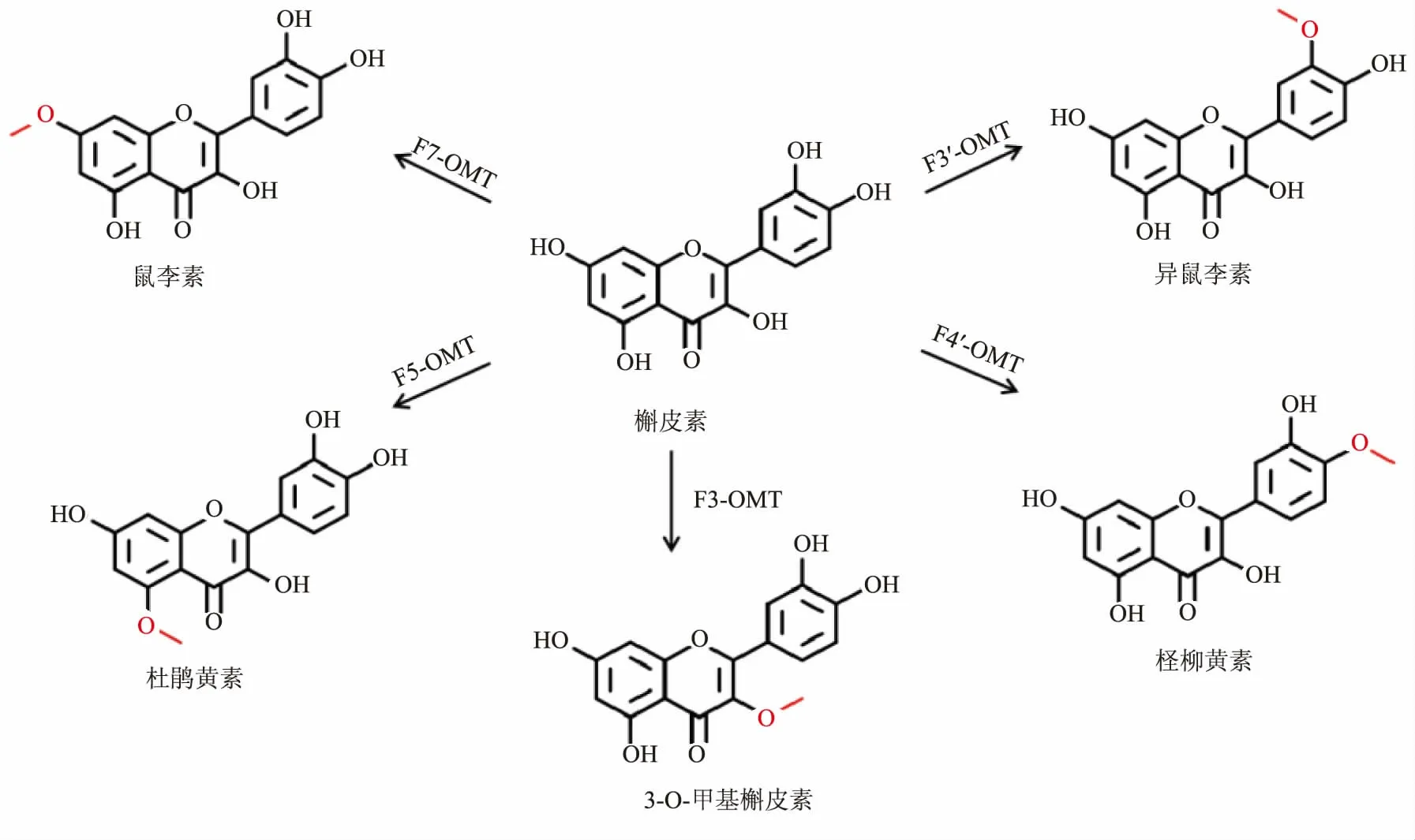
图1 单O-甲基槲皮素Fig. 1 Mono O-methylquercetin
1 材料与方法
1.1 材料与试剂
1.1.1菌株与质粒E.coliDH5α、E.coliBL21(DE3):作者所在实验室保存。 pETDuet-1、pGEX-4T-1:上海生工生物工程股份有限公司产品。 PCR 引物以及优化后的基因序列:上海生工生物工程股份有限公司合成。 基因来源及登录号见表1。
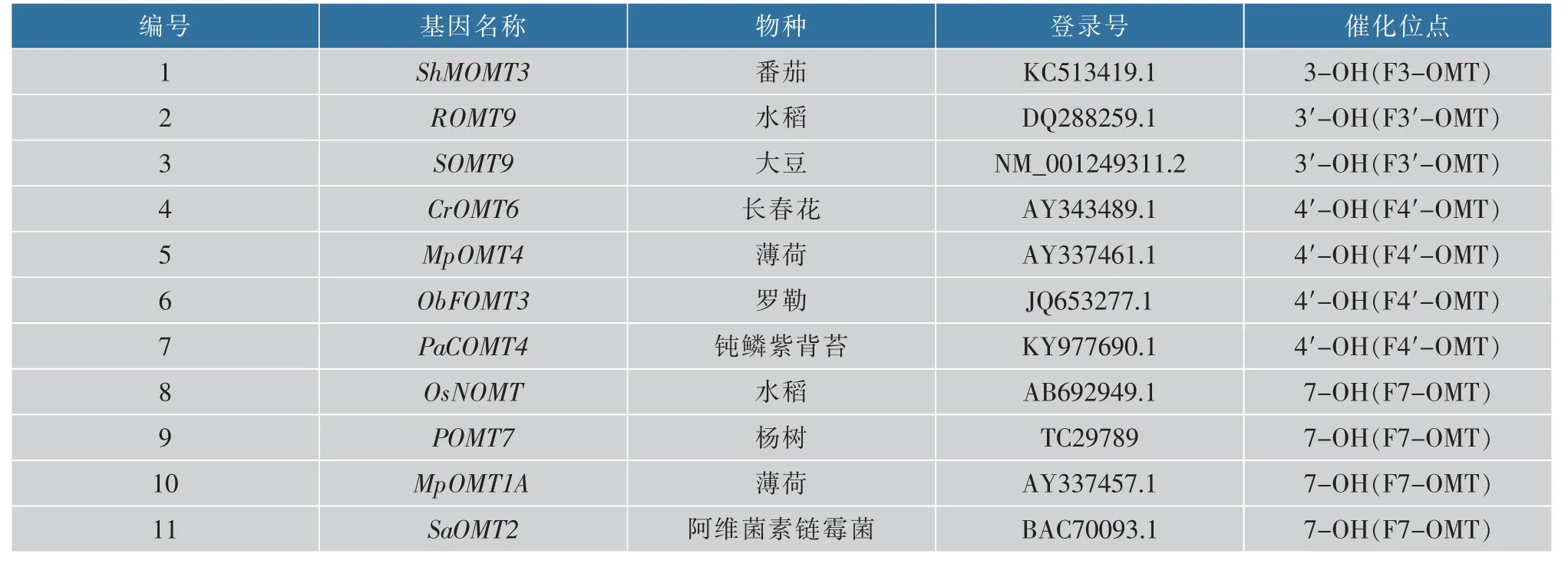
表1 FOMT 基因来源Table 1 Source of FOMT gene
1.1.2试剂 蛋白胨、酵母粉:英国OXOID 公司产品;乙酸乙酯、甘油、氨苄青霉素钠、磷酸氢二钾、磷酸二氢钾、甲醇、二甲基亚砜(DMSO)、Tris-HCl 缓冲液:国药集团化学试剂有限公司产品;异丙基-β-D-硫代半乳糖苷(IPTG):上海瑞永生物科技公司产品;槲皮素、异鼠李素、4′,7-二甲氧基槲皮素标准品:成都德斯特生物技术有限公司产品;柽柳黄素、鼠李素、3-O-甲基槲皮素液相标准品: 上海源叶生物科技有限公司产品;限制性核酸内切酶、一步克隆试剂盒、胶回收试剂盒、2×Phanta Max Master Mix高保真DNA 聚合酶以及质粒提取试剂盒: 南京诺唯赞生物科技股份有限公司产品;5×蛋白质上样缓冲液、5×Tris-甘氨酸电泳缓冲液、彩虹130 广谱蛋白质maker、考马斯亮蓝快速染色液:索莱宝生物科技有限公司产品。
TB 液体培养基:1.2 g/dL 的胰蛋白胨,2.4g/dL的酵母提取物,0.4 mL/dL 的甘油,17 mmol/L KH2PO4,72 mmol/L K2HPO4。并按要求添加氨苄青霉素(Amp)至终质量浓度为100 mg/L。
1.2 仪器与设备
TOne 96 PCR 仪: 德国Biometra 公司产品;核酸电泳仪: 北京君意东方电泳设备有限公司产品;凝胶成像仪: 英国UVItec 公司产品;5424R 小型台式高速离心机: 德国Eppendorf 公司产品;AcpitiJ-26XP 离心机: 美国Beckman 公司产品;SYNERGY H1 酶标仪: 美国Bio Tek 公司产品;LDZM-80L-III高压灭菌锅: 上海申安医疗器械厂产品;DZKW-4电热恒温水浴锅:北京市永光明医疗仪器有限公司产品;ZQPZ-115 振荡培养箱:天津市莱玻特瑞仪器设备有限公司产品;H-class 超高效液相色谱仪:美国Waters 公 司 产 品;qtof6550 型 质 谱 仪: 美 国Agilent Technologies 公司产品;蛋白质电泳仪:美国BIO-RAD 公司产品。
1.3 研究方法
1.3.1重组表达载体的构建 DNA 片段按照2×Phanta Max Master Mix 试剂盒方法进行PCR 扩增,PCR 产物经琼脂糖凝胶电泳后按照DNA 胶回收试剂盒方法进行基因的回收,使用一步克隆试剂盒进行质粒构建, 得到重组质粒pETDuet-CrOMT6、pETDuet-MpOMT4、pETDuet-ObFOMT3、pETDuet-PaCOMT4、pETDuet-OsNOMT、pETDuet-POMT7、pETDuet-MpOMT1A、pETDuet-SaOMT2、pGEX-4TShMOMT3、pGEX-4T-ROMT9、pGEX-4T-SOMT9,使用E.coliDH5α 进行质粒扩增,使用CaCl2法制备感受态细胞并进行转化,质粒提取后由上海生工生物工程股份有限公司测序验证。
1.3.2SDS-PAGE 分析FOMT 蛋白的异源表达测序后序列比对成功的质粒再次转入E.coliBL21(DE3)感受态细胞中进行表达,从过夜活化的平板上挑取单菌落于含Amp (质量浓度为100 mg/L)的TB 液体培养基中于37 ℃、220 r/min 培养至OD600为0.6~0.8, 添加IPTG 至终物质的量浓度为0.2 mmol/L 诱导蛋白质表达, 取诱导8 h 发酵液于4℃、5 000 r/min 离心5 min 收集细胞,随后加入等比例PBS 缓冲液重悬, 用超声细胞破碎仪破碎细胞,超声功率为300 W, 超声2 s 后停8 s 继续超声7 min,整个过程在冰上进行。 超声完毕后,将细胞破碎液于4 ℃、5 000 r/min 离心5 min,取离心后的上清液按照体积比4∶1 比例加入5×蛋白质上样缓冲液,混匀后于沸水中水浴加热5 min 后于冰上冷却,离心后取上清液进行SDS-PAGE 电泳分析。
1.3.3单O-甲基槲皮素的合成 上述构建得到4株含F4′-OMT、4 株含F7-OMT、2 株含F3′-OMT 和1 株含F3-OMT 的大肠杆菌工程菌, 并分别以槲皮素为底物进行发酵培养分别合成4种单O-甲基槲皮素(柽柳黄素、鼠李素、异鼠李素和3-O-甲基槲皮素)。 工程菌的培养方法如下:从过夜培养的平板上挑取单菌落至5 mL 含Amp(质量浓度为100 mg/L)的TB 液体培养基中, 然后置于37 ℃、220 r/min 条件下过夜培养得到种子液, 按照体积分数为1%接种量转接至20 mL 含有Amp(质量浓度为100 mg/L)的TB 液体培养基中于37 ℃、220 r/min 培养至OD600为0.6~0.8,之后添加IPTG 至终物质的量浓度为0.2 mmol/L,槲皮素底物(溶于DMSO 中)至终质量浓度为100 mg/L, 于23 ℃、220 r/min 培养10 h,然后使用UPLC 进行分析。
1.3.4二O-甲基槲皮素的合成 4′,7-二甲氧基槲皮素是槲皮素分子经4′-OH 和7-OH 甲基化后的产物,属于二O-甲基槲皮素中的一种。 由于其分子结构中含有两个甲氧基,因此其甲基化过程需要两步反应(见图2)。 在本研究中,4′,7-二甲氧基槲皮素的合成途径被分为两个基本的大肠杆菌细胞模块, 模块1 为OsNOMT 催化的7-OH 的甲基化,模块2 为MpOMT4 催化的4′-OH 的甲基化; 先将模块1 的细胞用50 mmol/L Tris-HCl(pH 7.4)缓冲液稀释至相应细胞质量浓度分别为8、16、24、32 g/L(以细胞干质量计), 随后添加槲皮素底物, 于23 ℃、220 r/min 下反应10 h,当体系中积累到一定量的鼠李素后, 再按模块1 与模块2 质量比分别为3∶1、2∶1、1∶1、1∶2、1∶3 的比例添加模块2 的细胞进行转化(槲皮素底物终质量浓度为100 mg/L), 反应10 h 后取发酵液使用UPLC 进行分析。
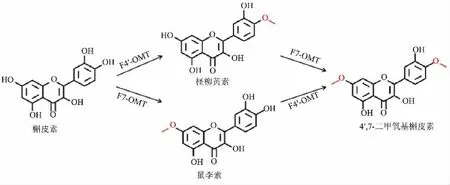
图2 槲皮素到4′,7-二甲氧基槲皮素的转化Fig. 2 Transformation of quercetin into 4′,7-dimethoxyquercetin
全细胞催化剂的制备参考Wang 等[16]方法,并稍有修改,具体方法如下:大肠杆菌工程菌的活化方法参考1.3.2,将活化后的种子液按照体积分数为1%接种量转接至含有Amp(质量浓度为100 mg/L)的TB 液体培养基中37 ℃、220 r/min 培养至OD600为0.6~0.8, 添加终物质的量浓度0.2 mmol/L 的IPTG, 于23 ℃、220 r/min 诱导蛋白质表达12 h;然后于5 000g、15 ℃离心10 min, 收集菌体细胞,用50 mmol/L Tris-HCl(pH 7.4)缓冲液冲洗后重悬至细胞质量浓度为8、16、24、32 g/L(以细胞干质量计,细胞干质量与OD600之间的转换关系为OD600为1时代表细胞质量浓度为0.35 g/L)[17]。
1.3.5产物的分析与鉴定 取发酵液等比例加入乙酸乙酯进行萃取,静置后取上清液经氮吹浓缩后加甲醇重溶, 经0.22 μm 尼龙滤膜过滤后进行分析。 UPLC 检测条件: 使用安捷伦C18柱(4.6 mm×150 mm)、PDA 检测器进行检测。 检测条件:梯度洗脱;A 相为乙腈,B 相为体积分数0.4%醋酸水溶液,0~20 min,B 相由20%升至85%(体积分数);流量为0.2 mL/min;检测波长为254 nm。LC-MS 检测条件:液相色谱按照上述进行, 质谱分析采用安捷伦qtof6550 系统,在100~1 200m/z、电喷雾离子源负离子模式、电压3 200 V 下进行质谱扫描分析。
2 结果与分析
2.1 FOMT 基因的优化及重组表达载体的构建
在大肠杆菌体内表达异源蛋白时存在密码子偏好性问题, 若存在稀有碱基或AT 含量过高均会导致蛋白质合成受阻,密码子可能发生错配,使得外源蛋白难以在大肠杆菌体内高效表达[18]。 因此对不同来源的FOMT 基因进行密码子优化,可有效提高其表达水平。 表2 为基因优化后的各项指数,其中密码子适应指数(CAI)是用来反应编码区的同义密码子和最佳密码子使用频率的相符合程度,一般可用CAI 来评估外源基因在宿主内的表达水平,其取值在0~1.00; 当CAI 为0.80~1.00 时认为基因与宿主的偏好性较高。 GC 含量的最佳百分比为40.00%~60.00%。
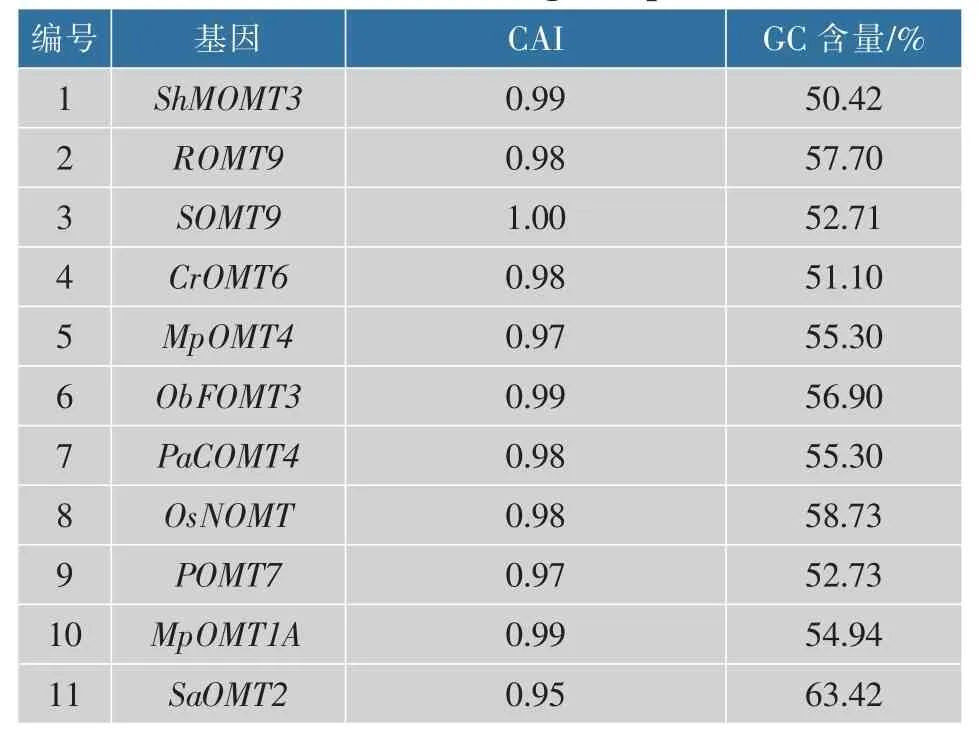
表2 基因优化后各项指标Table 2 Indexes after gene optimization
2.2 FOMT 蛋白的异源表达鉴定
使用SDS-PAGE 对大肠杆菌工程菌诱导8 h后细胞内可溶性蛋白质进行检测,SDS-PAGE 结果如图3 所示。 结果表明,表达CrOMT6(4.07×104)、MpOMT4 (3.78×104)、ObFOMT3 (3.68×104)、PaCOMT4(4.15×104)、OsNOMT(4.00×104)以及带有GST 标 签 的ROMT9(6.57×104)、SOMT9(5.36×104)和ShMOMT3(6.66×104)蛋白的重组大肠杆菌中检测到了符合目的蛋白相对分子质量的蛋白质条带且条带较亮,说明其在大肠杆菌中能够可溶表达且蛋白质表达量高。 对含有POMT7 (3.96×104)和MpOMT1A(3.80×104)的菌株中的可溶性蛋白进行检测,发现其表达量极少;而含有SaOMT2(3.75×104)的重组菌株中的蛋白质几乎不能可溶性表达,在后期的发酵中也无法发挥催化活性。
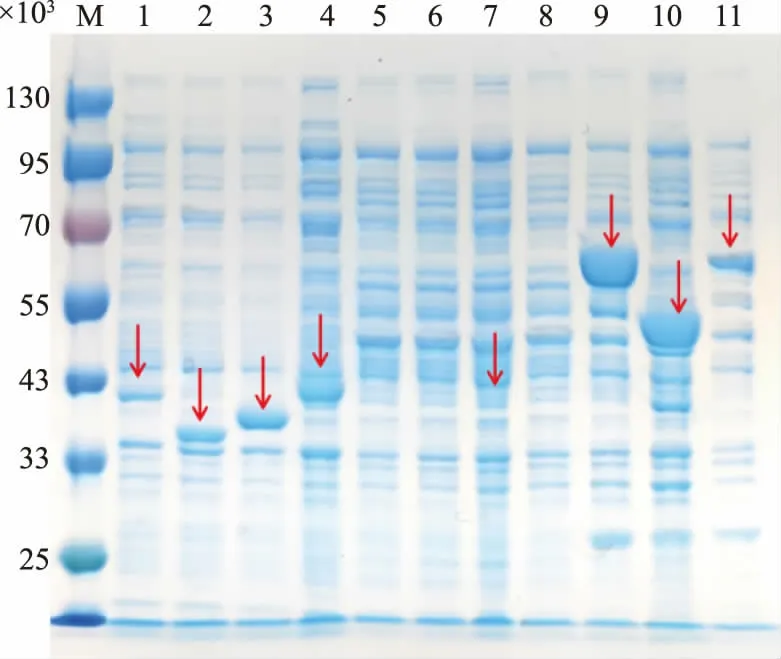
图3 SDS-PAGE 分析FOMT 蛋白表达Fig. 3 Analysis of FOMT protein expression by SDSPAGE
2.3 单O-甲基槲皮素的合成
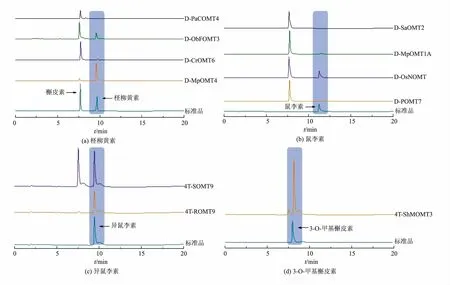
构建了含有11种不同来源FOMT 的大肠杆菌工程菌, 并根据FOMT 催化位点对其进行分类,其中包括4种F4′-OMT、4种F7-OMT、2种F3′-OMT和1种F3-OMT, 重组菌株按上述方法加入槲皮素底物至终质量浓度为100 mg/L 进行发酵培养,随后使用UPLC 对发酵液进行分析(见图4),并分别与柽柳黄素、鼠李素、异鼠李素以及3-O-甲基槲皮素标准品检测结果进行对比。 样品检测结果发现,含不同催化位点FOMT 的重组菌中均检测到与相应标准品出峰时间相同的产物峰。 其中4种含F4′-OMT 的重组菌中, 仅有PaCOMT4 没有检测到柽柳黄素;4种含F7-OMT 的重组菌中, 除SaOMT2 外,在11.2 min 处均检测到鼠李素;其余3 株工程菌分别检测到异鼠李素、3-O-甲基槲皮素相应峰。 质谱分析显示4种产物与相应标准品离子峰位置一致,进一步验证了实验结果。
重组菌株经发酵培养后通过UPLC 检测并计算产 量 (见 图5)。 结 果 表 明,4种F4′-OMT 中,MpOMT4 活性最高, 合成了31.17 mg/L 柽柳黄素,CrOMT6 和ObFOMT3 催化合成柽柳黄素产量分别为4.12 mg/L 和12.18 mg/L;4种F7-OMT 中,OsNOMT 最高催化合成了11.17 mg/L 鼠李素;两种F3′-OMT(ROMT9 和SOMT9)催化合成的异鼠李素的产量分别为8.72 mg/L 和8.90 mg/L;ShMOMT3 催化合成3-O-甲基槲皮素的产量为52.95 mg/L。在表达钝磷紫背苔来源的PaCOMT4 和阿维菌素链霉菌来源的SaOMT2 的大肠杆菌工程菌发酵液中未检测到相应目标产物,这可能是因为其在大肠杆菌中不能有效可溶性表达,产生蛋白质包涵体而无法发挥催化活性[19]。而且,研究表明FOMT 存在底物偏好性差异,不同来源的FOMT 对槲皮素底物的亲和性可能会影响其催化效率,从而导致目标产物产量之间的差异[20]。
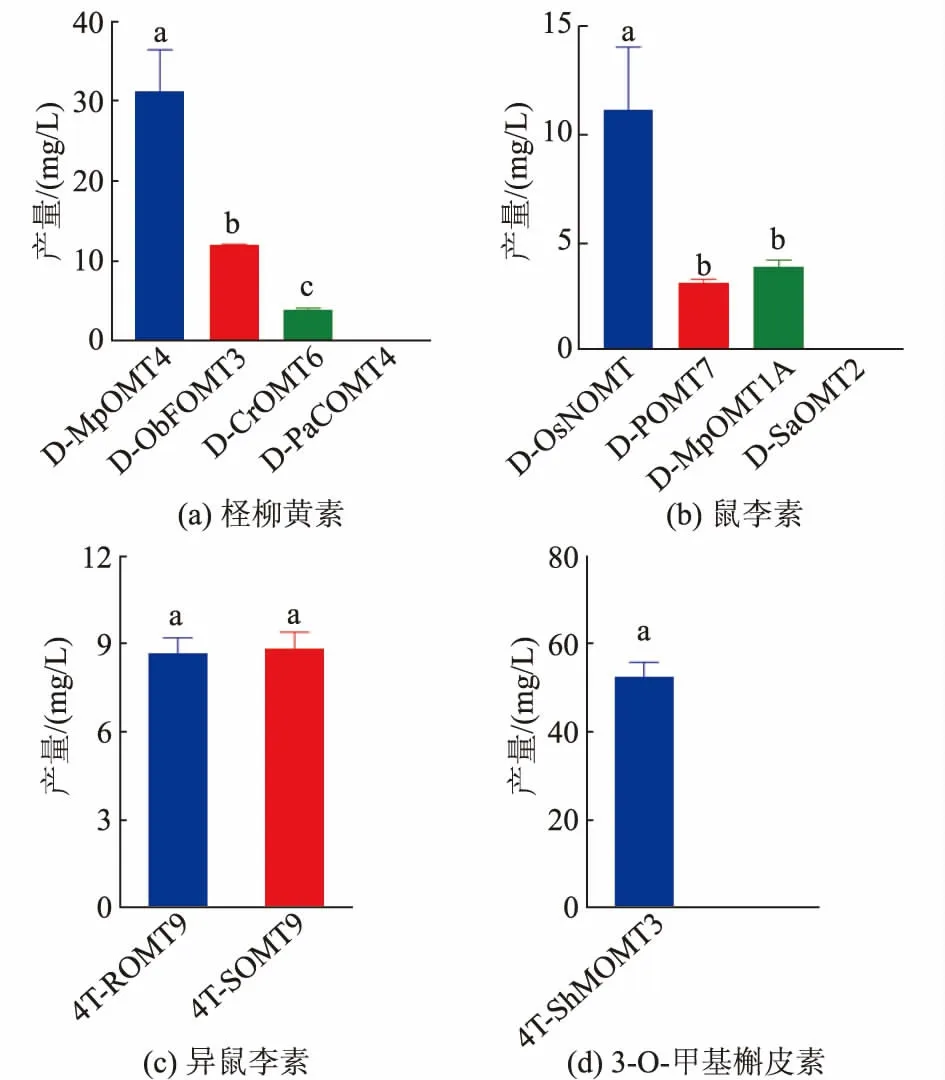
图5 不同来源FOMT 发酵结果Fig. 5 Fermentation results of FOMT from different sources
2.4 4′,7-二甲氧基槲皮素的合成
2.4.1不同添加顺序对4′,7-二甲氧基槲皮素产量的影响 按照大肠杆菌共培养方法进行发酵实验,通过改变模块1(OsNOMT)与模块2(MpOMT4)细胞前后添加顺序, 探究4′,7-二甲氧基槲皮素合成产量的变化。在细胞质量浓度为16 g/L(以细胞干质量计), 菌体质量比为1∶1 条件下进行发酵 (见图6)。 结果表明,MpOMT4 可利用鼠李素作为底物,而OsNOMT 不可利用柽柳黄素作为底物。 当细胞质量浓度为16 g/L(以细胞干质量计),模块1 与模块2质量比为1∶1 时, 先将模块1 细胞添加底物, 反应10 h 后再添加模块2 细胞进行催化, 可以得到15.75 mg/L 4′,7-二甲氧基槲皮素;若先添加模块2细胞,催化4′-OH 甲基化,再添加模块1 细胞进行催化, 发酵液中未检测到4′,7-二甲氧基槲皮素的合成。这可能是由于槲皮素4′-OH 的甲基化导致其分子构象发生变化,导致OsNOMT 无法与其结合发生催化活性。 研究发现FOMT 具有严格的催化位点特异性和底物特异性,一种FOMT 只能特异性地结合某一类类黄酮底物。 Kim 等通过在大肠杆菌中构建RSOMT 共表达载体发现,ROMT9 不能以4′-甲氧基槲皮素为底物,而SOMT2 能够以3′-甲氧基槲皮素为底物[21]。 根据国内外已经报道的关于多种植物FOMT 晶体结构分析表明, 不同植物来源的FOMT 底物特异性主要是与其结合的类黄酮底物结合域之间的差异而引起的[22]。
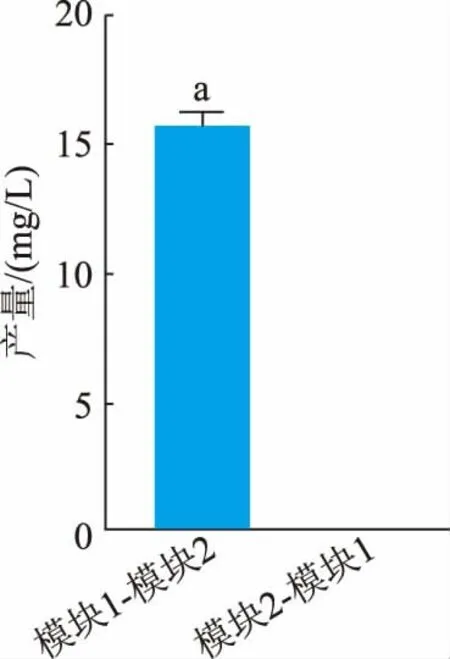
图6 不同添加顺序对4′,7-二甲氧基槲皮素产量的影响Fig. 6 Effects of different addition sequences on 4′,7-dimethoxyquercetin yield
D 和4T 为质粒载体名称缩写。
随后通过UPLC 对发酵液进行分析 (见图7)。结果表明样品中出现与4′,7-二甲氧基槲皮素标准品保留时间相同的峰, 随后按照本文1.3.5 中的方法对产物进行质谱扫描, 发现样品中存在与4′,7-二甲氧基槲皮素标准品一致的离子峰,相对分子质量检测结果一致(见图8)。
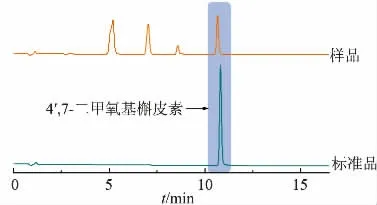
图7 4′,7-二甲氧基槲皮素UPLC 检测结果Fig. 7 Determination results of 4′,7-dimethoxyquercetin by UPLC
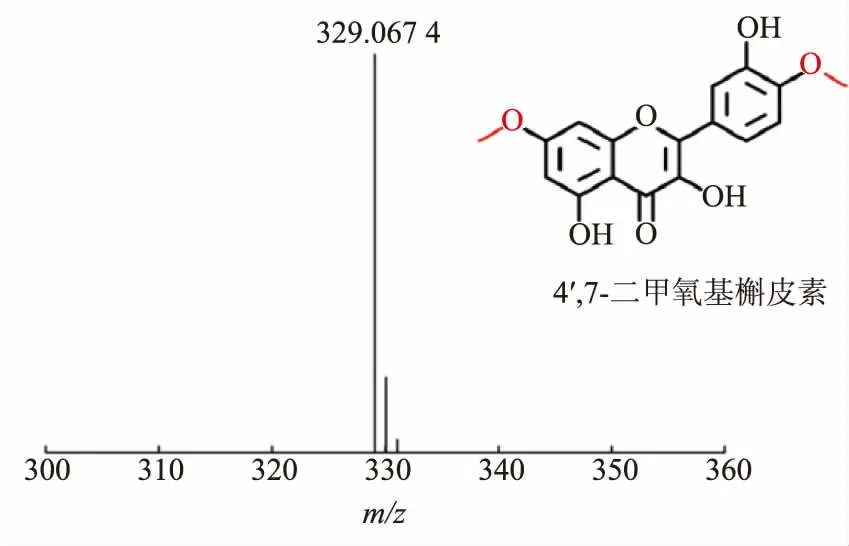
图8 4′,7-二甲氧基槲皮素LC-MS 检测结果Fig. 8 Determination results of 4′,7-dimethoxyquercetin by LC-MS
2.4.2不同缓冲液对4′,7-二甲氧基槲皮素产量的影响 为了探究不同缓冲液和pH 对发酵产量的影响,选取PBS 6.0(pH 6.0)、PBS 7.0(pH 7.0)、PBS 8.0(pH 8.0)、50 mmol/L Tris-HCl(pH 7.4)缓冲液进行对比;在细胞质量浓度为16 g/L(以细胞干质量计),模块1 与模块2 质量比为1∶1 条件下进行发酵(见图9)。 结果表明,在50 mmol/L Tris-HCl(pH 7.4)缓冲液中4′,7-二甲氧基槲皮素产量最高, 为15.75 mg/L; 在3种不同pH 的PBS 缓冲液中发酵结果显示, 在PBS 6.0、PBS 7.0、PBS 8.0 缓冲液中4′,7-二甲氧基槲皮素质量浓度分别为10.57、9.64、5.68 mg/L。
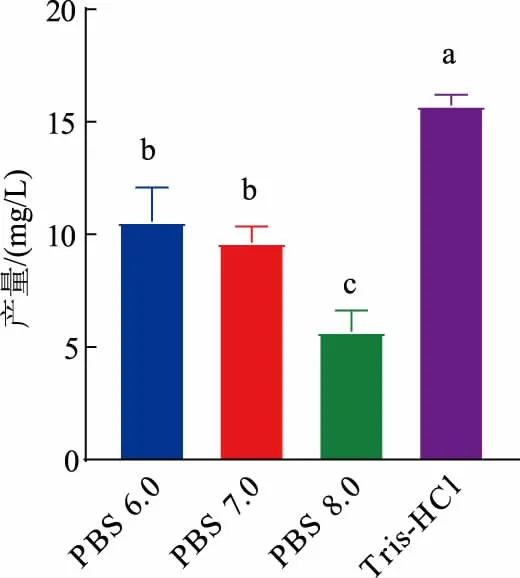
图9 不同缓冲液对4′,7-二甲氧基槲皮素产量影响Fig. 9 Effects of different buffers on 4′,7-dimethoxyquercetin yield
2.4.3培养体系的优化 为了提高4′,7-二甲氧基槲皮素产量, 通过调整培养体系中模块1 与模块2细胞的比例和生物量对其进行优化(见图10)。菌体细胞质量浓度分别设置为8、16、24、32 g/L (以细胞干质量计);模块1 与模块2 质量比为3∶1、2∶1、1∶1、1∶2、1∶3。 结果表明,随着菌体细胞质量浓度的增加,4′,7-二甲氧基槲皮素产量呈现出先上升后下降趋势;在槲皮素底物添加量(质量浓度)为100 mg/L 情况下,当模块1 与模块2 质量比为1∶2,细胞质量浓度为24 g/L(以细胞干质量计)时,4′,7-二甲氧基槲皮素产量最高,为21.56 mg/L。
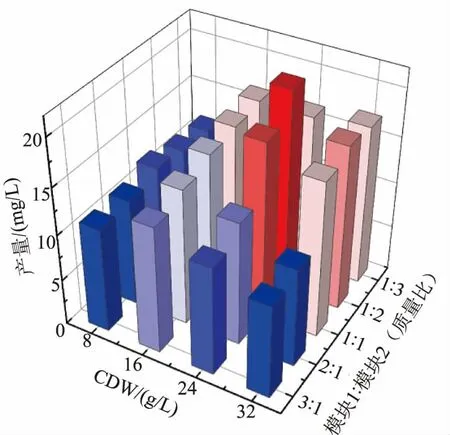
图10 培养体系的优化Fig. 10 Optimization of cultivation system
一些具有生物活性的O-甲基黄酮类化合物,如鼠李秦素、4′,7-二甲氧基槲皮素等, 在不同的芳香环和类黄酮骨架中含有两个或两个以上的甲基[23]。由于FOMT 具有严格的区域特异性,所以多甲氧基类黄酮的生物合成需要两个以上的FOMT 和甲基化反应[24]。研究发现,当试图在单个微生物中表达多种酶以构建体内全细胞催化剂时,经常会出现蛋白质表达负担和氧化还原平衡等问题[25];为了解决这些问题,4′,7-二甲氧基槲皮素的生物催化途径被分为两个基本的大肠杆菌细胞模块, 模块1 为OsNOMT 催 化 的7-OH 的 甲 基 化, 模 块2 为MpOMT4 催化的4′-OH 的甲基化。先将模块1 的细胞添加槲皮素底物,当发酵液中积累了一定量的鼠李素后,再添加模块2 的细胞,用以催化鼠李素转化合成4′,7-二甲氧基槲皮素, 并通过对发酵体系进行优化, 最高合成了21.56 mg/L 的4′,7-二甲氧基槲皮素。
3 结 语
研究表明,甲基化修饰可提高槲皮素分子的药理活性和生物利用度,然而由于甲基化槲皮素的植物获取与化学合成具有诸多限制,利用微生物表达FOMT 催化槲皮素转化为甲基化槲皮素因具有生产周期短、环境污染小等优点而受到广泛关注。 本研究中通过构建11种含有不同来源FOMT 的大肠杆菌工程菌,成功合成了4种单O-甲基槲皮素(柽柳黄素、鼠李素、异鼠李素和3-O-甲基槲皮素),最高产量分别为31.17、11.17、8.90 、52.95 mg/L; 另外还通过构建大肠杆菌共培养体系成功合成了4′,7-二甲氧基槲皮素,在槲皮素底物质量浓度为100 mg/L时4′,7-二甲氧基槲皮素产量最高为21.56 mg/L,为解决在单个微生物中表达多种酶导致蛋白质表达负担和氧化还原平衡等问题以及为合成不同甲基化黄酮或多甲氧基黄酮提供了科学参考。
