Notch信号通路相关受体及配体在复发性流产患者绒毛及蜕膜组织中的表达
2022-08-17胥爱辉
洪 甲,胥爱辉,庞 婷,杨 洋,江 点
(1.西安国际医学中心医院产科,陕西 西安 710100;2.西安医学院,陕西 西安 710021;3.西安航天总医院妇科,陕西 西安 710100)
复发性流产(Recurrent spontaneous abortion,RSA)定义为与同一性伴侣发生3次及3次以上的,妊娠小于28周的妊娠丢失者,其中绝大多数常见于妊娠早期[1]。在育龄期人群中,RSA发生率可达3%[2],尤其伴随着RSA发生次数的增多,该类型患者获得成功妊娠的概率严重下降[3],造成患者及其家庭巨大身心和经济负担。但是RSA病因至今尚未明确,涉及解剖学、遗传因素、内分泌异常、免疫原因、感染等诸多方面[4];近年来RSA不同病因学领域的机制性研究取得了一定进展,其中妊娠建立伊始多因素导致的母胎界面异常为主要病理生理学基础[5]。具备正常功能的滋养细胞以及良好的蜕膜状态是保证成功妊娠的关键,Notch信号通路能够通过参与细胞功能调节,与滋养细胞浸润、胎盘血管形成、胚胎着床等多种妊娠生理过程直接相关[6]。Notch信号通路高度保守,其作为跨膜蛋白,主要通过其受体、配体相互作用,精准地传递相关信号,从而在调控细胞增殖、分化、 凋亡方面发挥重要生理作用。其中,在哺乳动物种类中,Notch信号通路相关受体被发现有4种基因型,分别是Notch1、Notch2、Notch3、Notch4;而相关配体有5种,即DLL1、DLL3、DLL4、Jagged1、Jagged2,它们均为跨膜蛋白,并能与Notch受体结合。当受体与配体结合后,Notch通路被激活并通过经典与非经典两种途径发挥其生理调控作用,目前已被证实与子痫前期等病理妊娠发生密切相关[6],但具体方式尚不明确。然而,Notch信号通路是否也与RSA发生发展相关,并且其初步参与RSA发病的方式如何,为本研究探讨的内容。
1 资料与方法
1.1 一般资料 按照相关指南的诊断标准[7],选取行人工流产术的RSA患者15例为RSA组,该组患者均为≥3次自然流产者,平均年龄(25.17±7.22)岁,妊娠时间(9.85±2.02)周,夫妻双方无染色体异常,绒毛组织染色体检测结果正常。另选取同期正常早孕要求终止妊娠的患者15例作为正常组,该组患者均为初次妊娠,平均年龄(24.83±6.78)岁,妊娠时间(8.22±2.31)周。两组患者体重指数≤25 kg/m2,均无妊娠感染、代谢、循环、内分泌系统疾病,均无门诊手术前特殊药物使用史。本研究经医院伦理委员同意并批准,所有患者均签署知情同意书。
1.2 研究方法
1.2.1 研究标本收集:于人工流产术后分别收集患者的绒毛及蜕膜组织,0.9%氯化钠溶液漂洗干净后迅速置于液氮中,随后分管标记、冻存于超低温冰箱中待检,所有标本均经过无RNA酶化处理。
1.2.2 Notch信号通路相关受体及配体mRNA表达水平检测:使用RNA提取试剂Trizol(购自上海碧云天生物公司)提取两组绒毛及蜕膜组织中总RNA;紫外分光光度计检测RNA含量后,使用反转录试剂Prime Script RT Reagent kit(购自日本Takara公司)合成cDNA;按照qRT-PCR试剂盒说明(购自日本Takara公司)步骤进行实验;PCR反应条件为95 ℃、10 min,95 ℃、15 s,57 ℃、60 s,95 ℃、15 s,39个循环。以GAPDH为内参,进行PCR反应。检测两组绒毛及蜕膜组织中Notch1、Notch2、Notch3、Notch4及DLL1、DLL3、DLL4、Jagged1、Jagged2在mRNA水平的表达情况。每组实验重复3次。具体引物序列见表1。

表1 目的基因引物序列
1.2.3 Notch信号通路相关受体及配体蛋白表达水平检测:使用RIPA裂解液(购自上海碧云天生物公司)提取两组绒毛及蜕膜组织中总蛋白;按照BCA试剂盒(购自上海碧云天生物公司)说明书步骤检测蛋白浓度。随后进行Western blot实验,配胶完成后,上样电泳;电转仪将目的条带转至PVDF膜上(购自美国Millipore公司),完成室温封闭后,加一抗(Notch1、Notch2、Notch3、Notch4及DLL1、DLL3、DLL4、Jagged1、Jagged2单克隆抗体分别购自英国Abcam公司和武汉博士德生物工程有限公司)至PVDF膜孵育(抗体浓度:Notch1 1∶2500、Notch2 1∶3000、Notch3 1∶2500、Notch4 1∶2000、DLL1 1∶2000、DLL3 1∶3000、DLL4 1∶2500、Jagged1 1∶2500、Jagged2 1∶2000、内参β-actin 1∶500);第2天PVDF膜加HRP标记的羊抗兔二抗(抗体浓度1∶30000,购自上海碧云天生物公司)常温孵育;孵育完成后,加ECL底物液(购自美国Millipore公司)并按照试剂盒说明完成化学发光过程;最后使用Invitorgen iBright FL1500 凝胶多功能成像系统分析胶片灰度值。每组实验重复3次。
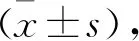
2 结 果
2.1 两组绒毛及蜕膜组织中Notch信号通路相关受体及配体mRNA表达水平比较 qRT-PCR结果显示,与正常组相比,RSA组绒毛组织中Notch1、Notch2、Notch4、DLL4、Jagged1、Jagged2在mRNA水平表达均降低(均P<0.01),Notch3、DLL1、DLL3表达在两组间比较无统计学差异(均P>0.05)。与正常组相比,RSA组蜕膜中Notch1、Notch2、Notch4、DLL1、DLL4、Jagged1、Jagged2在mRNA水平表达均降低(均P<0.05),Notch3、DLL3表达在两组间比较无统计学差异(均P>0.05)。见表2、3。
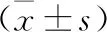
表2 两组绒毛组织中Notch信号通路相关受体及配体mRNA表达水平比较
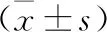
表3 两组蜕膜组织中Notch信号通路相关受体及配体mRNA表达水平比较
2.2 两组绒毛及蜕膜组织中Notch信号通路相关受体及配体蛋白表达水平比较 Western blot结果提示,与正常组相比,RSA组绒毛中Notch1、Notch2、Notch4、DLL4、Jagged1、Jagged2蛋白表达水平均降低(均P<0.01),Notch3、DLL1、DLL3表达在两组间比较无统计学差异(均P>0.05),见图1(表4)。与正常组相比,RSA组蜕膜中Notch1、Notch2、Notch4、DLL1、DLL4、Jagged1、Jagged2蛋白表达水平均降低(均P<0.01),Notch3、DLL3表达在两组间比较无统计学差异(均P>0.05),见图2(表5)。
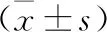
表4 两组绒毛组织中Notch信号通路相关受体及配体蛋白表达水平比较
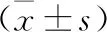
表5 两组蜕膜组织中Notch信号通路相关受体及配体蛋白表达水平比较
3 讨 论
RSA为临床中常见疾病,因其复杂和尚不明确的病因,目前尚未有较为精准的诊断方法及治疗手段[8],逐渐成为困扰人类生殖健康的一大问题。目前,基于RSA的病因学研究种类繁多,涉及免疫、细胞自噬[9]、非编码RNA[10]等,但无论研究领域如何,正常且顺利的胚胎着床以及容受性良好的蜕膜环境为避免RSA发生的基本要素。而Notch信号通路广泛表达于女性生殖系统(如子宫内膜)及妊娠相关组织(如胎盘、胚胎囊泡)中,其本身作为一类高度保守的受体-配体信号系统,在细胞增殖、凋亡、分化、侵袭、黏附,以及细胞间免疫调节方面均发挥重要生理性作用[11];而Notch信号通路受体-配体表达的缺失或者异常均可直接影响上述生理过程,导致妊娠过程异常的发生,包括RSA、子痫前期疾病等[6]。
作为跨膜蛋白家族,Notch信号通路的正常运转依靠其受体与配体间的正常相互作用。相关研究[12-13]表明,在整个妊娠期,部分Notch信号通路相关配体及受体可在不同类型绒毛外滋养细胞及蜕膜基质细胞中表达。因此,本研究从“种子”(绒毛)和“土壤”(蜕膜)组织层面出发,探究Notch信号通路参与RSA的可能方式。我们选择正常早孕流产患者作为对照,研究RSA患者绒毛及蜕膜组织中Notch信号通路相关受体及配体的表达情况,结果发现:在Notch受体层面,RSA组患者绒毛及蜕膜组织中Notch1、Notch2、Notch4在mRNA及蛋白水平表达降低,而Notch3表达则在两组间无统计学差异;作为哺乳动物中表达的4种Notch受体,均可在滋养细胞或子宫内膜基质细胞中表达;其中Notch1、Notch2能够通过对白介素4的表达调控,促进辅助性T细胞的分化[14];而在体外实验中也发现Notch1能够增加两种滋养细胞的浸润过程[15];Notch2则在胚胎着床早期能够影响滋养层细胞多种功能[16];此外,Notch4在子宫内膜增殖期表达增高,被证明参与内膜容受性调节过程[17];Notch4也能够参与滋养细胞侵袭性调节与螺旋动脉重铸过程[18]。结合本研究中发现提示Notch1、Notch2、Notch4的表达降低,进一步减低了Notch信号通路的受体-配体结合率,影响了该通路的信号转导作用,减弱了滋养细胞侵袭、蜕膜正常容受性建立过程,从而可能与RSA相关。
Notch配体包括Delta 样分子(DLL)以及Serrate 的同源分子(Jagged),当Notch配体与受体结合后,才会激活转录活化因子,发挥其细胞功能调节能力;DLL及Jagged均能够反向促进和激活Notch信号通路作用。本研究中我们对Notch配体检测结果发现:RSA组绒毛组织中DLL4、Jagged1、Jagged2在mRNA及蛋白水平表达降低,DLL1、DLL3表达在两组间比较无统计学差异;而在RSA组蜕膜中DLL1、DLL4、Jagged1、Jagged2在mRNA及蛋白水平表达均降低,DLL3表达在两组间比较无统计学差异。DLL4、Jagged1能够促进母胎界面T细胞增殖;而相关研究已证实DLL4、Jagged1、Jagged2在子痫前期胎盘滋养细胞、血管内皮细胞中低表达,它们与胎盘血管形成异常相关[19-20],这与我们的发现具有一致性。而除外内皮细胞,DLL1、DLL4也可表达于子宫内膜NK细胞,并通过影响γ干扰素分泌,发挥Notch通路对螺旋动脉重铸的影响。而DLL3与其他配体不同,其能够抑制其他配体与Notch通路的结合,进而降低Notch通路的激活[21]。综上,推测由于分布于不同生殖相关组织(滋养细胞、血管内皮细胞、免疫细胞等)的Notch信号通路部分配体表达下降,从而导致Notch信号传导激活过程受阻,进一步导致母胎界面中免疫平衡、滋养细胞功能异常、血管重铸及蜕膜化过程障碍等发生,最终诱发RSA产生。
本研究中发现Notch信号通路部分相关受体及配体在RSA患者绒毛及蜕膜组织中呈现病理性低表达,一方面提示Notch信号通路与RSA发病相关,另一方面也说明Notch信号通路可因受体-配体结合异常,在妊娠早期从胚胎本身及蜕膜状态两个层面影响了最终的正常植入过程,即参与了RSA发生。本研究为进一步明确RSA发病机制提供了实验依据。
