重视不同来源移植细胞在视网膜退行性疾病中的替代治疗作用△
2022-08-12万光明
万光明 余 川
视网膜退行性疾病以视网膜色素上皮细胞和光感受器细胞进行性减少为特征,目前尚不可治愈,如老年性黄斑变性(AMD)、视网膜色素变性(RP)和Stargardt病等[1]。临床上视网膜退行性疾病的治疗多以抗炎和营养神经等方法为主,目的是阻止或减缓疾病进展,保存剩余视力[2],但作用有限,不能有效恢复受损视网膜细胞的功能。视网膜退行性疾病存在相关致病基因或易感基因,且基因疗法已被证实可改善遗传性视网膜疾病患者的视觉功能,但这种治疗对晚期患者效果较差[3-4]。近年来,视网膜疾病再生治疗被广泛研究。细胞替代治疗已成为视网膜退行性疾病的一种潜在治疗方法[1-2,5-6]。目前,以干细胞为基础的疗法替代丢失的视网膜细胞已成为一个快速发展的转化研究领域。通过细胞移植将具有特定功能的细胞整合于受损视网膜,可改善视网膜微环境以及替代和修复丢失或受损的细胞,从而恢复组织丧失的功能。移植治疗所采用的细胞通常包括自体或异体细胞、干细胞以及干细胞来源的视网膜前体细胞或成熟细胞。视网膜退行性疾病中细胞替代治疗的作用越来越受到重视。不同类型的移植细胞有不同优缺点,本文从不同来源移植细胞的角度阐述视网膜退行性疾病的替代治疗现状,并对未来细胞替代治疗的前景进行展望。
1 干细胞
1.1 胚胎干细胞胚胎干细胞(ESC)常见于发育胚胎中,可定向分化,形成机体各种组织。体外获得高质量的人ESC(hESC)取决于胚胎质量、分离程序和培养条件,目前已经成功建立了临床级hESC细胞系。但hESC只能从人类胚胎中获得,存在伦理问题。异种或同种异体间的免疫排斥反应也阻碍着ESC疗法的应用,通常在移植后联合免疫抑制治疗。通过基因修饰的ESC可降低免疫排斥反应,减弱固有免疫和适应性免疫反应的杀伤作用,例如,修饰编码和控制MHC I类和II类分子表达的相关基因,但在移植治疗时,由于缺乏诱导器官生成的信号,ESC在体内形成畸胎瘤的风险较大,尚无有效方法解决致瘤性问题[7]。目前,使用ESC治疗视网膜退行性疾病的研究多以ESC来源的视网膜前体细胞或成熟细胞为主。由于细胞替代治疗的关键在于移植细胞的可用性,因此,成功将ESC分化为特定细胞表型后,需在体内外对所分化细胞的结构和功能进行鉴定。
1.2 成体干细胞成体干细胞是机体组织特有的干细胞,具有自我更新、增殖和细胞谱系分化的潜能,并长期驻留于特定的生态位中,主要存在于骨髓、脂肪、脐带、视网膜和神经等组织中,可分化为功能成熟的组织细胞,但其定向分化为靶向移植细胞能力有限[8-10]。
1.2.1 间充质干细胞间充质干细胞(MSC)具有免疫原性低,不受伦理限制等特点,因MSC分化为特定靶细胞的能力有限,其移植治疗主要通过免疫调节并提供营养支持来修复受损组织,延缓视网膜退行性病变进展。目前,MSC移植治疗视网膜退行性疾病的临床研究已有报道。骨髓MSC注射于RP患者玻璃体内,可改善视功能,但会导致纤维性增殖膜、牵拉性视网膜脱离、虹膜新生血管等并发症[11-12]。玻璃体内注射的MSC难以迁移并整合到视网膜病变区,无法发挥更有效的治疗效果。而视网膜下腔注射可解决此问题,但同时会导致新的并发症。将脂肪MSC移植于11例晚期RP患者视网膜下腔后,随访发现,仅有4例患者视力改善,并出现5例视网膜前膜和1例脉络膜新生血管[13]。人脐带组织来源的MSC能够持续稳定扩增,无核型变化,可挽救大鼠光感受器功能,有效减缓视网膜退行性疾病进展[14]。临床中,给予晚期RP患者静脉输注脐带MSC可维持或部分改善患者视功能,随访过程中没有明显不良反应发生[15]。
MSC玻璃体内和视网膜下腔移植存在增殖、视网膜脱离、新生血管形成等严重并发症,并存在存活率低的特点,单纯MSC移植治疗的临床应用受到限制。截至目前,国内获批的26项干细胞药物临床试验中,有19项为MSC注射液,适应证中均不包括视网膜退行性疾病。静脉输注合适剂量MSC可能成为一种安全的细胞治疗途径,但此种方法的效果因机体循环系统的免疫杀伤作用而明显降低,无法进行有效的细胞替代治疗。最近的一项研究发现,MSC培养基中加入硫酸葡聚糖可促进细胞外基质和活性细胞因子的分子自组装,制备出一种浓缩MSC分泌促血管生成因子的干细胞胶原纳米颗粒,并成功应用于伤口的血管再生[16]。这为视网膜退行性疾病的MSC移植治疗提供了新的研究方向。通过与材料相关学科结合,不仅充分利用MSC外分泌因子或外泌体的功能,还可减少移植治疗的并发症,进一步提高干细胞精准化治疗效果。
1.2.2 视网膜干/祖细胞视网膜干/祖细胞(RSC/RPC)是视网膜组织特有的成体干细胞,可分化形成视网膜前体细胞。不同物种RSC的再生能力和机制存在差异,以往认为成年哺乳动物视网膜缺乏再生能力,但后续研究发现,成人睫状上皮的纤毛边缘存在RSC以及视杯细胞内层存在RPC,但增殖能力均有限[17-18]。外源性因素可在体外激活具有干细胞特性的RSC/RPC,这些细胞存在于成人眼组织内,包括睫状缘细胞、视网膜色素上皮(RPE)细胞、虹膜色素上皮(IPE)细胞,Müller细胞和无长突细胞等[19]。在体内,成年小鼠Müller细胞能够被激活至RPC状态,并刺激功能性神经元再生[20-21]。干细胞的再生能力需要自身与其生态位之间高度协调活动的参与[22]。对RSC/RPC特定分化所需微环境的研究,并明确调节RSC/RPC向临床所需的细胞或组织类型进行定向分化的信号通路是其替代治疗成功与否的关键。
RSC/RPC替代治疗视网膜退行性疾病已在动物实验和早期临床试验中取得一定效果[20-21,23],但其安全性仍需进一步验证。此外,移植后RPC分化能力往往有限,其整合和分化取决于宿主组织微环境,如免疫反应、视网膜分泌的抑制因子等[19]。因此,不断加深对RSC/RPC生态位和组织病变区微环境的认识,通过调节内外信号途径,解除抑制因素,将有助于视网膜细胞的再生性研究。
1.2.3 神经干细胞神经干细胞(NSC)来源于神经组织,常用于中枢神经系统损伤的修复,而视神经属于中枢神经系统的一部分。NSC移植治疗视网膜退行性疾病过程中,神经视网膜功能的改善是细胞替代作用,还是对存活细胞的营养支持,目前尚不清楚。流产胎儿中枢的NSC移植到大鼠视网膜下腔,可维持光感受器与二级神经元间特殊的突触连接以及吞噬光感受器外节的能力,能够保护光感受器细胞,促进视网膜退行性疾病的修复[24],但NSC整合到视网膜外核层后并未分化为成熟的光感受器细胞[25]。这说明视网膜下腔移植的NSC可能通过营养支持保护而非替代受损的光感受器细胞。
1.3 诱导多能干细胞诱导多能干细胞(iPSC)是从重编程的体细胞中获得,具有与ESC类似的细胞分化潜能,两者常经诱导分化为视网膜细胞前体细胞或成熟细胞,进行视网膜退行性疾病的替代治疗研究。相较于hESC,iPSC的来源更加广泛,避免了种属或异体间的免疫排斥反应,同时解决了因使用人类胚胎组织带来的伦理学问题。iPSC用于细胞治疗的一个明显优势是移植细胞可以来源于自体细胞,但iPSC存在表观遗传学异常、基因组不稳定等情况[26-27]。因患者体细胞可能携带致病基因,与自体iPSC相比,细胞治疗中利用健康体细胞去分化获得的同种异体iPSC将更为安全[28]。2022年4月国内首个iPSC来源的干细胞药物——异体内皮祖细胞注射液(ALF201)——获得临床试验默示许可(CXSL2200090),其适应证为大动脉粥样硬化型急性缺血性卒中。iPSC生产过程是费时、昂贵的,这增加了基础研究和临床应用的负担。因此,在确保安全有效地获得iPSC基础上,开发一套更快、更经济的重编程系统是必要而迫切的。
2 RPE细胞
由于RPE细胞在视网膜退行性疾病中受累较早,而且对光感受器细胞有保护和支持作用,RPE细胞移植已成为目前治疗视网膜退行性疾病的重要临床方法之一,目的是替代支持光感受器的RPE细胞并为周围组织提供营养和支持作用。移植的RPE细胞主要来源于自体、异体和不同类型干细胞。
2.1 自体或异体来源的RPE细胞自体RPE细胞免疫原性低,移植治疗时,常进行RPE和脉络膜联合移植。动物实验表明,单纯自体RPE细胞移植可显著减少因RPE细胞丢失引起的兔光感受器变性和脉络膜血管萎缩[29]。自体RPE细胞和部分脉络膜联合移植治疗光感受器退行性病变的模型兔,其退化的光感受器细胞的存活时间延长,并且外节再生出现的更早[30]。最新的研究证实,RPE细胞和脉络膜联合移植可快速重建移植区血管组织,进而维持RPE细胞的正常生理功能和光感受器细胞的功能状态[31]。这为自体RPE细胞临床替代治疗提供了研究基础。临床试验中,通过自体RPE细胞和脉络膜联合移植治疗湿性和干性AMD患者,可观察到补片贴附良好,且出现血管化(图1和图2),患者视力较术前改善,但也出现视网膜出血、视网膜脱离、增生性玻璃体视网膜病变和新生血管复发等并发症[32-33]。自体RPE细胞取材较为困难,对手术者要求较高,且易出现严重并发症,使其研究和应用受限。
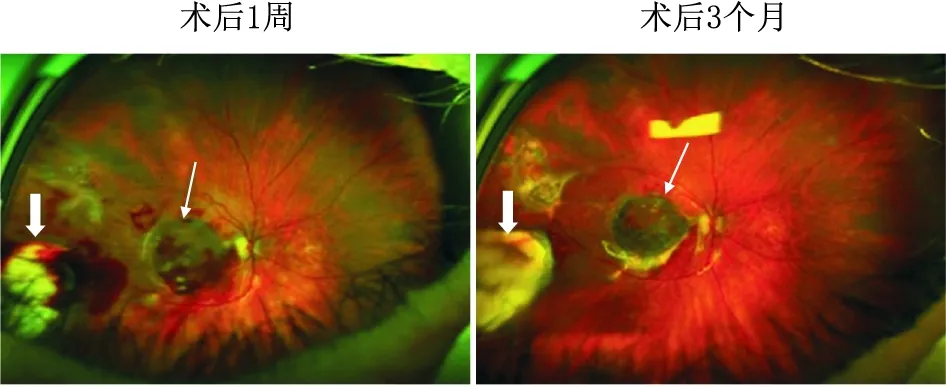
图1 AMD患者自体RPE-脉络膜补片移植术后的眼底彩色照像 白色细箭头:补片;白色粗箭头:补片采集部位。图片来源:Parolini等,Retina,2020。

图2 AMD患者自体RPE-脉络膜补片移植术后2年的荧光素眼底血管造影(FFA)和吲哚菁绿血管造影(ICGA) 白色细箭头:补片;白色粗箭头:补片采集部位;三角形箭头:纤维性瘢痕。图片来源:Parolini等,Retina,2020。
异体RPE细胞,包括成人RPE细胞和胎儿RPE细胞,其中成人型细胞移植后易出现免疫排斥反应,胎儿型细胞因视网膜发育程度低,免疫原性相应减弱,可在体外大量扩增,但存在伦理学问题。AMD患者进行同种异体成人或胎儿RPE细胞移植后,视力在随访期间并未得到有效改善[34-35]。与自体RPE细胞移植相比,同种异体RPE细胞常进行单纯细胞膜片或悬液移植,因治疗效果欠佳、取材困难、排斥反应和术后并发症的存在,相关报道较少。
2.2 ESC来源的RPE细胞ESC经诱导分化形成的RPE细胞,在结构和功能上具有RPE细胞的典型特征。通过对ESC来源的RPE(ESC-RPE)细胞进行转录组分析发现,该类RPE细胞可稳定转录,不发生上皮-间充质转化,并形成成熟的RPE细胞群[36]。ESC-RPE细胞的体外成熟度对维持其关键功能基因的高水平表达具有重要作用[37],且有成熟晚期的RPE细胞群对氧化应激有更好的耐受性[38]。
hESC-RPE细胞悬液移植治疗Stargardt病时,移植部位色素沉积于RPE层,范围逐渐扩大(图3),患者视力较治疗前提高,随访期间未发现明显免疫排斥反应、致瘤性等并发症[39]。同样,经该类细胞悬液移植治疗AMD的长期安全性和耐受性评估试验也得到相似结果[40]。除进行细胞悬液移植治疗外,hESC-RPE细胞单层膜片植入严重湿性AMD患者视网膜下腔后,可在体内正常存活,其周围色素沉积呈离心性扩大,移植24周后趋于稳定(图4),植入超过1年的患者视力均获得改善[41]。极化RPE细胞膜片能够更好地拮抗氧化应激诱导的细胞死亡[42]。将由ESC来源的视网膜类器官和极化RPE细胞膜片使用生物黏合剂制成的视网膜补片共移植于免疫缺陷视网膜退化晚期大鼠体内后,可观察到移植补片生长,新光感受器细胞和神经元形成以及宿主视网膜细胞整合,使得受损的视网膜组织结构重建[43]。目前,临床中ESC-RPE细胞联合移植相关研究尚未见报道。对于ESC-RPE细胞单纯或联合移植,需提高细胞纯度,控制分化程度,分析致瘤特性,并明确生物分布和移植细胞与宿主间的相互作用等,进行临床前安全性和有效性研究也必不可少。ESC-RPE细胞属于同种异体移植,在替代治疗中还需考虑免疫原性以及全身或局部免疫抑制剂的使用情况。因免疫抑制剂存在副作用,如何降低移植细胞的免疫原性是亟需解决的问题。通过将生物材料与细胞替代治疗相结合,多层纳米涂层自组装技术制备ESC-RPE细胞移植物的免疫原性显著降低,移植治疗中未使用免疫抑制剂,仍可保持移植细胞的生存活力[44]。这体现了医学应用研究与材料科学结合的优势,为解决细胞替代治疗的潜在问题提供了有效方法。

图3 Stargardt病患者hESC-RPE细胞悬液移植前后的眼底彩色照像和光学相干断层扫描(OCT) 箭头:色素沉着增加,且位于RPE层。图片来源:Schwartz等,Lancet,2012。

图4 湿性AMD患者1和患者2中hESC-RPE细胞膜片移植后的眼底彩色照像 绿色虚线:移植片的原始边界。图片来源:da Cruz等,Nat Biotechnol,2018。
2.3 iPSC来源的RPE细胞iPSC来源的RPE(iPSC-RPE)细胞表现出正常RPE细胞的特性和功能,可表达RPE相关标记蛋白并发挥吞噬活性,能够为光感受器细胞提供营养支持和短暂的拯救作用[45]。但iPSC-RPE细胞对氧化应激更为敏感[46]。这提示iPSC-RPE细胞悬液移植到体内有存活率低的可能。自体iPSC-RPE细胞膜片首次应用于湿性AMD患者,术后1年,可在患者中观察到完整移植片和黄斑囊样水肿[47],移植4年后,移植片仍然存活,色素沉积范围稍增加,周围的外核层和邻近的脉络膜血管持续存在,视力没有明显变化[48](图5)。这说明自体iPSC-RPE细胞移植片可能有支持光感受器和脉络膜血管以及延缓病情进展的作用。

图5 湿性AMD患者iPSC-RPE细胞膜片移植前后的眼底彩色照像、OCT和FFA 眼底彩色照像中,黑色星号和白色三角形箭头:纤维性新生血管膜及其边界;白色星号:新生血管膜切除术后下方脉络膜血管;黄色细箭头:视网膜出血处;白色细箭头:移植片;红线内区域:主要移植片;绿线内区域:移植物碎片。OCT图片中,黄色虚线内区域:黄斑区呈高反射性的新生血管膜;白色星号:光感受器细胞层;黄色细箭头:移植片中RPE样细胞系延伸至光感受器细胞层和脉络膜间隙;橙色三角箭头(术后1年OCT图):黄斑囊状水肿;黄线:移植片;黄色三角箭头:外核层与移植片连接处;橙色粗箭头:主干血管;橙色三角箭头(术后4年OCT图):网状血管。FFA图中,白色星号:移植区持续存在的脉络膜血管。图片来源:Mandai等,N Engl J Med,2017; Takagi等,Ophthalmol Retina,2019。
由于iPSC-RPE细胞存在携带致病基因、突变等风险,使得相关临床试验受到诸多限制。通过从AMD患者中获得无癌性突变的临床级iPSC,经再分化制备成临床级iPSC-RPE细胞膜片,移植于大鼠和猪激光诱导的RPE损伤模型后,有效改善了细胞膜片在移植区的整合和功能[49]。人iPSC-RPE和光感受器细胞联合移植于RP模型大鼠的视网膜下腔,10个月后,未见异常的增殖细胞,移植后的细胞分别具有人RPE细胞和光感受器细胞特征,对视力有明显的维持作用[50]。此外,在涂有胶原蛋白的可降解生物膜两侧共培养iPSC-RPE细胞和内皮细胞,通过制备人造血-视网膜屏障模型,有效地维持了移植细胞生长和细胞间接触[51]。上述细胞膜片移植、联合移植和视网膜类器官移植实验证实了iPSC-RPE细胞在视网膜退行性疾病动物模型中的安全性和有效性,为在患者体内进行细胞替代治疗研究提供了可靠的依据,但仍需进一步的动物实验研究加以证实以有效提高iPSC-RPE细胞的临床适用性。目前,iPSC-RPE细胞移植面临的挑战包括手术技术、病理性微环境、免疫排斥和免疫抑制等。随着移植物的基因校正、生物材料仿生支架、视网膜组织工程等技术的不断完善,有望解决iPSC-RPE细胞移植存在的问题,使植入体内的细胞能够复制原生RPE细胞的功能,进一步增强病变视网膜的再生能力。
2.4 MSC来源的RPE细胞MSC可进行跨胚层分化,脐带、脂肪和骨髓MSC在特定条件下进行体外诱导分化为RPE细胞,但仅具备部分功能,如相关标志物表达、吞噬和分泌功能等。共培养、条件培养基和小分子物质等在体外MSC来源的RPE(MSC-RPE)细胞形成中发挥重要作用[52-54]。体内诱导条件下,不同移植途径的MSC分化方向以及所形成RPE细胞的功能存在差异。大鼠视网膜下腔注射的骨髓MSC可表达泛细胞角蛋白、胶质纤维酸性蛋白和视紫红质,不仅能够分化为RPE细胞,还具有向光感受器和神经胶质细胞分化的能力[55],但经小鼠尾静脉注射的骨髓MSC却无法迁移至损伤视网膜,主要通过抑制视网膜细胞凋亡,减少炎症反应,发挥视网膜损伤修复作用[56]。目前,MSC存在体内诱导率低,移植后存活率低等缺点。
此外,IPE细胞与RPE细胞起源于同一胚胎细胞系,结构和功能上有诸多相似。人虹膜组织分离出的IPE细胞具有有限的视网膜干细胞特性[57]。自体IPE细胞移植于切除脉络膜新生血管的湿性AMD患者视网膜下腔后,可作为RPE细胞的替代物,但功能较低,随访期间大部分患者视力稳定,未见黄斑水肿或脉络膜新生血管复发[58]。移植的替代细胞能否存活主要取决于宿主免疫排斥反应的强弱和病变区微环境的适宜程度。因IPE细胞具有自体来源、取材相对容易等优点,移植后很少发生排斥反应,适合于临床移植,但移植效率低。通过基因修饰提高细胞活性或传递靶向分子,可进一步提高IPE细胞移植治疗视网膜退行性疾病的效率,但基因修饰、细胞体外培养和视网膜微环境等可能降低移植安全性。
3 光感受器细胞
不可逆性的光感受器细胞功能障碍或死亡常发生于视网膜退行性疾病晚期。多能干细胞(PSC)分化的光感受器细胞及其前体细胞的替代治疗是目前重要的研究方向之一[59]。经过鼠源性、人源性、干细胞源性以及体外二维培养和三维视网膜分化等的不断探索和改良,已获得具有纤毛结构、成熟外节结构和整合能力的光感受器细胞及其前体细胞,为光感受器退行性疾病的替代治疗提供了细胞移植来源。
hESC来源的视锥细胞前体移植于晚期光感受器退化模型小鼠的视网膜下腔,发现其与双极细胞形成突触连接,约1/3小鼠出现对光反应敏感,但大部分小鼠出现异常光反应,如光诱导抑制[60],这表明,体内移植的视锥细胞前体可进行细胞整合,进而修复损伤的视网膜,但这种组织重塑效率低且不稳定。对于iPSC来源的未成熟视杆细胞,进行野生型或视网膜变性小鼠的视网膜下腔移植后,不仅出现视紫红质阳性的外节样结构,还表现出与原生发育的视杆细胞相似的膜电流以及表达特异性光转导基因的能力[61]。除hESC/iPSC分化的光感受器前体细胞外,体外扩增的RPE细胞也可分化为具有多种光感受器特性的神经细胞,并表达光感受器标记物[62]。正常情况下,MSC不能向光感受器细胞转化。通过基因修饰,过表达促红细胞生成素的脐带MSC,经体外选择性培养后,发现其向光感受器细胞分化的能力明显增强[63]。然而,将MSC和RPE细胞联合移植于小鼠视网膜下腔,在提高移植细胞存活率的基础上,仅能发挥免疫抑制和促进神经营养因子分泌的作用[64],不能在体内定向分化为具有替代光感受器的功能性细胞,但hESC来源的神经前体细胞与RPE细胞体外共培养,可获得具有光敏感受体特异性的细胞[65],这提示在体移植细胞的分化可能受病变区微环境、细胞类型和移植方式等因素的影响。因此,直接进行体外分化或分离的光感受器细胞及其前体细胞移植治疗将更为有效。
人 PSC 来源的层状结构视网膜类器官和替代治疗的相关研究已相继开展(图6)。三维视网膜组织和生物可降解三维支架的应用拓展了光感受器细胞替代治疗的研究领域[66-67]。目前,移植性光感受器细胞的形态和功能存在诸多不足,其替代治疗面临着很多未解决的技术难题,相关研究仍处于临床前研究阶段。光感受器细胞移植效果受疾病类型、外界膜完整性、反应性胶质增生和免疫反应影响,如何选取合适的细胞来源、分化状态、植入时机和纯化移植细胞,进一步优化移植效果在当前研究中备受关注。由于视网膜退行性疾病中,RPE细胞先发生病变,使其对光感受器细胞的支持和保护作用降低,单一光感受器细胞移植不能满足病情改善或恢复的需要。联合移植时,RPE细胞能够维持光感受器的结构和功能,使替代治疗效果优于单一细胞移植。对于特殊类型视网膜退行性疾病,如视网膜色素变性、视锥细胞营养不良等,相应细胞呈特异性丧失,视杆细胞和视锥细胞的个性化移植为此类退行性疾病提供了更为合适的治疗方法。
4 小结和展望
对于视网膜退行性疾病的细胞替代治疗,安全、高效的移植细胞至关重要。移植细胞在宿主体内的存活是移植成功的首要因素。理想的移植细胞需具有较高存活率、稳定分化程度、特定移植方式以及与宿主视网膜高效地整合等特点。但因移植细胞存在伦理、免疫排斥、致瘤性、携带致病基因等不足和病变区微环境改变的特点,使得细胞替代治疗效果受到很大程度上的限制。随着诱导纯化方法的完善和移植技术的不断更新,部分移植细胞在治疗视网膜退行性疾病方面成为现实,但其在临床上的远期疗效和安全性仍需进一步评估。
不同来源移植细胞将成为未来细胞替代治疗的研究焦点,重视其在视网膜退行性疾病中的替代治疗作用,通过实验室和临床研究,不断优化移植细胞的治疗效果,建立视网膜退行性疾病替代治疗细胞的评价标准,可有效筛选出最佳的移植细胞类型。细胞替代治疗效果的提高,不仅需要充分利用不同来源细胞各自的移植优势,还应采取有效措施避免其制备及治疗过程中的风险因素,更重要的是重视移植细胞作用机制及其自身功能调控机制的研究。通过不同形式的干预措施,如重编程、基因修饰、三维培养和联合生物材料等,促进移植细胞体外分化,增强其在体的生物学功能,将有助于改善视网膜退行性疾病的细胞替代治疗效果。相信通过遗传学、材料科学、生物技术和临床医学等学科的密切合作,不同来源移植细胞或视网膜类器官的潜在问题能够得到解决,且在移植治疗及其个性化移植和联合移植方面取得显著的进展。通过不断增强移植细胞的临床适用性,基于不同来源移植细胞的替代治疗将在视网膜退行性疾病中得到广泛的应用。
