腐霉利和咯菌腈混用对黄瓜灰霉病菌的联合毒力及药剂残留动态
2022-08-10张江兆徐重新高美静卢莉娜刘贤金
张江兆, 徐重新, 沈 燕,3, 高美静,卢莉娜, 卢 飞,3, 刘贤金*,
(1. 南京农业大学 植物保护学院,南京 210095;2. 江苏省食品质量安全重点实验室——省部共建国家重点实验室培育基地,南京 210014;3. 农业农村部农产品质量安全控制技术与标准重点实验室 (南京),南京 210014)
黄瓜灰霉病是由灰葡萄孢Botrytis cinereaPers 引起的一种植物死体营养型病害。灰葡萄孢具有繁殖速度快、产孢量大等特点,由其侵染引起的灰霉病是威胁温室和大田蔬菜种植业健康发展的重要病害之一[1-3]。目前尚未培育出抗灰霉病的黄瓜品种,因此化学防治仍然是黄瓜灰霉病防控的主要方式[4]。单一农药的频繁及过量使用不仅会导致病虫害抗药性的产生,同时也易对农作物及生态环境安全产生不良影响。将不同作用机制的农药进行联合应用,不仅能够减轻农药对单一靶标的刺激,降低抗性风险,同时通过联合应用所产生的增效作用,也能够在达到目标防效的基础上减少农药施用量,从而降低农药残留,在一定程度上提升农产品质量安全[5]。
腐霉利 (procymidone) 属二甲酰亚胺类杀菌剂,是田间防治灰霉病的常用农药,其主要通过靶向抑制灰葡萄孢甘油三酯的合成,改变细胞通透性而造成胞内电解质渗漏,最终引起菌体繁殖受阻乃至死亡,从而对患病农作物起到治疗和保护作用[6]。咯菌腈 (fludioxonil) 为苯并吡咯类杀菌剂,对灰葡萄孢具有高度专一性,其主要通过抑制灰葡萄孢信号传导中有丝分裂活化蛋白激酶/组氨酸激酶的磷酸化,从而促进菌体中甘油等物质的合成,达到阻止菌体细胞生长繁殖的目的[7-8]。
Wang 等[9]报道,2020 年在全国多地韭菜样品抽样检测中,腐霉利残留超标情况屡有发生,分析其原因应是过量施药导致,这不仅严重威胁农产品安全和人体健康,也极易导致病原菌产生抗药性。有研究表明,浙江省草莓灰霉病菌对腐霉利的抗药性频率为71.5%,内蒙古灰霉病菌对腐霉利的抗药性频率已达90%以上。灰葡萄孢对咯菌腈敏感性很强,很少出现抗药性菌株[10]。鉴于腐霉利和咯菌腈作用方式不同,因此通过将两种农药联合应用,很有可能提升药剂对病原菌的抑制作用,从而减少农药施用量,一方面能降低农药残留,提升农产品质量安全水平,另一方面也有望降低病原菌对咯菌腈的抗药性风险并延缓其对腐霉利的抗药性发展。
目前已有研究显示,腐霉利和咯菌腈在番茄灰霉病防治中无交互抗性现象,将两者联合应用有可能获得较为理想的复配增效药剂[11],但尚未见有关腐霉利和咯菌腈复配在黄瓜灰霉病防治中应用的研究报道。基于此,本研究拟采用菌丝生长速率法,通过测定腐霉利和咯菌腈单独使用的毒力及混配组合的联合毒力,探究了两种杀菌剂的最佳混配增效比,进而初步明确了其混配增效机理,同时通过优化后的高效液相色谱-串联质谱(HPLC-MS/MS) 检测方法,探究了混配剂减量施用后在黄瓜上的残留规律,以期获得一种安全、绿色、减量不减效的混配型新制剂。
1 材料与方法
1.1 供试材料
1.1.1 菌株 黄瓜灰霉病菌野生菌株,由本课题组保存,于2019 年从发病黄瓜上通过单孢分离获得,经菌株特征序列鉴定为灰葡萄孢Botrytis cinereaPers。
1.1.2 药剂及主要仪器 99% 咯菌腈 (fludioxonil)标准品,上海源叶生物科技有限公司;98% 腐霉利 (procymidone) 标准品,宝如亿 (北京) 生物技术有限公司;50%咯菌腈可湿性粉剂 (WP),瑞士先正达作物保护有限公司;50%腐霉利 WP,山东省青岛凯源祥化工有限公司。
AB Triple Quad™ 4500 (美国AB SCIEX 公司);QL-901 涡旋混合器 (江苏海门市麒麟医用仪器厂);R10.v.v 食品切碎搅拌机 (法国Robot Coupe公司) 等。
1.2 试验方法
1.2.1 供试培养基 马铃薯葡萄糖琼脂培养基(PDA):200 g 马铃薯,16 g 琼脂粉,20 g 葡萄糖,用超纯水定容至1 L,于115 ℃ 灭菌20 min,待用。
1.2.2 抑菌活性测定 采用菌丝生长速率法[12]。分别称取适量腐霉利及咯菌腈标准品至10 mL 容量瓶中,以丙酮溶解,用无菌水定容至10 mL,配成10 g/L 的母液。取适量母液,将腐霉利和咯菌腈分别按照质量比1∶2、1 : 1 和2∶1 的比例配成混合药液,用无菌水稀释,加入PDA 培养基中,配制成混合药液最终质量浓度分别为0.005、0.01、0.02、0.04、0.08、0.16、0.32 和0.64 mg/L的含药培养基平板;同时配制腐霉利和咯菌腈最终质量浓度均为0.005、0.01、0.02、0.04、0.08、0.16、0.32 和0.64 mg/L 的单剂含药平板;以无药PDA 平板作对照。将保存的黄瓜灰霉病菌在25 ℃下活化3 d 后,挑取菌丝,接种至PDA 培养基上继续活化培养3 d,沿菌落边缘打取菌碟,分别接种于各含药及对照PDA 培养基平板中央。每处理设置3 个重复。25 ℃ 避光培养3 d 后,采用十字交叉法测量菌落直径,通过DPS 分析软件得出EC50值及毒力回归曲线。
增效作用分析采用Wadley 法[13]:首先构建单剂的剂量反应曲线,并通过概率对数转换校正得到线性方程,计算出单剂的EC50值,根据所得单剂的EC50值计算混剂的EC50(th),即预期有效抑制中浓度理论值,mg/L。计算公式见式 (1)。
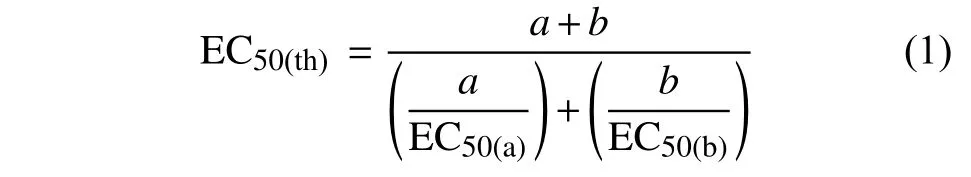
式 (1) 中:a、b分别表示两种药剂在混剂中所占的比例;EC50(a)、EC50(b)分别指a、b 两种单剂对病原菌的有效抑制中浓度,mg/L。
根据式 (2),计算混剂理论EC50值 (EC50(th))与实际EC50值 (EC50(ob),mg/L) 的比值,确定增效比 (SR)。
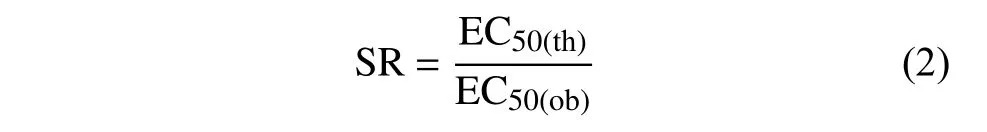
若SR>1.5,认为该混剂表现出增效作用;SR<0.5,认为其表现为拮抗作用;0.5≤SR≤1.5,则认为该混剂表现为相加作用。
1.2.3 田间试验 2021 年5 月至2021 年11 月于江苏省南京市溧水区江苏省农业科学院溧水试验基地温室,根据NY/T 788—2004《农药残留试验准则》[14],选取黄瓜处于生长期到成熟期的地块进行试验。各小区面积均在30 m2以上,每处理设3 个重复,同时设清水对照组,均施药1 次。50%腐霉利WP 和50%咯菌腈WP 单剂施药剂量均为有效成分150 g/hm2,两者质量比1 : 1 混配剂的施药剂量为总有效成分150 g/hm2。用水量为600 L/hm2。对黄瓜进行叶面喷施,并于药后2 h及1、3、5、7、10、14、21 d 取样,待前处理及分析测定。
1.2.4 仪器条件 检测方法参考GB 23200.121—2021《食品安全国家标准 植物源性食品中331 种农药及其代谢物残留量的测定 液相色谱-质谱联用法》[15]。
色谱条件:Agilent Zorbax Eclipse PLUS C18色谱柱 (2.1 mm × 50 mm,1.8 μm);柱温40.0 ℃;进样量3.0 μL,流速0.3 mL/min;流动相A 为0.1%甲酸水溶液,流动相B 为0.1%甲酸甲醇溶液,梯度洗脱条件见表1。

表1 高效液相色谱梯度洗脱条件Table 1 The gradient elution conditions of HPLC
质谱条件:ESI+多反应监测模式扫描,离子源温度为550 ℃,气帘气压力为35 MPa,电喷雾电压5 500 V,雾化气压力310 kPa。
腐霉利检测母离子对:m/z286.0,m/z284.0;子离子对:m/z109.1,m/z156.0 (定量离子);碰撞电压24 V。咯菌腈检测母离子对:m/z266.1;子离子对:m/z158.0,m/z229.0 (定量离子);碰撞电压46 V、17 V。
通过调整、优化液相色谱流动相、梯度洗脱条件、温度以及各化合物的质谱参数,最终确定了上述最优的HPLC-MS/MS 检测条件。在此条件下,各化合物均可独立出峰,且峰形良好,互不干扰。
1.2.5 样品前处理
提取:田间采集的黄瓜样品经高速研磨匀浆后,称取10 g (精确至0.01 g) 置于50 mL 离心管中,加入10 mL 乙腈,于2 500 r/min下涡旋振荡提取1 min;再依次加入1 g NaCl、4 g 无水MgSO4、1 g 柠檬酸钠二水合物及0.5 g 柠檬酸二钠盐倍半水合物,2 500 r/min 下振荡1 min;于5 000 r/min 下离心5 min,取2 mL 提取液,待净化。
净化:在装有2 mL 上述黄瓜样品提取液的离心管中加入50 mg PSA,于2 500 r/min 下涡旋分散固相萃取1 min,5 000 r/min 下离心5 min;取上清液过0.22 μm 有机滤膜,待HPLC-MS/MS检测。
1.2.6 分析方法确证 采用色谱纯乙腈配制腐霉利和咯菌腈质量浓度均为10 mg/L 的1 : 1 混合标准工作溶液,分别在空白黄瓜基质中添加适量混合标准工作溶液,得到两种农药添加水平均为0.01、0.02 及0.05 mg/kg 的黄瓜添加样品,每添加水平重复5 次,测定回收率及相对标准偏差(RSD)。采用净化后的空白黄瓜基质溶液,将10 mg/L 的1 : 1 混合标准工作溶液逐级稀释,配制成0.000 1、0.000 2、0.000 5、0.01、0.02、0.05、0.1、0.2 和0.5 mg/L 的基质匹配混合标准溶液,根据所确定的检测条件及仪器类型,选择5 个浓度点以上绘制基质匹配标准曲线。
采用标准曲线法定量,各农药组分含量按公式 (3) 进行计算。
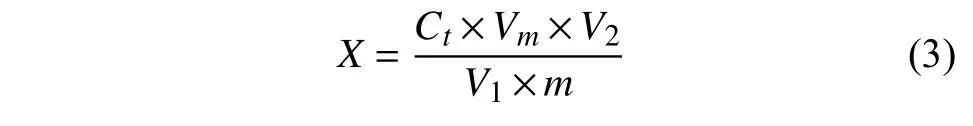
式中:X为供试样品中被测组分含量,mg/kg;Ct为根据标准工作曲线得到的样品溶液中被测组分的质量浓度,mg/L;m为所称取样品的质量,g;Vm为实测的样品提取液总体积,mL;V1为移取的提取液体积,mL;V2为定容体积,mL。
2 结果与分析
2.1 腐霉利、咯菌腈及其混配药剂对菌丝生长的影响
结果 (表2) 显示:腐霉利和咯菌腈对黄瓜灰霉病菌菌丝生长均具有较强的抑制作用,其中咯菌腈对该菌的抑制活性约是腐霉利的2.5 倍。腐霉利和咯菌腈按质量比1 : 2 和2 : 1 混配施药后,增效系数 (SR) 分别为1.0 和0.6,对该菌的抑制活性表现为简单的相加作用;而二者按质量比1 : 1 混配后,抑制作用EC50值分别是咯菌腈和腐霉利单剂的5.3 倍和7.4 倍,SR 高达5.0,表现为极强的联合增效作用。
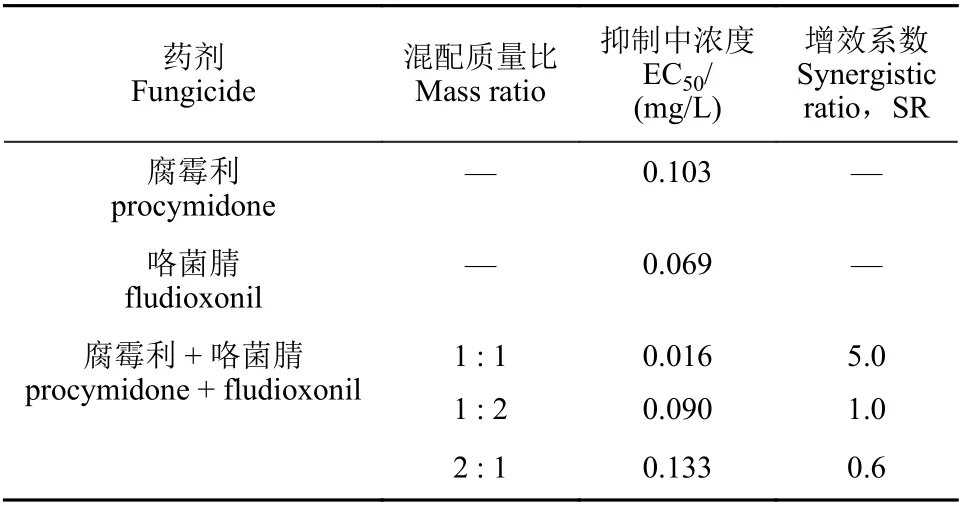
表2 腐霉利和咯菌腈单独使用及混配组合对灰葡萄孢菌丝生长的毒力测定Table 2 Toxicity of the single agent and mixtures of procymidone and fludioxonil to B. cinerea
2.2 腐霉利、咯菌腈及其混配药剂对菌丝形态的影响
为进一步了解腐霉利与咯菌腈按质量比1 :1 混配后对黄瓜灰霉病菌的联合毒力作用,采用扫描电镜对经混配药剂处理3 d 后的菌丝形态进行了观察,结果如图1 所示。其中,未经药剂处理的空白对照组 (图1A) 菌丝大多充盈饱满,未观察到菌丝渗透性加强的现象;经腐霉利单剂处理后,菌丝细胞膜渗透性明显增强,胞内物质大量外泄,大量菌丝呈现出干瘪、皱缩的状态 (图1B);经咯菌腈单剂处理后,菌丝体表面出现少量凸起,胞内物质外渗并附着在菌丝表面,但菌丝整体结构仍呈较为饱满的状态 (图1C);而经腐霉利与咯菌腈混配剂处理后,菌丝不仅表现出明显的皱缩现象,同时内容物也出现大量外渗且集中附着于菌丝表面,菌丝表观形态受损程度明显比两种单剂处理组严重 (图1D)。结果进一步印证了腐霉利与咯菌腈按质量比1 : 1 混配对黄瓜灰霉病菌具有显著的联合增效作用。

图1 扫描电镜观察两种单剂及混配药剂对黄瓜灰霉病菌菌丝表观形态的影响(4 k ×)Fig. 1 SEM observation of the effects of two single agents and the mixture on the mycelial morphology of B. cinerea (4 k ×)
2.3 检测方法确证
所采用的HPLC-MS/MS 检测方法对腐霉利和咯菌腈的标准曲线方程分别为y= 2 137.1x+ 1 731.3,R2= 0.998 8 和y= 23 186.8x+ 29 783.4,R2= 0.999 6,表明该方法下两种农药的峰面积和进样质量浓度间呈良好的线性关系。方法的定量限 (LOQ) 为0.01 mg/L。腐霉利和咯菌腈在空白黄瓜样品中的添加回收率分别为100%~102%和94%~96%,RSD分别为1.7%~5.3%和2.8%~3.4%,均在农药残留检测规范允许范围内[14],说明该检测方法可用于腐霉利和咯菌腈在黄瓜上施用后残留动态的定量分析。
2.4 残留消解动态
采用HPLC-MS/MS 检测方法对温室叶面喷施两种单剂及混配药剂后的黄瓜样品进行分析,结果显示:腐霉利单剂在黄瓜中的原始沉积量为1.77 mg/kg,咯菌腈单剂的原始沉积量为1.32 mg/kg;而两种农药按质量比1 : 1 混配施用后,腐霉利和咯菌腈在黄瓜中的原始沉积量分别为1.36 mg/kg 和0.70 mg/kg,均比各自单剂明显降低。针对施药后21 d 的黄瓜样品进行农药最终残留量分析,结果表明:腐霉利和咯菌腈单剂的最终残留量分别为0.102 mg/kg 和0.125 mg/kg;而两种农药按1 : 1 混配后,腐霉利和咯菌腈的最终残留量分别为0.042 mg/kg 和0.023 mg/kg,比各自单剂分别降低了59%和82%。消解动态分析表明,两种农药在黄瓜中的残留量与施药后间隔期呈指数关系(图2 和图3),其消解动态符合一级反应动力学方程,混配药剂中两种农药的半衰期均比各自单剂显著缩短 (表3),表明联合用药可有效降低两种农药的残留风险。

图2 腐霉利单剂及混剂的残留消解曲线Fig. 2 The digestion curves of procymidone single and mixture agents
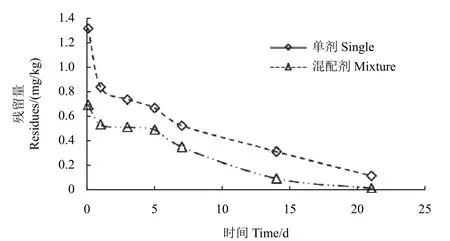
图3 咯菌腈单剂及混剂的残留消解曲线Fig. 3 The digestion curves of fludioxonil single and mixture agents

表3 腐霉利和咯菌腈在黄瓜中的消解动态Table 3 Digestion dynamics of procymidone and fludioxonil in cucumber
3 讨论与结论
目前尚未见有关腐霉利与咯菌腈复配药剂在农作物病虫害防控上应用或研究的文献报道。本研究首次探究了这两种农药混配后对黄瓜灰霉病菌的联合毒力,并通过室内抑菌活性试验,确定了两种农药按质量比1 : 1 混配后对黄瓜灰霉病菌表现为显著的增效作用,增效系数 (SR) 达5.0。该增效系数虽低于王翀[16]报道的啶酰菌胺与腐霉利按照1∶2 混配后对草莓灰霉病菌 (同为灰葡萄孢) 的增效系数 (10.34),但明显高于刘圣明等[17]报道的咯菌腈与氟啶胺按1∶3 混配后对番茄灰霉病菌 (灰葡萄孢) 的增效系数(2.09)[16-17]。由于不同药剂之间的相互影响不尽相同,关于腐霉利和咯菌腈混配在黄瓜灰霉病防控中的实际应用价值还有待后期进一步综合研究。根据扫描电镜观察结果,腐霉利与咯菌腈按质量比1 : 1 混配后,对黄瓜灰霉病菌菌丝形态所造成的损伤程度均比两种单剂严重,存在叠加放大效应,但其具体的分子机理尚不清楚。据文献报道的腐霉利和咯菌腈的抑菌作用机理[18-20],我们推测:两种农药混用后,腐霉利通过改变病原菌细胞膜通透性而引起菌丝内外渗透压失衡,瓦解了菌丝的正常形态;与此同时,咯菌腈则持续激活病原菌的高渗透甘油信号通路,以维持其内部膨压,从而加剧了病原菌菌丝渗透失衡的程度,造成菌丝干瘪以及大量内容物渗出,最终表现为协同增效作用。此外,菌丝体表还出现了细胞膜褶皱和糜烂现象,这可能是由于咯菌腈较腐霉利提前作用,导致菌丝充盈膨胀后,胞内物质溢出所致。
本研究将腐霉利和咯菌腈减量混配后施用,其原始沉积量和最终残留量均得以降低,消解半衰期有所缩短。本研究中的半衰期与文献报道的腐霉利在露地黄瓜中消解半衰期为2.1~2.8 d,在设施黄瓜中半衰期为3.1~3.8 d[21]相比,其消解速率有所减慢,原因可能是试验期间 (11 月) 温度偏低,减缓了腐霉利的代谢速率。目前尚未见有关咯菌腈在温室黄瓜中残留消解动态的研究报道,有报道其在温室菊花中的半衰期为5.5 d[22],在樱桃中消解速率则相当缓慢,半衰期为33.7~44.7 d[23]。本研究发现,咯菌腈单剂及其与腐霉利按1 : 1 质量比混配后,在田间黄瓜中的消解半衰期分别为6.93 d 和4.33 d,表明其在黄瓜中的消解速率较在樱桃中快,而与在温室菊花中的消解速率较为接近。目前关于两种或两种以上农药在作物中代谢规律相互影响的研究较少。有研究表明,腐霉利和多菌灵之间可能存在代谢抑制现象[24];而在Lin 等[25]的研究中,腐霉利和噻虫嗪复配后,因腐霉利对番茄表面微生物的多样性存在一定影响,导致两者半衰期均有不同程度缩短。影响农药在植物体内相互作用的因素较为复杂,可能取决于施药剂量、施药时期、农药本身化学结构以及农药在作物中的作用靶标等[26]。关于不同农药之间具体因何种原因造成部分药剂代谢速率加快的现象,还需进一步研究阐明。
本研究首次报道了腐霉利与咯菌腈混用对黄瓜灰霉病病原菌灰葡萄孢具有显著的协同增效作用,且两种农药混配后在田间黄瓜中的残留量以及降解速率明显优于各自单剂。所得结果不仅可为黄瓜灰霉病防治提供高效的新型混配药剂,为两种农药的联合减量施用提供依据,同时也有望通过这种减量混合用药方案,有效降低腐霉利和咯菌腈在黄瓜中的残留风险,从而提升黄瓜的产品质量安全水平。
