妊娠后期饲粮蛋白质水平对藏母羊泌乳性能的影响及乳腺转录组分析
2022-08-09姜洋洋李蒋伟张峰硕杨葆春王志有桂林生侯生珍
周 力 姜洋洋 李蒋伟 张峰硕 杨葆春 王志有 桂林生 侯生珍
(青海大学农牧学院,西宁 810016)
转录组是研究功能基因组的重要手段,不仅包括编码蛋白质的信使RNA(messenger RNA,mRNA),还包括长链非编码RNA(long non-coding RNA,lncRNA)、微小RNA(microRNA,miRNA)以及环状RNA(circular RNA,circRNA)等非编码RNA[1]。细胞或组织的特定表型不仅受蛋白质编码RNA(mRNA)的调控,还与基因组中非编码RNA密切相关。这些RNA转录物并非单一、独立的,而是能够通过特定的形式调控彼此功能,这种调控机制被称之为竞争性内源RNA(competing endogenous RNA,ceRNA)机制[2]。目前在人[3]、奶牛[4]、山羊[5]等上均有乳腺组织转录组分析的报道,但关于绵羊乳腺组织相关功能的报道甚少。以小尾寒羊为研究对象,发现饲粮营养水平能够对其生殖激素和泌乳性能产生明显的影响[6]。当饲粮能量水平恒定为12.92 MJ/kg 时,随着饲粮蛋白质水平的升高,西农萨能羊泌乳量以及乳蛋白量变化虽不明显,但乳脂率能随之显著提高[7]。由此可以看出,饲粮蛋白质水平与反刍动物的泌乳性能具有一定的关系。
藏羊(Tibetan sheep)作为我国特有的绵羊品种资源,其体格粗壮、抗寒、耐粗饲,对青藏高原极端恶劣的自然环境与气候条件具有较强的适应性[7]。乳用性能是评价乳用绵羊是否优质的一个重要标志,处于泌乳时期的母畜不断从饲粮中摄取营养物质来维持生命与生产活动,饲粮营养水平在很大程度上决定了高峰期泌乳量与泌乳持续力。母羊妊娠期正处于枯草季节,此时草场生产力与牧草营养严重不足,这不仅会影响机体维持自身以及产后泌乳的需要,同时还会限制后代胎儿的发育[8]。研究证实,反刍动物的泌乳量直接决定了多羔的成活率,还可明显影响羔羊的生长发育[9]。此外,妊娠期也是母畜乳腺发育的关键阶段,此时若能了解饲粮蛋白质水平对藏母羊泌乳性能的影响,并揭示其调控乳腺发育的分子机理,对于其泌乳性能的遗传改良具有重要的指导意义。
鉴于此,本研究拟以青海省海东市高原型藏羊为研究对象,通过采集泌乳后期乳腺组织,利用RNA-seq技术对饲喂高、低蛋白质水平饲粮的藏母羊的乳腺组织差异表达基因(differentially expressed genes,DEGs)进行筛选,并通过GO功能注释、KEGG富集分析来挖掘控制藏羊乳腺发育的相关候选基因,旨在为解析绵羊泌乳性能的分子机理提供理论依据。
1 材料与方法
1.1 试验时间与地点
动物饲养试验于2018年10月7日至2018年12月10日在青海省海东市乐都金元牧业有限公司进行,试验羊只为高原型藏羊。
1.2 试验设计与饲喂管理
试验选取体重[(45.35±2.43) kg]相近且发育正常的妊娠后期藏母羊60只(经产2胎,单羔),随机分2组,每组30只。LP组饲喂蛋白质水平为7.5%的饲粮,HP组饲喂蛋白质水平为11.5%的饲粮。试验历时65 d(配种后第85~150天),包括预试期5 d与正试期60 d。基础饲粮参照我国《肉羊饲养标准》(NY/T 816—2004)并结合藏羊生长的营养需要进行设计,其组成及营养水平见表1。精料补充料每日摄入量0.25 kg,粗饲料由燕麦干草与燕麦青贮以1∶1(按干物质计)组成,每日摄入量为3 kg,精料补充料与粗饲料混合搅拌后饲喂。

表1 基础饲粮组成及营养水平(干物质基础)
试验开始前对整个圈舍进行全面的消毒,按照羊场正规程序对试验羊进行防疫。采用全舍饲单栏饲养,每天08:00和18:00各饲喂1次,自由采食和饮水。每天清洗料槽与水槽,定期消毒,保持圈舍通风、干燥和卫生等。母羊泌乳量采用羔羊吃奶前后称重法测定。于试验第62~64天(配种后第147~149天),每日哺乳3次(08:00、13:00、18:00),完成哺乳后对羔羊进行体重称量并与母羊隔离,当日泌乳量为3次测定的总和。同时收集乳汁5 mL,将每只试验羊3 d采集到的乳汁进行混匀,用于乳成分分析。配种后第150天,每组各采集3只试验羊右侧乳腺组织放入无RNA酶冻存管,置于液氮中保存待用。
1.3 羔羊体况测定
分别在羔羊初生以及羔羊饲养第30天、第60天(断奶时)测定其体重,并计算平均日增重(average daily gain,ADG),计算公式如下:
平均日增重(g/d)=1 000×[断奶体重(kg)-
初生重(kg)]/饲养时间(d)。
1.4 母羊乳成分分析
乳成分测定:乳蛋白率、乳脂率、乳糖率均用FOSS 120型乳成分分析仪(丹麦)检测。
1.5 转录组测序
通过总RNA提取试剂盒对藏羊乳腺组织总RNA进行提取。使用超微量核酸蛋白仪检测提取RNA的浓度与纯度,再利用2%的琼脂糖凝胶电泳检测RNA的完整性。所有样品RNA提取并检测合格后,用干冰保存并送至广州基迪奥生物科技有限公司,应用Illumina NovaSeq 6000高通量测序平台进行RNA-seq测序。
总RNA提取试剂盒、FastKing RT Kit cDNA第1链合成试剂盒以及SuperReal PreMix Color(SYBR Green)等试剂盒均购自天根生化科技(北京)有限公司。
为了保证数据质量,严格按照广州基迪奥生物科技有限公司的数据处理步骤,对下机的原始数据进行质控与过滤,获得高质量数据。然后使用比对软件Tophat 2将过滤掉核糖体RNA的reads比对到物种的参考基因组上,获得藏母羊乳腺样本特异序列信息。
采用差异表达倍数(fold change,FC)以及错误发现率(false discovery rate,FDR)值对不同处理间基因表达差异的程度进行筛选,满足|log2(FC)|>2且FDR<0.05定义为DEGs。进一步结合GO和KEGG数据库对筛选出的DEGs进行功能注释、GO分类及KEGG通路分析,以P<0.05作为相关基因富集到的差异生物学通路筛选条件。
1.6 实时荧光定量PCR(RT-qPCR)
为了对转录组测序的结果进行验证,从最显著的前5条通路中挑选出5个DEGs使用primer 5.0软件设计扩增引物(表2)。通过Fast Quant RT Kit反转录试剂盒将提取的总RNA反转录合成cDNA,符合要求的cDNA按照Super ReaPreMix Plus Kit在罗氏Light Cyler 480 II实时荧光定量PCR仪上进行RT-qPCR。反应体系为:2×Super Real Color PreMix 10 μL,上、下游引物各0.6 μL,cDNA 1 μL,加RNase-free ddH2O至20 μL。反应条件:预变性95 ℃ 15 min;变性95 ℃ 10 s;退火/延伸60 ℃ 30 s,循环数为40。以β-肌动蛋白(β-actin)为内参基因,以胰岛素样生长因子1(IGF1)、细胞周期蛋白D1(CCND1)、信号转导和转录激活因子3(STAT3)、蛋白络氨酸激酶(SRC)和Ⅵ型胶原蛋白A5(COL6A5)为目的基因,相关引物由上海生工生物工程股份有限公司进行合成。每个样品设置3个复孔,目的基因相对定量的结果采用2-△△Ct法[10]进行计算。
1.7 数据统计与分析
试验数据经过Excel 2019初步整理后,采用t检验比较分析2组试验数据的差异显著性,结果用“平均值±标准差(mean±SD)”表示,P<0.05作为差异显著水平,P<0.01作为差异极显著水平。
2 结果与分析
2.1 2组羔羊生长性能比较
2组羔羊的体重与平均日增重结果如表3所示。2组羔羊的初生重、第30天体重以及断奶体重(第60天体重)均无显著差异(P>0.05),但HP组羔羊的平均日增重比LP组提高了16.40%(P<0.05)。
2.2 2组藏母羊泌乳性能比较
藏母羊的日产奶量和乳成分结果如表4所示。与LP组相比,HP组藏母羊的日产奶量提高了19.58%,同时乳糖率、乳脂率以及乳蛋白率分别提高了22.07%、24.84%、18.70%,2组间差异均达到了显著水平(P<0.05)。
2.3 乳腺转录组测序数据评估
本试验利用Illumina NovaSeq 6000高通量测序平台对LP组与HP组藏羊乳腺组织(每组3个样本)进行转录组学测序。如表5所示,所有样本原始序列(raw reads)数目均在46 645 540~59 793 388个范围内,去除接头和低质量的reads,最后过滤后序列(clean reads)数目均在46 135 380~59 177 836个范围内,占raw reads的比例为98.91%~99.05%。LP组与HP组Q20和Q30比例均在96%以上,GC含量在48.98%~51.27%,说明测序碱基识别时出错的概率较低,碱基含量接近。标准试验条件下,映射到基因组的序列(total mapped reads or fragments)比例≥70%,其中具有多个定位的测序序列(multiple mapped reads or fragments)占总体的百分比≤10%。本试验通过使用比对软件Tophat 2将过滤掉核糖体RNA的reads比对到参考基因组上,最后发现所有样本比对到参考基因组上的reads占clean reads的比例均高于98%,符合试验要求,满足后续生物信息数据分析的需要。

表2 RT-qPCR引物信息

表3 羔羊的体重与平均日增重
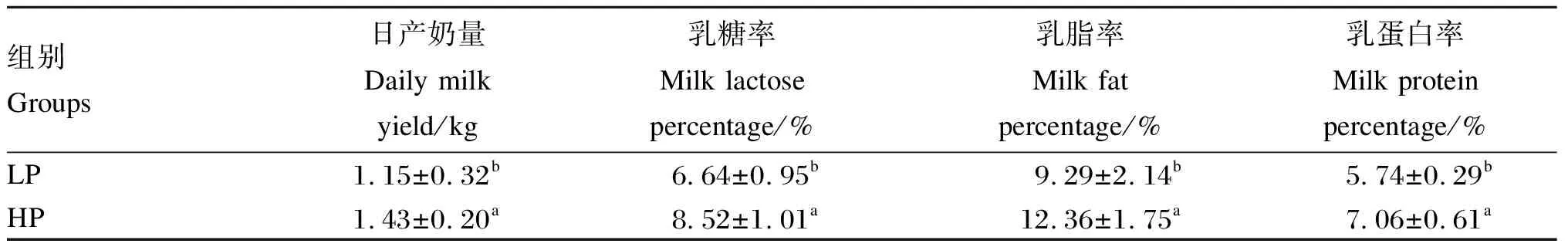
表4 藏母羊的日产奶量与乳成分
对测序数据进行主成分分析,结果如图1-A所示,2组的第一主成分(PC1)和第二主成分(PC2)解释率分别为54.50%、35.80%,2组累计可达90.30%,说明2组之间分离趋势较为明显,样本分组合理。此外,在基因丰度为1时,发现2组间共有基因数为8 827个,其中878个基因为LP组特有,120个基因为HP组特有(图1-B)。

表5 样本测序数据评估

LP:LP组;HP:HP组。下图同。
2.4 DEGs筛选、功能注释和富集分析
2.4.1 DEGs筛选
通过DEGs火山图(图2)可以非常直观地筛选出LP组与HP组的DEGs。DEGs火山图中x轴表示log2(FC)值,y轴表示-lg(FDR)值。结果显示,低、高蛋白质水平饲粮条件下藏母羊乳腺组织DEGs达到了40个,其中上调基因11个,下调基因29个。
2.4.2 DEGs功能富集分析
为了进一步了解藏母羊乳腺组织中DEGs的功能,利用GO数据库对筛选出的DEGs进行富集分类,可分为生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组分(cellular component,CC)(图3)。在BP、MF以及CC中,DEGs所富集的GO的条目分别为16、9和4个。在BP组分中,2组间DEGs在细胞进程(cellular process)、单组织进程(single organism process)及代谢进程(metabolic process)上富集到的DEGs数目最多;在MF组分中,DEGs在细胞组分(cell part)中所占的比例最高,其次为细胞(cell)和细胞器(organelle);在CC组分中,DEGs在结合(binding)中所占比例最大。
2.5 KEGG通路注释
通过对乳腺DEGs进行KEGG通路分析,共获得30条差异信号通路,最显著的前5个信号通路依次为Rap1信号通路(Rap1 signaling pathway)、烟酸和烟酰胺代谢(nicotinate and nicotinamide metabolism)、果糖和甘露糖代谢(fructose and mannose metabolism)、矿物质吸收(mineral absorption)、磷脂酰肌醇-3-激酶-丝/苏氨酸蛋白激酶信号通路(PI3K-Akt signaling pathway);此外,还发现黑素原生成(melanogenesis)、鞘脂类信号通路(sphingolipid signaling pathway)、雌激素信号通路(estrogen signaling pathway)以及脂肪细胞内脂解的调节(regulation of lipolysis in adipocyte)等与泌乳量及乳品质紧密关联的差异信号通路。
2.6 RT- qPCR验证
为了验证RNA-seq测序结果的可靠性,从DEGs中选取了IGF1、SRC、CCND1、COL6A5以及STAT3基因进行RT-qPCR验证,并与其测序结果进行对比。从图4可知,所选择的5个基因在2种方法中表达趋势一致,说明本次试验RNA-seq测序结果较为可靠。

图2 DEGs火山图

图3 DEGs的GO分析
3 讨 论
3.1 藏母羊妊娠后期饲粮蛋白质水平对羔羊生长性能的影响
青藏高原地区气候严寒,枯草期长达7个月以上,牧草匮乏,营养价值偏低,粗蛋白质含量不足5%,造成羊只的营养需要得不到满足,生长发育受阻,严重时出现掉膘,甚至发生死亡[11]。加上妊娠母羊因供养与带羔哺乳体能和营养消耗极大,若不能得到及时补充,羔羊的生长发育会因母体体况不佳、营养不良等出现流产或死胎现象,不利于实际生产。此外,初生羔羊由于消化器官尚未发育完全,若饲粮管理稍有疏忽,不仅会影响今后的发育潜力,还会增加死亡率,给牧场造成巨大的经济损失。因此,在高寒牧区实施精粗饲养对于维持妊娠后期藏母羊自身以及子代羔羊发育至关重要。Griffiths等[12]认为,母羊妊娠期的体况与其胎儿初生重和生长性能直接相关,在妊娠期体重增加较好的母羊能更好地哺育胎儿,从而促进生长发育。这说明妊娠期母羊的生长发育与其子代羔羊关系紧密。以北川白山羊为研究对象,结果显示14%蛋白质组平均日增重显著低于16%蛋白质组[13]。此外,雷耀庚等[14]指出,饲粮蛋白质水平与平均日增重和养分消化率有关。基于上述人员的研究结论可以看出,反刍动物的生长发育受饲粮蛋白质水平的影响较大,这与本试验结果基本一致。在本试验中,LP组羔羊的平均日增重显著低于HP组。分析原因可能是11.5%蛋白质水平饲粮能够提供更多易于消化吸收的碳水化合物、蛋白质、矿物质和维生素等营养物质,有助于母羊瘤胃微生物繁殖和促进微生物蛋白合成,进而影响新生羔羊发育[15]。

IGF1:胰岛素样生长因子1 insulin-like growth factor 1;CCND1:细胞周期蛋白1 cyclin D1;STAT3:信号转导和转录激活因子3 signal transduction and transcriptional activation factor 3;SRC:蛋白络氨酸激酶 sarcoma;COL6A5:Ⅵ型胶原蛋白A5 type Ⅳ collagen A5。
3.2 妊娠后期饲粮蛋白质水平对藏母羊泌乳性能的影响
泌乳性能是衡量奶畜生产性能的主要指标,其中产奶量是奶畜产生经济效益的重要保障。乳中营养成分可为胎儿提供生长发育所需的各种营养素,如蛋白质、脂肪、维生素以及矿物质等[16]。因此,泌乳期母羊的产奶量和乳成分对羔羊的生长发育十分重要。泌乳性能主要与饲粮营养水平的调整有关,饲粮蛋白质水平通过改变反刍动物瘤胃中挥发性脂肪酸的比例,进而影响母畜的泌乳性能与健康状况。蛋白质水平对崂山奶山羊采食量无显著影响,但对产奶量、料奶比及乳成分有不同程度的影响[17]。饲粮蛋白质水平从16%提高至19%后,能够显著提高荷斯坦奶牛的干物质摄入量、产奶量以及乳糖含量[18]。研究表明,精粗比为65∶35组关中奶山羊的产奶量极显著高于精粗比为35∶65组,同时乳中乳糖和乳蛋白的比例随着泌乳时间的增加而显著升高[19]。当饲粮蛋白质水平由16%提高到18%时,却对西农萨能羊的泌乳性能和乳品质无任何影响[20]。在奶山羊上亦证实不同能量或蛋白质水平饲粮对奶山羊乳脂率的影响不显著[21]。但也有试验所得结论[22]与上述研究相反。这可能是由于试验动物、饲养管理以及饲粮蛋白质水平梯度不同所致。此外,为了进一步了解饲粮营养水平与藏羊泌乳性能的关系,本试验测定了2组藏母羊的产奶量及乳成分,结果显示,HP组藏母羊的产奶量、乳糖率、乳脂率以及乳蛋白率均显著高于LP组。这提示妊娠后期饲粮蛋白质水平由7.5%提高到11.5%时,可以显著提高藏母羊的产奶量,并有效改善乳品质。
3.3 妊娠后期饲粮蛋白质水平对藏母羊乳腺转录组学的影响
乳腺作为哺乳动物特有的器官,其主要功能是泌乳,不仅在繁育后代过程中发挥着关键作用,而且对于人类健康具有重要意义[23]。乳腺的发育主要受到遗传、环境以及激素等因素的影响[24-25],饲粮营养水平对乳腺的发育也起着关键作用[26]。Gómez-Martínez等[27]给泌乳期奶牛饲喂不同能量水平(分别为净能需求量的85%、100%及115%)的饲粮,结果显示饲粮能量水平可显著影响乳腺相关基因的表达,并且DEGs主要富集于免疫通路上,一定程度上能够决定乳房炎的发生。当荷斯坦奶牛每天摄入700 g的葵花油(不饱和脂肪酸),可显著上调乳腺与乳蛋白合成紧密相关基因的表达,如胰蛋白酶原2(PRSS2)、卵黄状黄斑病蛋白3(BEST3)等[28]。当饲粮中亚麻籽含量达到20%时,绵羊乳腺组织中参与脂质和蛋白质合成的基因的表达显著受到抑制,导致乳中乳蛋白、乳脂以及乳糖含量下降[29]。本研究对乳腺组织中DEGs进行GO分类以及KEGG分析,发现多条与能量和脂质代谢紧密相关的差异信号通路,如烟酸和烟酰胺代谢、果糖和甘露糖代谢、鞘脂类信号通路、雌激素信号通路以及脂肪细胞内脂解的调节。这说明饲粮蛋白质水平对动物乳腺的生理和代谢具有一定的影响。另外,本试验挑选出5个与乳腺组织生长发育相关的DEGs进行了RT-qPCR验证,并与其测序结果一致,这表明RNA-seq测序结果可靠。在本试验中,与高蛋白质水平饲粮相比,低蛋白质水平饲粮显著降低了IGF1和SRC的相对表达量,并增加了CCND1、COL6A5和STAT3的相对表达量。
IGF1能够介导生长激素,从而启动JAK-STAT信号通路,调节泌乳性能。同时,IGF1可促进机体对葡萄糖的摄取,调节糖原异生与糖酵解,促进蛋白质和脂肪合成[30]。其他试验也发现,相较于中蛋白质水平饲粮与低蛋白质水平饲粮,高蛋白质水平饲粮能显著提高IGF1基因表达[31]。而本试验得出,LP组藏母羊能够显著降低IGF1的相对表达量。这表明低蛋白质水平饲粮导致母羊产奶量下降可能与IGF1表达下降有关。低蛋白质水平饲粮除了降低母畜的泌乳性能,同时还会影响细胞和体液免疫,使母畜容易发生乳房炎、乳腺癌等疾病。CCND1是调控细胞周期的关键蛋白,现已被证实为原癌基因,其过度表达或错误调控均可导致细胞的恶性转化[32]。而STAT3主要负责调控细胞生长、增殖、分化及凋亡,对细胞的生长发育起着重要作用[33]。本试验发现,LP组母藏羊CCND1和STAT3的相对表达量显著升高,这暗示在低蛋白质水平饲粮条件下妊娠期藏母羊易发生疾病,同时影响机体健康。SRC是一类由许多细胞外信号分子激活的非受体蛋白酪氨酸激酶。敲除雌性小鼠中SRC基因能够导致泌乳失败以及乳腺的提前退化[34]。有人指出,SRC基因可能调节β-酪蛋白基因的表达,可能与泌乳性状直接相关[35]。本试验中LP组藏母羊的产奶量减少可能也与SRC表达下降有关。COL6A5是胶原蛋白家族成员之一,目前关于COL6A5参与脂代谢的报道很少。COL6A5表达抑制可缓解双氢睾酮引起的脂肪过度积累和细胞肥大,且对应着相应的分子活动异常的改善[36]。从本试验结果来看,低蛋白质水平饲粮显著提高藏母羊乳腺组织中COL6A5基因的表达,这提示低蛋白质水平饲粮对藏母羊乳腺组织发育同样不利。
4 结 论
① 在本试验条件下,提高藏母羊妊娠后期饲粮蛋白质水平可增强羔羊的平均日增重与藏母羊的产奶量,并有效促进乳中糖、脂肪以及蛋白质的合成。
② 通过RNA-seq技术在藏母羊乳腺组织中鉴定出了40个DEGs,主要富集于鞘脂类信号通路、雌激素信号通路以及脂肪细胞内脂解调节,部分DEGs与能量和糖、脂代谢密切相关。
③ 综上可知,适当提高藏母羊妊娠后期饲粮蛋白质水平,可通过改变乳腺组织中的相关基因表达,提高藏母羊的泌乳性能及乳品质,进而提高羔羊的平均日增重。
