织锦巴非蛤幼虫对不同种类单胞藻的摄食和消化效果
2022-08-09邓正华翟子钦魏海军陈明强李有宁黄星美张钰伟
邓正华,翟子钦,魏海军,赵 旺,陈明强,李有宁,黄星美,张钰伟,5,王 雨*
(1中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室,广东广州 510300;2三亚热带水产研究院,海南三亚 572018;3中国水产科学研究院南海水产研究所热带水产研究开发中心,海南三亚 572018;4北海金不换水产有限公司,广西北海 536007;5天津农学院水产学院,天津 300384)
0 引言
【研究意义】织锦巴非蛤(Paphia textzle)俗称花甲王,是自然分布于我国南海潮下带泥沙质海底的一种埋栖型双壳经济贝类,其在北部湾自然海域也有一定的分布(杨文等,2013;陈瑞芳等,2020)。织锦巴非蛤壳表面呈黄棕色,布满浅褐色波纹,与波纹巴非蛤(P.undulata)在外形上极为相似。但织锦巴非蛤成贝壳长达7 cm,湿重在30 g以上,其味道鲜美,经济价值较高,市场价格常年维持在80~100元/kg。近年来,随着海洋捕捞技术与装备的不断进步、渔船马力的快速增加、捕捞队伍的迅速扩大及捕捞作业监控不力,海洋生物繁殖栖息地受破坏程度越来越严重(Deng et al.,2021a,2021b),致使织锦巴非蛤的自然资源量逐年锐减。因此,开展织锦巴非蛤苗种人工规模化繁育和增养殖,对补充其自然种群资源及丰富人民日益增长的海产品需求具有重要意义。【前人研究进展】织锦巴非蛤作为我国南海海水养殖新型品种,苗种规模化人工繁育是决定其能否实现大规模人工养殖的关键(邓正华等,2016)。其中,单胞藻作为双壳贝类幼虫培育的重要饵料,是影响其生长速率和存活率的主要因素之一(Mar‐shall et al.,2010;Cheng et al.,2020)。已有大量研究证实,优化单胞藻投喂种类和浓度(Pettersen et al.,2010;Yang et al.,2021),分析单胞藻营养价值(Martínez-Fernández,2006;Chen et al.,2015;Liu et al.,2016),调节幼虫培育密度(Doroudi and South‐gate,2000;Mazón-Suástegui et al.,2008;Ramos et al.,2021),满足幼虫营养需求(Martínez-Fernández and Southgate,2007;Aranda-Burgos et al.,2014)等方式均有利于提高幼虫培育生长速率及其存活率。单胞藻被作为滤食性双壳贝类的主要饵料,也是无脊椎动物苗种培育的重要食物来源(Pettersen et al.,2010;Shi et al.,2013)。Duy等(2015)认为影响双壳贝类幼虫生长和存活的因素不仅与投喂单胞藻饵料的营养价值有关,还与幼虫对该饵料的消化效率和同化效率有关,究其原因可能是并非所有单胞藻种类都能被幼虫摄食和消化(Quang et al.,2015)。Lo‐ra-Vilchis和Maeda-Martinez(1997)曾研究报道,扇贝(Argopecten ventricosus)幼虫饲喂的10种单胞藻中仅有7种能被摄食,其中5种能被消化;而在燕鸥珍珠母贝(Pteria sterna)幼虫饲喂的10种单胞藻中,仅有3种能被摄食,其中2种能被消化(Martínez-Fernández et al.,2004)。因此,在幼虫培育过程中选择单胞藻饵料时首先要明确投喂的单细胞种类是否能被幼虫摄食和消化(Marshall et al.,2010)。【本研究切入点】单胞藻能否作为海水双壳贝类幼虫培育的饵料来源应当满足以下条件:(1)合适的粒径大小和形态以确保能被摄食;(2)易于消化;(3)满足幼虫生长发育的营养需求;(4)无毒;(5)适宜人工大规模培养(Fernández-Reiriz et al.,2015)。小球藻(Chlo‐rella vulgaris)、微绿球藻(Nannochloropsis oculata)、杜氏盐藻(Dunaliella salina)、亚心形扁藻(Platymo‐nas subcordiformis)、绿色巴夫藻(Pavlova viridis)、湛江等鞭金藻(Dicrateria zhanjianggensis)、球等鞭金藻(Isochrysis galbana)、牟氏角毛藻(Chaetoceros muelleri)和三角褐指藻(Phaeodactylum tricornu‐tum)是我国沿海滤食性贝类人工苗种繁育常用的单胞藻饵料,但目前有关织锦巴非蛤幼虫在不同时期饲喂何种单胞藻饵料尚未明确。【拟解决的关键问题】在织锦巴非蛤幼虫培育期分别饲喂不同种类的单胞藻,观察幼虫对单胞藻摄食情况和消化效果,以期为织锦巴非蛤的苗种规模化人工繁育提供饵料投喂策略及参考依据。
1 材料与方法
1.1 试验材料
以2021年1月22日从广西北海市铁山港区自然海域捕捞的织锦巴非蛤2龄贝为亲本(n=30),亲贝壳长68.87±5.82 mm、壳高36.43±4.78 mm、壳宽21.45±3.88 mm、湿重30.33±4.28 g。供试的9种单胞藻(小球藻、微绿球藻、杜氏盐藻、亚心形扁藻、绿色巴夫藻、湛江等鞭金藻、球等鞭金藻、牟氏角毛藻和三角褐指藻)由农业农村部南海渔业资源开发利用重点实验室保存提供,其形态特征及粒径大小描述见表1和图1。
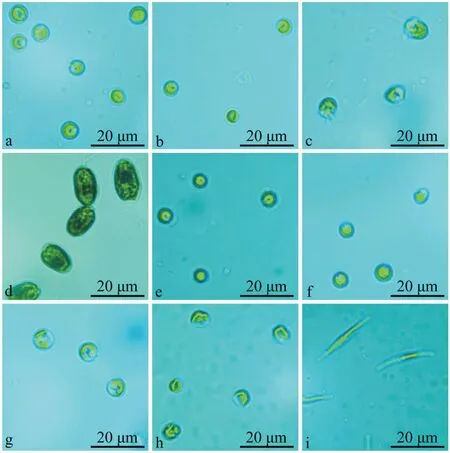
图1 9种单胞藻的形态特征Fig.1 Morphological characteristics of nine species of microalgae
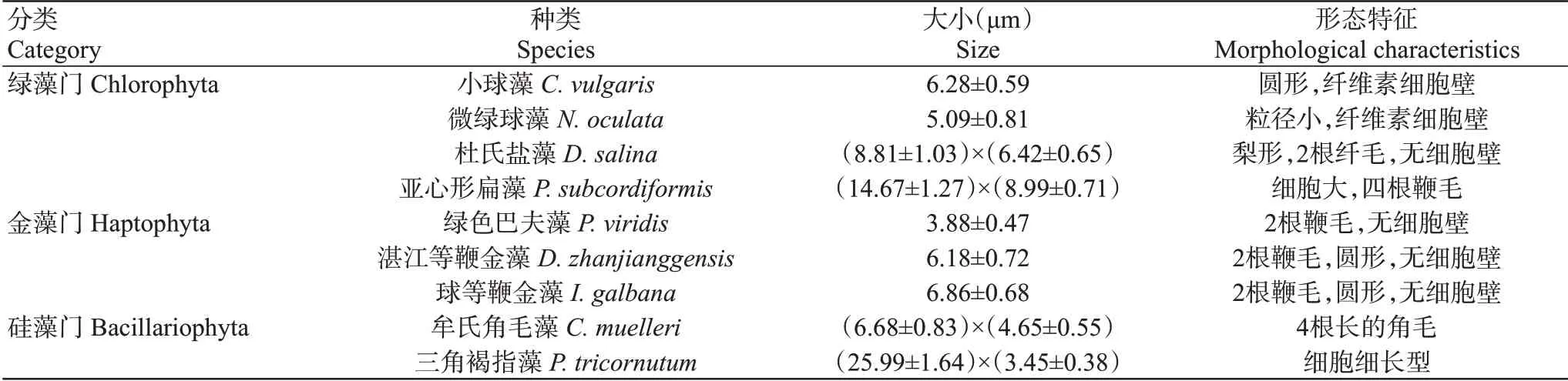
表1 9种单胞藻的生物学特征Table 1 Biological characteristics of nine species of microalgae
1.2 单胞藻培养与幼虫培育
9种单胞藻均采用5000 mL锥形瓶在室温28 ℃和光照5000 lx(12 h黑暗:12 h光照)条件下进行保种,藻种瓶每天摇晃2次,每7~10 d重新接种1次。在500 L圆形玻璃钢纤维桶中添加F/2营养盐,于自然光照条件下大规模培养单胞藻,确保单胞藻在使用时处于快速生长期且密度>106个/mL(亚心形扁藻>105个/mL)。
织锦巴非蛤亲贝从海区运回后,用塑料筐装好悬挂于20 m3的水泥池中进行营养强化,期间每天投喂亚心形扁藻和牟氏角毛藻混合藻,饵料投喂密度为1×104~2×104个/mL,亲贝每天投喂2次,每天换水50%。经过1周左右的室内暂养,将亲贝冲洗干净,置于阴凉处阴干刺激3 h,然后置于塑料筐中悬挂在水泥池中进行流水刺激,促使其排卵/排精。观察水中卵细胞和精子数量,当卵细胞数量达10个/mL时,及时将亲贝移出并停气30 min使卵细胞下沉,采用虹吸法吸取上层水排出多余精子,如此往复多次,洗去多余的精子。受精卵在水泥池孵化24 h,发育至D形幼虫后停气使其上浮,以虹吸法将上层幼虫吸出,经350目筛绢网收集,然后将幼虫转移至过滤的清海水池中培养,培养密度5个/mL。幼虫培育期间每天换水1次,换水量从前期30%增至60%,幼虫每天投喂2次,在1~9 dph(孵化后天数,days post hatch)期间投喂湛江等鞭金藻,超过9 dph后投喂亚心形扁藻,饵料投喂量根据幼虫摄食情况进行相应调整。幼虫培育期间水温(22.45±0.87)℃,盐度30‰,pH 8.24。
1.3 幼虫发育观察
幼虫培育期间,每天从培育池中取一部分幼虫(n>30)在显微镜下观察幼虫的运动和摄食状态,并在显微镜下连接Toup Cam XCAM1080PHD摄像头进行拍照,使用Toup View3.7测量幼虫大小。
1.4 幼虫对单胞藻的摄食与消化
幼虫孵化后,每隔3 d从培育池中取一部分幼虫置于过滤清海水中饥饿处理12 h,以确保幼虫胃内消化完全。然后将幼虫按10个/mL的密度置于9个1000 mL烧杯中,每个烧杯分别加入9种单胞藻使藻类浓度达104个/mL。幼虫在烧杯中摄食1 h后,从各烧杯中取一部分幼虫置于0.1 mL浮游植物计数框(2 cm×2 cm×250 μm)中,盖上盖玻片,在Phenix BMC536-ICCF光学显微镜下观察幼虫对单胞藻摄食情况。将已摄食单胞藻的幼虫用350目筛绢网过滤,经过滤清海水清洗后按5个/mL的密度置于过滤清海水中,分别在2、4、6和8 h后采用光学显微镜观察幼虫(n>30)对单胞藻的消化情况,参照Deng等(2021a,2021b)的研究结果,详细描述幼虫在饥饿、摄食、消化和空胃下的状态(表2)。

表2 幼虫对单胞藻的摄食与消化状态Table 2 Stages of larvae during ingesting and digesting microalgae
1.5 图像处理
采用Adobe Photoshop CS5对图像进行处理,以Tracker跟踪幼虫运动并形成运动轨迹。
2 结果与分析
2.1 织锦巴非蛤幼虫发育及其形态变化特征
织锦巴非蛤在水体整个发育过程中的幼虫形态特征及大小变化如图2所示。其中,初孵幼虫(D形幼虫)大小(壳长×壳高)为(82.49±3.02)μm×(63.98±2.16)μm,于4 dph发育至壳顶前期(115.89±3.86)μm×(101.62±3.80)μm,13 dph 进入变态期(205.61±15.84)μm×(182.61±13.53)μm,于15 dph变态至稚贝(225.63±8.99)μm×(198.65±8.25)μm。
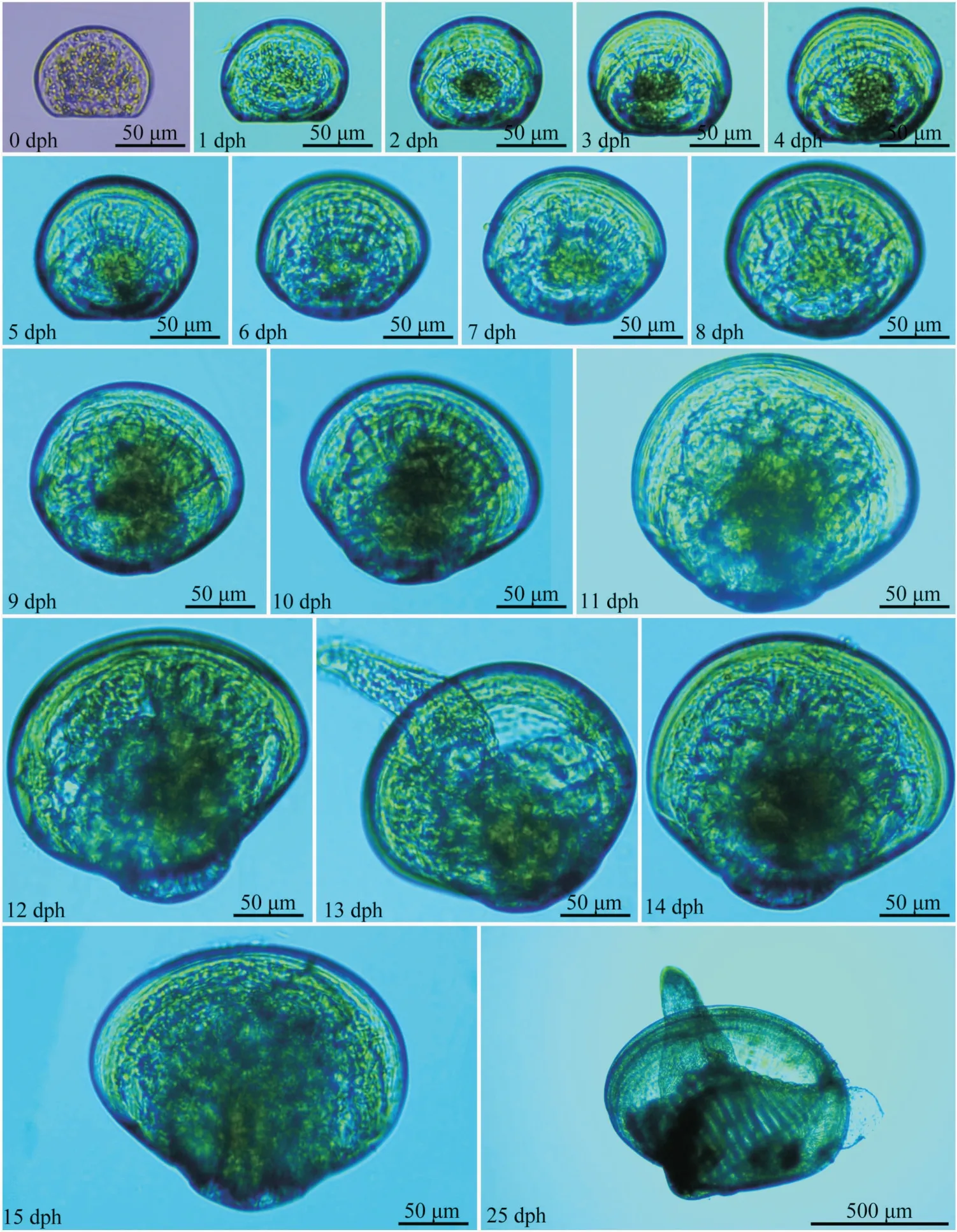
图2 织锦巴非蛤幼虫发育及其形态特征Fig.2 Developmental and morphological characteristics of P.textzle larvae
2.2 织锦巴非蛤幼虫运动与摄食观察结果
织锦巴非蛤幼虫在附着变态前于水中呈浮游状态,幼虫在水中正常运动时显微镜下的俯视观察如图3-A所示,幼虫侧面如图3-B所示,幼虫在水中的运动轨迹如图3-C所示。织锦巴非蛤幼虫在水中正常运动时,双壳张开,面盘伸出壳外靠近壳的后端且与水平轴呈一定角度。织锦巴非蛤幼虫通过面盘外周纤毛有规律地摆动,从而维持自身的运动和悬浮,大部分幼虫在水平方向沿顺时针方向运动。织锦巴非蛤幼虫在运动过程中也伴随着摄食,通过纤毛的摆动形成水流,单胞藻则随着水流方向进入幼虫口沟,在口沟纤毛摆动下进入胃内,胃内的单胞藻在微绒毛摆动下快速旋转并消化,消化的单胞藻则通过胃内微绒毛运动和胃自身收缩下排入肠道,再从肛门排出体外,从而完成幼虫对单胞藻的摄食、消化和排泄过程。
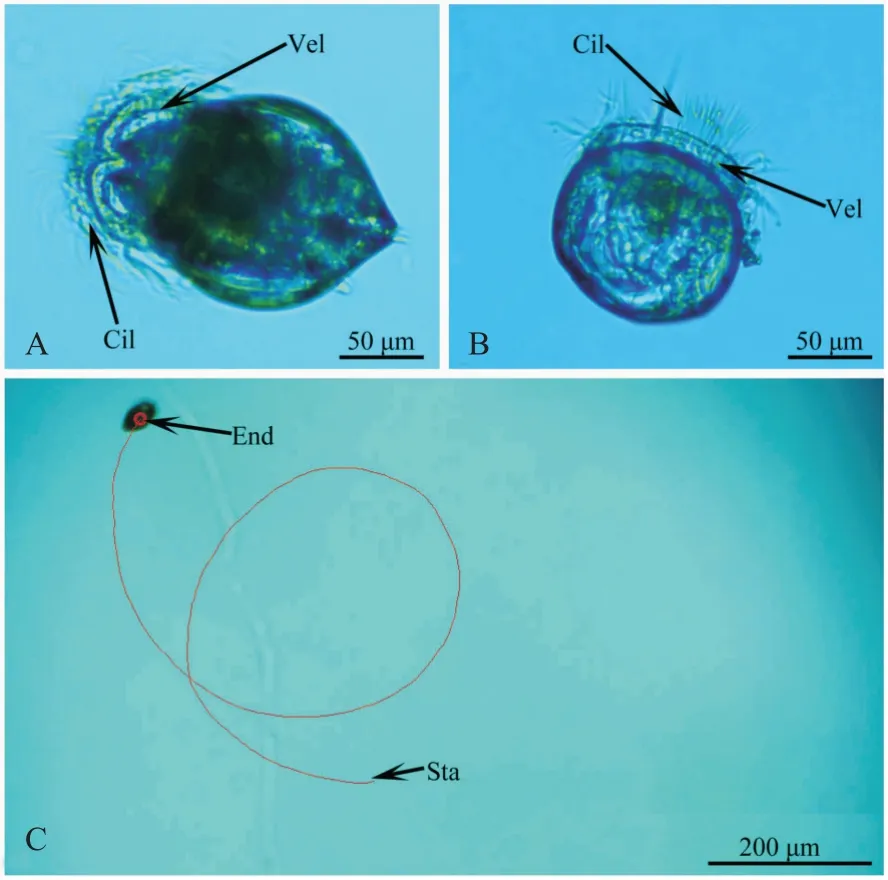
图3 织锦巴非蛤幼虫的运动状态及其运动轨迹Fig.3 Movement and movement trajectory of P.textzle larvae
2.3 织锦巴非蛤幼虫对不同种类单胞藻的摄食与消化情况
织锦巴非蛤幼虫饥饿、摄食、消化和空胃状态如图4所示。幼虫在过滤清海水中饥饿处理12 h后,其胃内处于空虚状态,消化盲囊无颜色(图4-A);当幼虫在水中摄食1 h后,其胃内可见形态完整的单胞藻(图4-B);而幼虫在过滤清海水中停置一段时间后,单胞藻在幼虫胃内消化呈糜状(图4-C);当幼虫对单胞藻完全消化后,幼虫胃内又处于空虚状态,消化盲囊因吸收单胞藻营养其颜色与消化的单胞藻颜色相同(图4-D)。
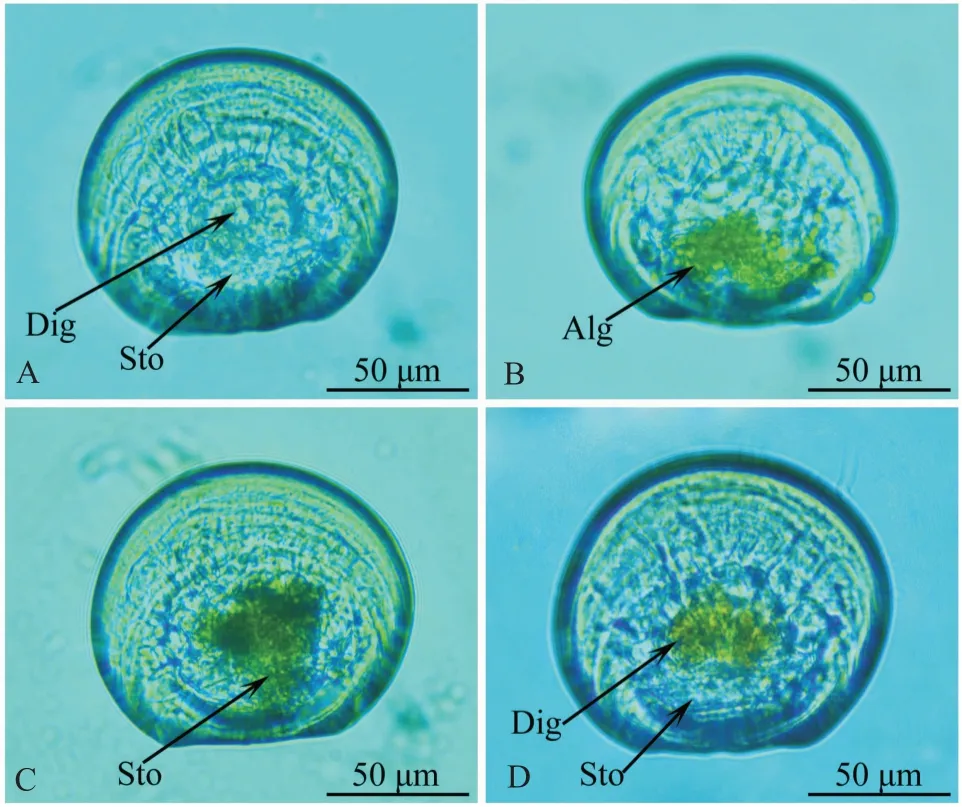
图4 织锦巴非蛤幼虫饥饿、摄食、消化和空胃状态Fig.4 Starvation,ingestion,digestion and empty stomach of P.textzle larvae
通过考察织锦巴非蛤幼虫在不同日龄对9种单胞藻的摄食情况与消化效果,结果(表3)发现幼虫在1 dph时能摄食小球藻、微绿球藻、绿色巴夫藻、湛江等鞭金藻和球等鞭金藻,在4 dph时有少量幼虫开始摄食杜氏盐藻,至10 dph时幼虫开始摄食亚心形扁藻和牟氏角毛藻,整个浮游幼虫期均不摄食三角褐指藻。织锦巴非蛤幼虫对小球藻和微绿球藻的消化较对其他种类单胞藻的消化更难。
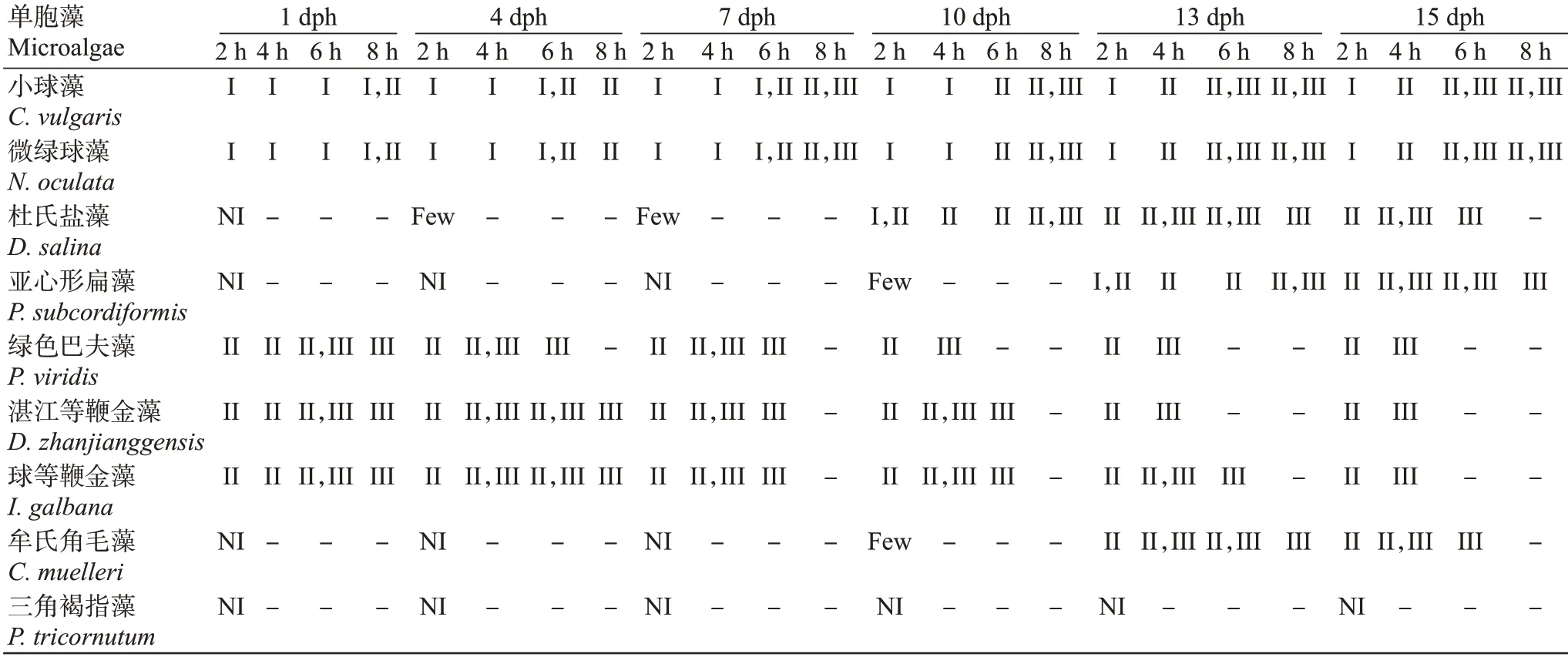
表3 不同日龄幼虫对9种单胞藻的摄食与消化Table 3 Ingestion and digestion of nine microalgae species by larvae at different larval age
3 讨论
织锦巴非蛤是一种小型的埋栖型双壳经济贝类,其初孵幼虫规格为(82.49±3.02)μm×(63.98±2.16)μm,较大多数附着型和固着型双壳贝类初孵幼虫大,如福建牡蛎(Crassostrea angulata)(Qiu et al.,2015)、企鹅珍珠贝(P.penguin)(Southgate et al.,2016)、珠母贝(Pinctada margaritifera)(邓正华等,2018)及合浦珠母贝(P.fucata)(邓正华等,2019);但比其他埋栖型双壳贝类初孵幼虫小,如黄边糙鸟蛤(Trachycardium flavum)(邓正华等,2016)、象拔蚌(Panopea zelandical)(Le et al.,2017)、靓巴非蛤(P.schnelliana)(Deng et al.,2021a)及对角蛤(Antigona lamellaris)(Deng et al.,2021a;Chen et al.,2021)。一般认为,初孵幼虫的大小与其浮游期的长短成反比(邓正华等,2016,2018)。幼虫浮游期也是苗种培育过程中极不稳定的时期,因此,浮游期缩短有利于提高苗种培育成功率,相对于浮游期长的种类能降低随机事件造成的死亡风险(邓正华等,2019)。织锦巴非蛤幼虫在水中正常运动时,双壳张开,面盘伸出壳外且靠近壳的后端,面盘斜向上与水平方向约呈45°的夹角,纤毛不断摆动使面盘产生斜向上的牵引力。类似于珠母贝幼虫(邓正华等,2018)的运动方式,斜向上的牵引力又分解为水平方向和垂直方向的牵引力,水平方向牵引着幼虫在水平方向的运动,垂直方向则促使幼虫在水中维持悬浮或下降的状态。俯视观察发现,织锦巴非蛤幼虫水平方向沿顺时针方运动,与珠母贝幼虫(邓正华等,2018)、合浦珠母贝幼虫(邓正华等,2019)、靓巴非蛤幼虫(Deng et al.,2021a)及对角蛤幼虫(Deng et al.,2021b)在水中观察到的运动方式相同。据Blake和Ottl(1996)对牡蛎幼虫纤毛摆动观察,发现其与钟形虫(Vorticella)摆动规律类似,纤毛周期性按统一方向摆动,因此在带动面盘产生牵引力的同时产生一定方向旋转,从而使幼虫在水体中沿着一定的方向螺旋运动。螺旋运动是一种较特殊的运动行为,在原生动物和软体动物的面盘幼虫期较常见。浮游幼虫螺旋运动的特点是沿着螺旋状的路径游动,被认为是由于身体形状不对称或鞭毛和纤毛等运动结构的运动所造成,许多双壳贝类幼虫还可通过改变纤毛摆动频率和面盘的角度而改变螺旋运动轨迹以应对环境变化。Le等(2017)研究认为,幼虫在纤毛摆动的同时形成水流,单胞藻随着水流方向被运送到幼虫口沟处,部分单胞藻在口沟纤毛摆动下被捕获,从而经幼虫口沟进入胃内,摄食方式效率较低。相比于幼虫的摄食方式,变态后的稚贝则依靠鳃进行滤食,极大提高了摄食效率。因此,较短的浮游幼虫期更有利于提高其苗种培育成功率。
本研究结果显示,织锦巴非蛤幼虫在1 dph时能摄食小球藻、微绿球藻、绿色巴夫藻、湛江等鞭金藻和球等鞭金藻,在4 dph时有少量幼虫开始摄食杜氏盐藻,至10 dph时幼虫开始摄食亚心形扁藻和牟氏角毛藻,整个浮游幼虫期均不摄食三角褐指藻。从单胞藻形态与粒径大小分析可知,幼虫更易摄食形状呈圆形且粒径较小的单胞藻,随着幼虫的生长逐渐摄食粒径更大的单胞藻,与其他无脊椎动物幼虫摄食情况(Doroudi et al.,2003;Deng et al.,2021a,2021b)一致。双壳贝类幼虫一般是通过面盘外周纤毛的摆动从而维持自身运动和形成相对水流,单胞藻随着水流的方向进入幼虫口沟,单胞藻再经过幼虫口沟进入胃内,从而完成整个摄食过程(邓正华等,2016)。因此,单胞藻形状呈球形且粒径较小的个体更易进入到幼虫口沟而被摄食。牟氏角毛藻由于耐高温、生长繁殖快、易于大规模培养及富含不饱和脂肪酸等特点,已广泛应用于热带和亚热带地区无脊椎水生动物苗种繁育(Reitan,2011;Carboni et al.,2012;Scholtz et al.,2013),且作为棘皮动物和双壳贝类幼虫繁育的主要或搭配饵料(Doroudi et al.,2003;Knauer,2011;Kaspar et al.,2014)。牟氏角毛藻虽细胞粒径大小只有6.68 μm×4.65 μm,但4个角分别着生有长度大于20 μm的硬质角毛,易阻碍幼虫摄食,因此不适宜作为幼虫开口饵料(Deng et al.,2021a,2021b)。三角褐指藻在我国北方常用于双壳贝类亲贝催熟育肥的饵料,由于其形态特征呈长条形,长度约25 μm,导致幼虫难以摄食,因此不适宜作为幼虫培育期的饵料。此外,在织锦巴非蛤幼虫能摄食的单胞藻饵料中,小球藻和微绿球藻较其他种类更难消化,在其他贝类中也得出相同的结论(Doroudi et al.,2003;Deng et al.,2021a,2021b)。小球藻和微绿球藻皆隶属于绿藻门,其细胞外表有一层纤维素细胞壁(邓正华等,2016),因此相对于无细胞壁种类更难消化。
4 结论
在织锦巴非蛤幼虫培育过程中,幼虫开口饵料宜选择湛江等鞭金藻、球等鞭金藻和绿色巴夫藻,在10 dph时适宜投喂杜氏盐藻,至13 dph时可投喂牟氏角毛藻藻和亚心形扁藻;在其他易被摄食和消化单胞藻种类充足的情况下,一般不选取小球藻和微绿球藻作为幼虫培育的首选饵料。
