饲料中添加β-葡聚糖对珍珠龙胆石斑鱼生长性能、免疫指标、转录组及肠道菌群的影响
2022-08-09代冰涛王红明宋守钢谭北平
陈 俭,代冰涛,王红明,宋守钢,谭北平,2,章 双,2*
(1广东海洋大学水产动物营养与饲料实验室,广东湛江 524088;2农业农村部华南水产与畜禽饲料重点实验室,广东湛江 524088)
0 引言
【研究意义】珍珠龙胆石斑鱼(Epinephelu fus‐coguttatus♀×Epinephelus lanceolatus♂)是以褐点石斑(E.fuscoguttatus)为母本、鞍带石斑鱼(E.lanceo‐latus)为父本杂交培育获得(Koh et al.,2008;王丽娜等,2017),也称为龙虎斑,是一种生性凶猛的肉食性鱼类,隶属于鲈形目(Perciformes)鲈亚目(Percoidei)鮨科(Serranidae)。因其肉质细嫩、营养丰富而深受消费者喜爱,且生长速度快,市场价值高。近年来,随着养殖规模的不断扩大,集约化、规模化养殖致使其养殖环境恶化,进而导致病害频发,严重制约了石斑鱼养殖业的健康发展(罗鸣等,2013)。免疫增强剂是指通过提高机体非特异性免疫功能以增强对外界应激和病原感染抵抗能力的物质,具有安全性、广泛性及稳定性等特点,能有效解决传统化学药物防治引起的耐药性、药物残留及水体污染等问题(An‐derson,1992)。因此,在饲料中添加免疫增强剂替代化学药物是鱼虾类等水产动物疾病防控的新方向。【前人研究进展】多糖作为一种免疫增强剂在水产养殖中已有较多研究报道(韩梦瑶等,2021),其中又以β-葡聚糖在水产养殖业中的应用最广泛,主要用于改善生长性能和增强免疫力,以及提高机体抗氧化能力、促进消化和优化肠道菌群结构等(许冰莹和邵庆均,2019)。Bahmani等(2000)以不同水平的β-葡萄糖喂养波斯鲟鱼(Acipenser persicus),结果发现其生长性能显著提高。Ji等(2017)研究表明,β-葡聚糖不仅能明显提高虹鳟鱼(Oncorhynchus mykiss)特异性生长速率、体重增加和饲料效率,还能使其在应对杀鲑气单胞菌感染时的存活率显著增加。Reyes-Becerril等(2018)对太平洋红鲷鱼(Lutjanus peru)的外周血白细胞进行体外测定,发现β-葡聚糖组能显著增加鱼体的非特异性免疫应答,在受到细菌感染后体内的过氧化物酶活性显著增强。Li等(2019)研究表明,在饲料中添加β-葡聚糖不仅可改善凡纳滨对虾(Litopenaeus vannamei)的消化酶活性、抗氧化能力和免疫能力,还能大量增加芽孢杆菌等益生菌,优化肠道中定殖微生物群结构。Nguyen等(2019)研究发现,在鲤鱼(Cyprinus carpio)养殖过程中以植物油形式在基础饲料中添加β-葡聚糖能抑制体内的一些炎症反应,且对其免疫调节无显著负面影响。β-葡聚糖在石斑鱼产业也有广泛应用,不仅可降低石斑鱼在运输过程中带来的损伤(Wu et al.,2020),还可作为珍珠龙胆石斑鱼哈维氏弧菌疫苗的免疫佐剂(Wei et al.,2020),也可减轻土霉素对珍珠龙胆石斑鱼造成的不良影响(Lee et al.,2020)。此外,张海艳等(2018)采用转录组测序分析腹腔注射β-葡聚糖对斜带石斑鱼的影响,结果发现β-葡聚糖可引起鱼体免疫相关基因差异表达,进一步证实β-葡聚糖可作为新型渔业免疫增强剂。【本研究切入点】目前,β-葡聚糖作为饲料添加剂在石斑鱼上的研究主要集中在生长性能及免疫相关生化指标等方面(Chang et al.,2013;Lee et al.,2020),而鲜见从转录组水平分析差异表达免疫基因和肠道优势菌群的研究报道,特别是以β-葡聚糖作为免疫增强剂对珍珠龙胆石斑鱼免疫途径的分子机制及作用通路尚未明确。【拟解决的关键问题】以珍珠龙胆石斑鱼为研究对象,通过在饲料中添加β-葡聚糖进行养殖试验,考察β-葡聚糖对珍珠龙胆石斑鱼生长性能和免疫指标的影响,并进行高通量测序及肠道菌群结构分析,旨在明确β-葡聚糖诱导珍珠龙胆石斑鱼的免疫响应机制,为β-葡聚糖作为免疫增强剂在水产饲料中的应用提供理论依据。
1 材料与方法
1.1 饲料配方
β-葡聚糖来源于酿酒酵母,购自青岛玛斯特生物技术有限公司。基础饲料配方如表1所示,其粗蛋白含量为50.18%、粗脂肪含量为11.63%。以基础饲料组为对照组,参考吴春玉等(2013)、李永娟等(2015)的研究结果,在基础饲料中添加100 mg/kg β-葡聚糖。饲料原料粉碎后过60目筛,准确称取各饲料原料,将β-葡聚糖按逐级扩大法混合均匀,采用双螺杆挤条机(F-75华南理工大学科技实业总厂)加工成2.0和2.5 mm规格的饲料。饲料制作完成在通风处风干,用自封袋密封,-20 ℃保存备用。
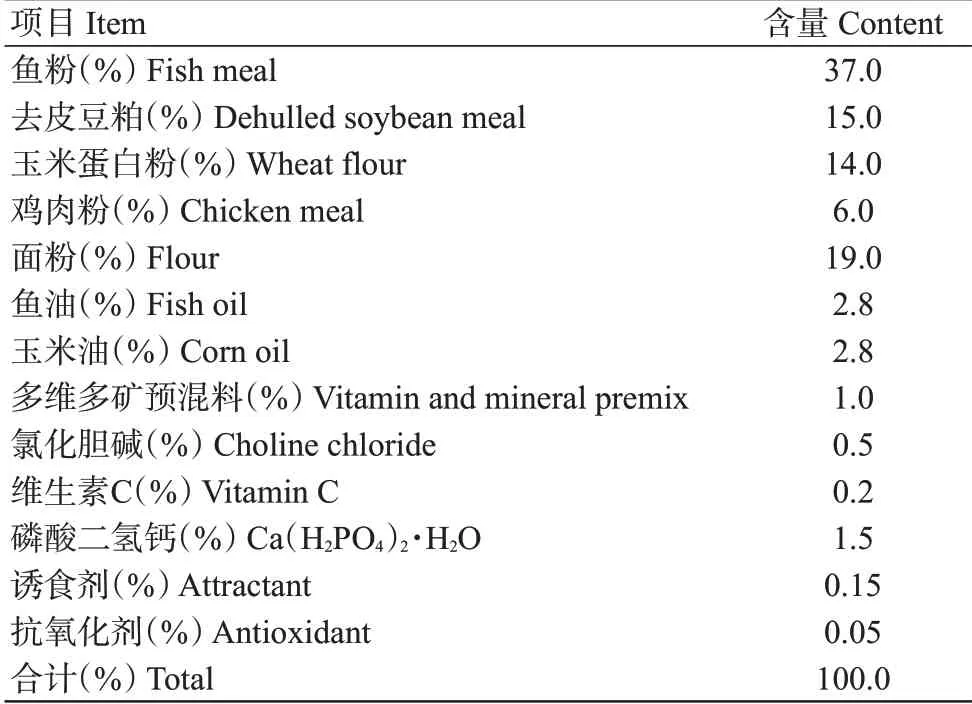
表1 基础饲料组成配方(干物质基础)Table 1 Basic feed composition(dry matter basis)
1.2 试验用鱼及养殖管理
珍珠龙胆石斑鱼苗购自广东省湛江市雷州石斑鱼苗场,购回后暂养于广东海洋大学东海岛生物研究基地室内的海水鱼养殖系统1000 L玻璃钢桶中,期间投喂商品料,驯化1周后随机挑选规格一致、初始平均体重为6.12±0.22 g、健壮无病的珍珠龙胆石斑鱼置于玻璃钢桶(500 L)中进行养殖。试验设2个处理(对照组和β-葡聚糖组),每处理3个重复,每个重复40尾鱼,养殖8周。养殖期间,按鱼体重3%进行表观饱食投喂2次(8:00和17:00),投喂量依据摄食情况和天气变化及时调整。投喂1 h后通过虹吸法清除残饵和粪便,每天换水1次,每次换水量为50%。试验期内养殖车间由自然光照提供光源,水温28~30 ℃,海水盐度为26.5‰~28.0‰,连续充氧,溶解氧含量>6.8 mg/L,pH 7.8~8.2,氨氮含量<0.03 mg/L。记录养殖过程中试验鱼的异常现象。
1.3 样本采集
养殖试验结束,空腹24 h后称取每桶珍珠龙胆石斑鱼总重,记录存活尾数,体重和体长用于生长性能分析。以丁香酚进行麻醉后,通过尾静脉取血法抽取全血,每个重复6尾鱼,每尾鱼抽取1 mL,前3尾全血放入装有抗凝剂的无菌防爆管,经液氮速冻后-80 ℃保存,用于转录组测序;后3尾全血置于离心管中,离心收集上清液,分装后-80 ℃保存,用于血清生化指标测定。采集完血剩下的试验鱼解剖3尾取胃和肠道,剔除内容物及肠系膜,用预冷的生理盐水冲洗干净,置于防爆管中,液氮速冻后-80 ℃保存。取出待测样品在4 ℃下解冻,用剪刀剪成小块,加入10倍体积的预冷生理盐水,高速组织匀浆机冰浴匀浆,匀浆液经2500 r/min离心10 min后取上清液,用于测定消化酶活性。每个重复取4尾珍珠龙胆石斑鱼,用75%酒精擦拭体表,无菌条件下剖取中肠,以无菌生理盐水漂洗后装入无菌防爆管中,液氮速冻后-80 ℃保存,用于肠道微生物测定。同时,对饲料进行常规分析,其中粗蛋白含量测定采用凯氏定氮法,粗脂肪含量测定采用索氏提取法。
1.4 生长性能分析
珍珠龙胆石斑鱼的存活率、增重率、特定生长率、饲料系数、肝体比及肥满度分别按以下公式计算:
存活率(SR,%)=Nt/N0×100
增重率(WGR,%)=(Wt-W0)/W0×100
特定生长率(SGR,%/d)=(lnWt-lnW0)/t×100
饲料系数(FCR)=F/(Wt+Wn-W0)
肝体比(HSI,%)=肝脏重/全鱼重×100
肥满度(CF,g/cm2)=Wi/(L3)×100
式中,Nt为终末珍珠龙胆石斑鱼尾数,N0为初始珍珠龙胆石斑鱼尾数,Wt为终末珍珠龙胆石斑鱼总重,W0为初始珍珠龙胆石斑鱼总重,Wn为死亡个体总量,t为养殖时间,F为摄入饲料干重,Wi为珍珠龙胆石斑鱼体重(g),L为珍珠龙胆石斑鱼体长(cm)。
1.5 血清生化指标测定
珍珠龙胆石斑鱼血清生化指标采用南京建成生物工程研究所有限公司生产的试剂盒进行测定,每个样品重复3次,血清生化指标包括总蛋白(Total protein,TP)、葡萄糖(Glucose,GLU)、总胆固醇(To‐tal cholesterol,TCHO)、总甘油三酯(Total triglyceride,TG)、丙二醛(Malondialdehyde,MDA)含量及谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)、过氧化氢酶(Catalase,CAT)、溶菌酶(Lysozyme,LZM)、胃蛋白酶(Pepsin)、肠胰蛋白酶(Trypsin)、肠淀粉酶(Amy‐lase)、肠脂肪酶(Lipase)活性。
1.6 转录组测序分析
1.6.1 测序文库构建及Illumina测序 用TRIzol®试剂(美国Invitrogen公司)从血细胞中提取总RNA,以带有Oligo(dT)的磁珠富集真核生物mRNA(若为原核生物,则用试剂盒去除rRNA)。加入Fragmenta‐tion Buffer将mRNA打断成短片段,以mRNA为模板,用六碱基随机引物合成cDNA第一链,然后加入缓冲液、dNTPs、RNase H和DNA Polymerase I合成cDNA第二链,经Qia Quick PCR试剂盒纯化并加入EB缓冲液洗脱后进行末端修复、加poly(A)尾并连接测序接头,然后用琼脂糖凝胶电泳进行片段选择,最后进行PCR扩增,建好的测序文库委托广州基迪奥生物科技有限公司,采用Illumina HiSeqTM4000进行测序。
1.6.2 转录组De novo组装 Illumina测序得到的原始图像数据经Base Calling转化为序列数据,对原始数据(Raw date)进行过滤,去除含Adaptor的Reads、低质量Reads(Q≤20的碱基数占整个Read的40%以上)、N率≥10%的Reads,得到高质量的Clean reads。使用Trinity进行转录组De novo组装:首先将具有一定长度overlap的Reads连成更长的片段,再通过Reads overlap得到不含N的组装片段即组装获得Unigenes。
1.6.3 转录组注释分析 注释前利用Trinity提供的ORF预测流程对组装的Unigenes进行基因预测,通过HMMER 3.0对组装的Unigenes在Pfam数据库中进行蛋白家族注释分析。设定期望值<0.00001,使用BLASTx对拼接所得的所有核苷酸序列分别在Nr、Swiss-Prot、KOG和KEGG数据库进行比对,以获得相应的注释信息。
1.6.4 差异表达基因富集分析 使用Bowtie将Clean reads比对到转录组序列上,通过RSEM对Bowtie比对结果进行表达量统计分析,以RPKM/FPKM衡量基因的表达量水平,并运用edgeR进行基因表达差异分析。FDR≤0.05且|log2FC(Sample2/Sample1)|≥1,则该基因为显著差异表达基因。然后利用Blast2 GO在GO数据库中进行功能分类注释,并在KEEG数据库中进行代谢通路富集分析。
1.6.5 实时荧光定量PCR验证 为验证RNA-Seq测序结果准确性,选择保存在-80 ℃用于转录组测序的样本提取RNA进行实时荧光定量PCR验证。随机选择10个差异表达基因进行验证,包括肌红蛋白(Myoglobin)基因、絮凝蛋白FLO11(SPRR3)基因、Septin-5基因、细胞表面糖蛋白(MCAM)基因、血清剥夺反应因子(SDPR)基因、逆转录病毒相关Pol多蛋白(Pol)基因、Kruppel-like因子9(KLF9)基因、干扰素调节因子4(IRF4)基因、C-myc启动子结合蛋白(DENND4A)基因和肽基脯氨酰顺反异构酶(FKBP5)基因。差异表达基因扩增引物序列如表2所示,以EF1α为内参基因。利用实时荧光定量PCR仪(德国Eppendorf公司)进行检测,扩增程序:95 ℃预变性2 min;95 ℃15 s,60 ℃10 s,72 ℃20 s,进行40个循环。采用2-ΔΔCt法换算目的基因相对表达量。
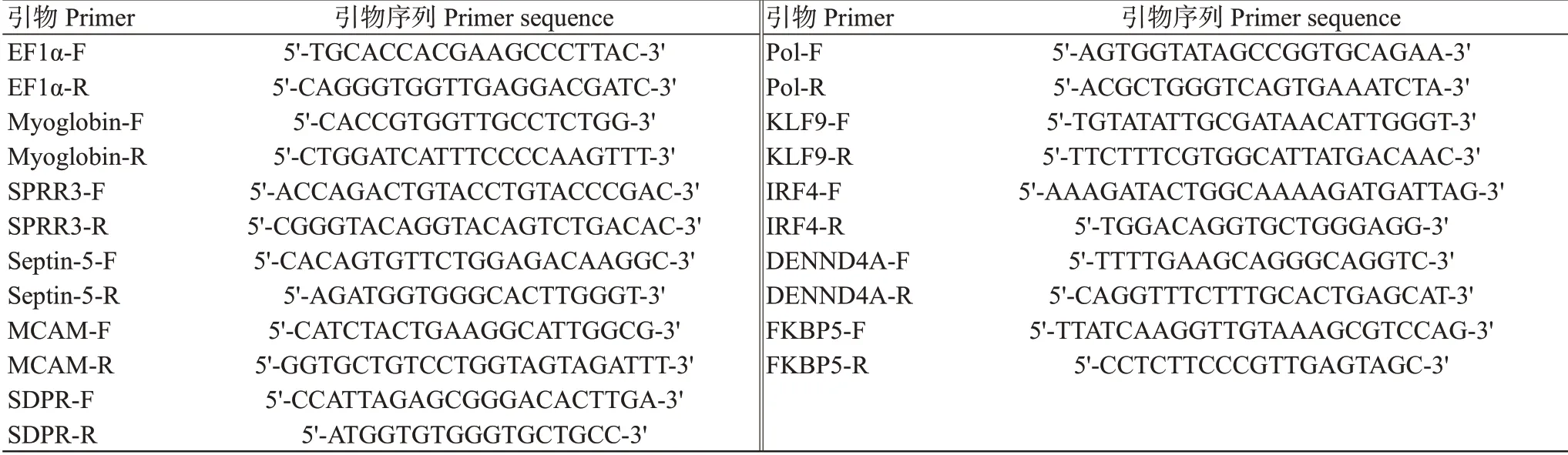
表2 实时荧光定量PCR扩增引物序列信息Table 2 Real-time fluorescent quantitative PCR amplified primer sequence information
1.7 肠道菌群组成分析
1.7.1 PCR扩增及产物回收 采用美国Hipurte PowerSoil®的DNA Isolation Kit试剂盒完成珍珠龙胆石斑鱼肠道细菌总DNA提取,采用16S rDNA序列V3~V4区通用引物(341F:5'-CCTAYGGGRBGCAS CAG-3';806R:5'-GGACTACNNGGGTATCTAAT-3')进行PCR扩增,反应体系20.0 μL:5×FastPfu Buffer 10.0 μL,2.5 mmol/L dNTPs 4.0 µL,上、下游引物(5 μmol/L)各1.0 µL,PrimeSTAR HS DNA聚合酶0.5µL,DNA模板10 ng,ddH2O补足至20.0 µL。扩增程序:98 ℃预变性1 min;98 ℃30 s,55 ℃30 s,72 ℃45 s,进行27个循环;72 ℃延伸5 min。PCR扩增产物经1.0%琼脂糖凝胶电泳后利用成像系统检测,并在紫外灯下割取目的条带,随后按凝胶回收试剂盒[天根生化科技(北京)有限公司]说明纯化目的产物,最后用2.0%琼脂糖凝胶电泳检测纯化效果。将DNA浓度调至25 ng/μL,所有样品按1∶1混匀后,通过Illumina HiSeq PE250平台进行建库及测序,委托广州赛哲生物科技股份有限公司完成。
1.7.2 信息学分析 得到Clean Tags后进行OTUs聚类分析。根据OTUs聚类结果,对每个OTU的代表序列进行物种注释,得到对应的物种注释信息和基于物种的丰度分布情况;同时对OTUs进行丰度、Al‐pha多样性分析(包括物种丰富度指数Chao1和ACE,多样性指数Shannon和Simpson),明确样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有OTUs信息等;最后在门和属2个分类水平上统计每个样品的物种丰度和物种分布,进行群落结构分析。
1.8 统计分析
采用GraphPad Prism 7.04对试验数据进行t检验,以分析组间差异。
2 结果与分析
2.1 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼生长性能的影响
与对照组相比,添加β-葡聚糖能显著提高珍珠龙胆石斑鱼的终末体重、增重率和特定生长率(P<0.05,下同)。β-葡聚糖组珍珠龙胆石斑鱼的存活率和肥满度也高于对照组,肝体比低于对照组,但差异不显著(P>0.05,下同)。在饲料系数方面,β-葡聚糖组显著高于对照组(表3)。
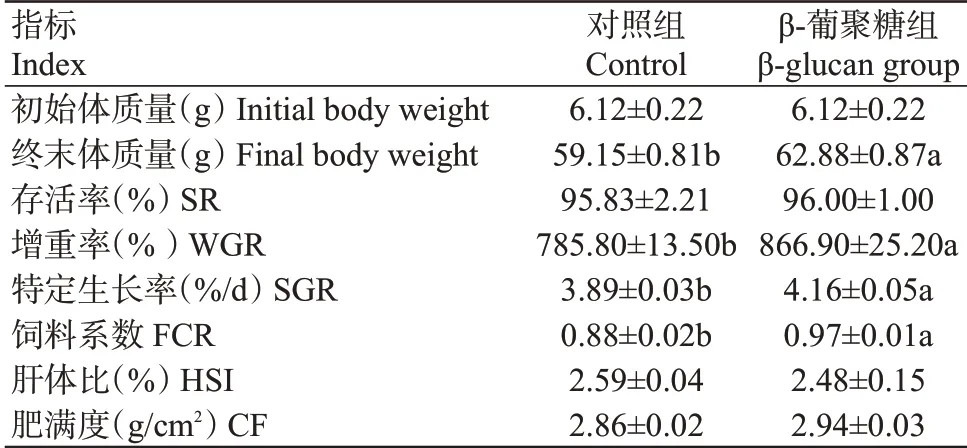
表3 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼生长性能的影响Table 3 Effects of adding β-glucan to feed on growth perfor‐mance of E.fuscoguttatus ♀×E.lanceolatus♂
2.2 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼血清生化和免疫指标的影响
如表4所示,饲料中添加β-葡聚糖能显著提高珍珠龙胆石斑鱼血清中总蛋白含量,同时显著降低总胆固醇和总甘油三酯水平。与对照组相比,β-葡聚糖组珍珠龙胆石斑鱼血清中的谷丙转氨酶和谷草转氨酶活性均呈下降趋势,其中谷丙转氨酶活性呈显著下降趋势。添加β-葡聚糖对珍珠龙胆石斑鱼血清中的酸性磷酸酶和碱性磷酸酶活性未造成显著影响,但可使过氧化氢酶和溶菌酶活性显著提高,丙二醛含量显著降低。

表4 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼血清生化和免疫指标的影响Table 4 Effects of adding β-glucan to feed on serum biochemical and immune indexes of E.fuscoguttatus ♀×E.lanceolatus♂
2.3 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼消化酶的影响
如表5所示,β-葡聚糖组珍珠龙胆石斑鱼的胃蛋白酶和肠道脂肪酶活性显著高于对照组,而胰蛋白酶和肠淀粉酶活性与对照组相比无显著差异。

表5 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼消化酶的影响Table 5 Effects of adding β-glucan to feed on digestive en‐zyme of E.fuscoguttatus ♀×E.lanceolatus♂
2.4 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼转录组的影响
2.4.1 测序及序列组装结果 利用Illumina HiSeq PE250平台进行测序,滤掉低质量碱基后得到的有效碱基(Clean bases)数目为8194810200个,Clean bases占总碱基数的98.50%。原始Reads滤过后得到54632068条Clean reads,占原始Reads的97.14%,其中GC含量为49.96%、Q20为98.50%、Q30为95.50%。采用Trinity对Clean reads进行组装,共获得79291条Unigenes,其长度范围为201~20143 bp,所有Unige‐nes长度均大于200 bp,平均长度为941 bp,Unigenes的N50为2141 bp。进一步对Unigenes进行质量评估,结果发现随着序列长度的增加,Unigenes分布数量呈逐级递减趋势(图1),没有明显中断现象,表明本研究的转录组测序质量较高。

图1 Unigenes序列长度统计结果Fig.1 Unigenes sequence length statistics
2.4.2 转录组注释分析结果 通过与Nr、Swiss-Prot、KOG、KEGG数据库进行比对,发现有28811条Unigenes与已知基因同源,占整个组装转录本的36.34%,在Nr、Swiss-Prot、KOG、KEGG数据库中注释到的同源序列数目分别为28664(占36.15%)、19668(占24.80%)、16056(占20.24%)和14866(占18.74%)条。物种同源性分析结果(图2)显示,珍珠龙胆石斑鱼Unigenes与Nr数据库中的脊椎动物基因高度同源,其中与大黄鱼(Larimichthys crocea)的同源序列比例最高,达22.26%(6381个),其次是与盲曹鱼(Lates calcarifer),其同源序列比例达22.10%(6335个)。

图2 转录组序列同源物种分布统计结果Fig.2 Transcriptome sequence allied species distribution statistics
对79291条Unigenes进行GO功能注释分析,结果显示共有35161条Unigenes在生物学过程(Biologi‐cal process)、细胞组分(Cellular component)和分子功能(Molecular function)三大类别的53个功能分支中得到注释(图3)。在生物学过程方面,Unigenes主要注释到细胞过程(Cellular process)、单一生物过程(Single-organism process)、代谢过程(Metabolic pro‐cess)和生物调控(Biological regulation)等功能条目上;在细胞组分方面,以注释到细胞(Cell)、细胞部分(Cell part)、生物膜(Membrane)、生物膜部分(Membrane part)和细胞器(Organelle)等功能条目的Unigenes较多;在分子功能方面,Unigenes主要注释到结合(Binding)和催化活性(Catalytic activity)2个功能条目上。

图3 Unigenes的GO功能注释分析结果Fig.3 GO functional annotation analysis result of unigenes
对79291条Unigenes进行KEGG信号通路富集分析,结果如图4所示,共有16849条Unigenes富集为细胞过程(Cellular processes)、有机系统(Organis‐mal systems)、代谢(Metabolism)、遗传信息处理(Genetic information processing)和环境信息(Envi‐ronmental information processing)五大分类,富集到的Unigenes数目分别为2875(占17.06%)、2129(占12.64%)、6865(占40.74%)、2089(占12.40%)和2891(占17.16%)条,共涉及228条KEGG信号通路,其中免疫相关通路有16条。
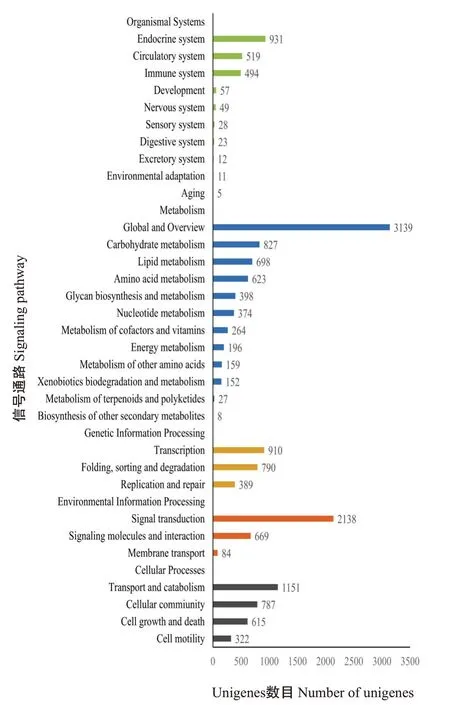
图4 Unigenes的KEGG信号通路富集分析结果Fig.4 KEGG signaling pathway enrichment analysis result of unigenes
2.4.3 差异表达基因筛选及富集分析结果 依据FDR≤0.05且|log2FC(Sample2/Sample1)|≥1的筛选条件,共筛选获得8014个差异表达基因(图5),包括4990个上调基因和3024个下调基因。GO功能注释分析结果(图6)表明,分别有470、262和436个差异表达基因注释到生物学过程、细胞组分和分子功能三大类别中。在生物学过程类别中,以生物调控所占比例最高,其次是细胞过程、代谢过程和单一生物过程;在细胞组分类别中,以细胞类别所占比例最高,其次是细胞部分及细胞器;在分子功能类别中,主要是结合及分子传感器活性功能。KEEG信号通路富集分析结果(图7)显示,共有648个差异表达基因富集到175个KEEG信号通路上。其中,富集基因数目最多且具有显著差异的前10个信号通路分别是细胞因子—细胞因子受体相互作用(Cytokine-cytokine receptor interaction)、吞噬体(Phagosome)、精氨酸生物合成(Arginine biosynthesis)、微生物在不同环境中的代谢(Microbial metabolism in diverse environ‐ments)、细胞黏附分子(Cell adhesion molecules)、嘌呤代谢(Purine metabolism)、JAK-STAT信号通路(Jak-STAT signaling pathway)、神经活性配体—受体相互作用(Neuroactive ligand-receptor interaction)、糖化/葡萄糖生成(Glycolysis/gluconeogenesis)及IgA产生的肠道免疫网络(Intestinal immune network for IgA production)。在富集到的KEGG信号通路中共有16条通路与免疫功能相关,涉及139个显著差异基因。与对照组相比,β-葡聚糖组有108个显著上调的差异表达基因和31个显著下调的差异表达基因富集到13条免疫调节通路上(表6)。
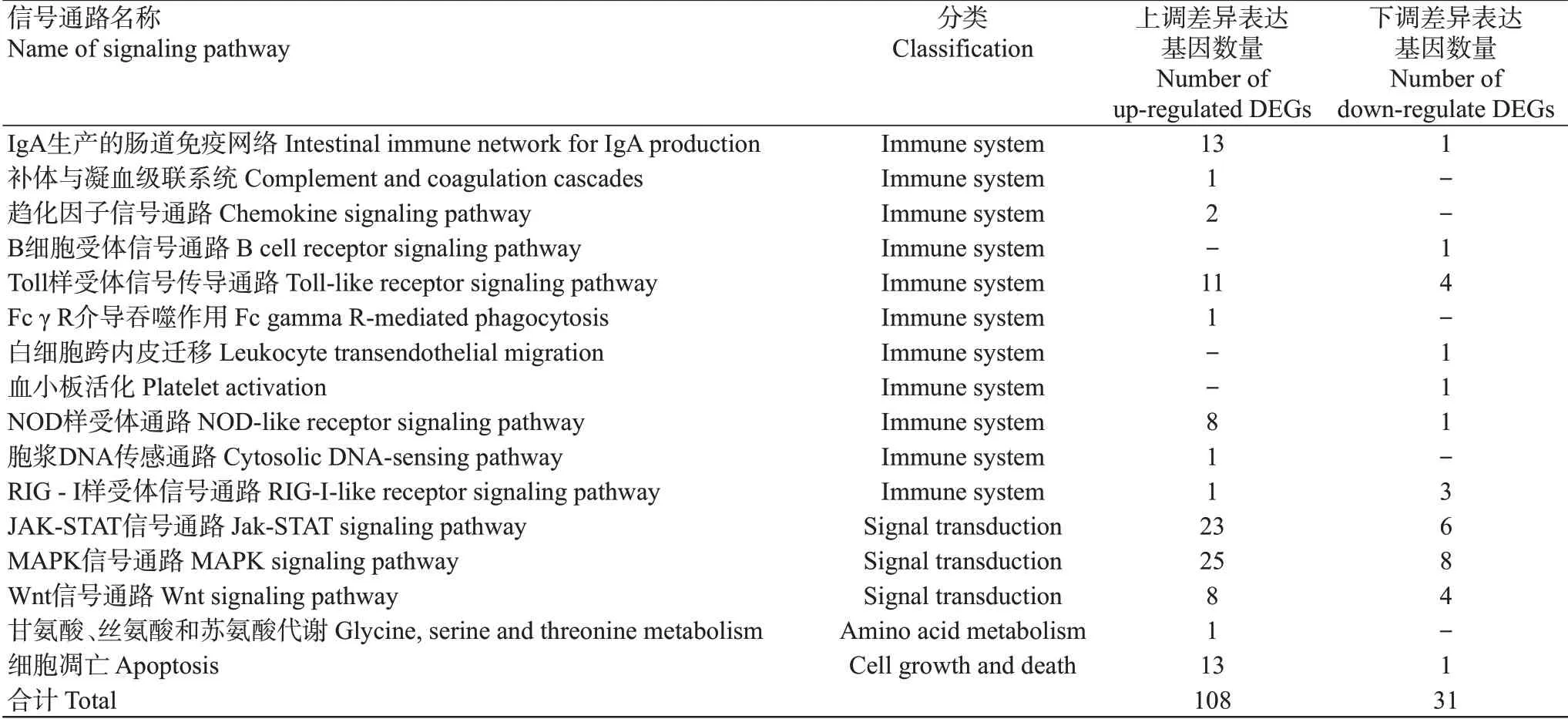
表6 饲料添加β-葡聚糖后珍珠龙胆石斑鱼中与免疫通路相关的差异表达基因Table 6 DEGs related to immune pathway in E.fuscoguttatus ♀×E.lanceolatus♂after adding β-glucan to the feed
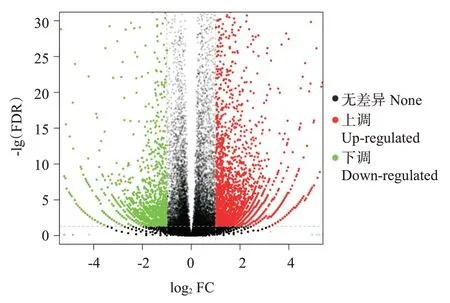
图5 差异表达基因的火山图Fig.5 Volcano map of DEGs

图6 差异表达基因的GO功能注释分析结果Fig.6 GO functional annotation analysis of differentially expressed genes(DEGs)
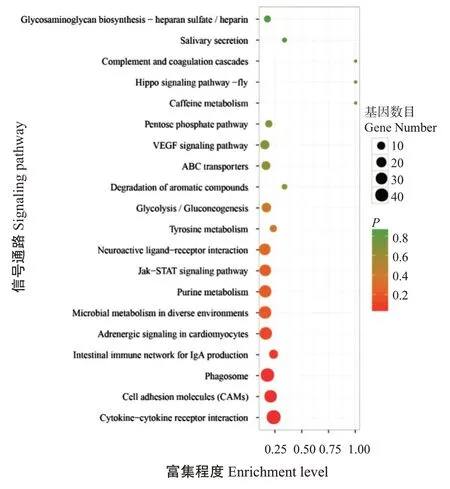
图7 差异表达基因的KEGG信号通路富集分析结果Fig.7 KEGG signaling pathway enrichment analysis of DEGs
2.4.4 实时荧光定量PCR验证结果 随机挑选在对照组和β-葡聚糖组珍珠龙胆石斑鱼间呈显著差异表达的相关基因(Myoglobin、SPRR3、Septin5、MCAM、SDPR、Pol、KLF9、IRF4、DENND4A和FKBP5)进行实时荧光定量PCR验证,结果(图8)显示,实时荧光定量PCR检测得到的基因相对表达量与RNA-Seq测序结果基本一致。
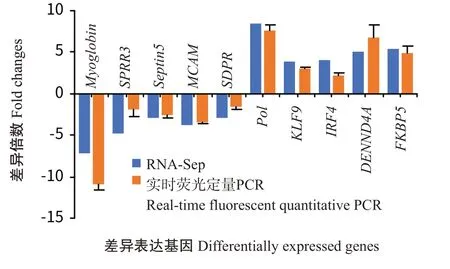
图8 珍珠龙胆石斑鱼差异表达基因实时荧光定量PCR验证结果Fig.8 Real-time fluorescent quantitative PCR verification analysis of DEGs in E.fuscoguttatus ♀×E.lanceolatus♂
2.5 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼肠道菌群的影响
2.5.1 肠道菌群多样性分析结果 珍珠龙胆石斑鱼肠道菌群多样性分析结果(表7)表明,β-葡聚糖组珍珠龙胆石斑鱼肠道菌群的OTUs数量、ACE指数和Shannon指数均显著高于对照组,而Chao1指数和Simpson指数在两处理组间无显著差异。
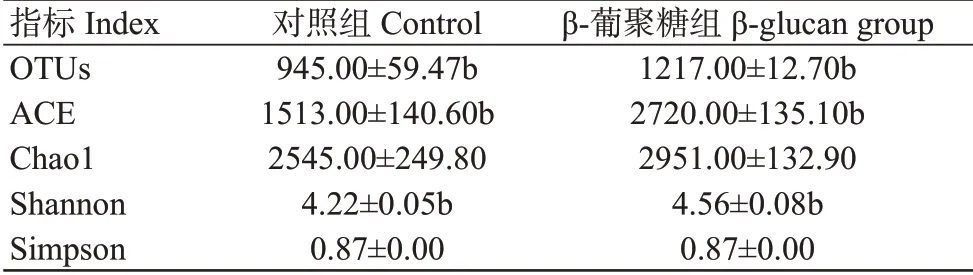
表7 饲料添加β-葡聚糖对珍珠龙胆石斑鱼肠道菌群多样性的影响Table 7 Effects of adding β-glucan to feed on intestinal bacte‐ria community diversity of E.fuscoguttatus ♀×E.lanceolatus♂
2.5.2 肠道菌群结构组成 在门分类水平上,对照组和β-葡聚糖组珍珠龙胆石斑鱼肠道菌群中共发现30个门类,包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻门(Cyanobacteria)及厚壁菌门(Firmicutes)等。选取2个处理组相对丰度排名前5的物种生成相对丰度柱形堆叠图,结果显示其总相对丰度均超过97%(图9),但不同门类细菌在两处理组间的相对丰度存在明显差异,β-葡聚糖组中变形菌门、蓝藻门的相对丰度显著低于对照组(图10-A和图10-C),而厚壁菌门、拟杆菌门的相对丰度极显著高于对照组(图10-B和图10-D)。
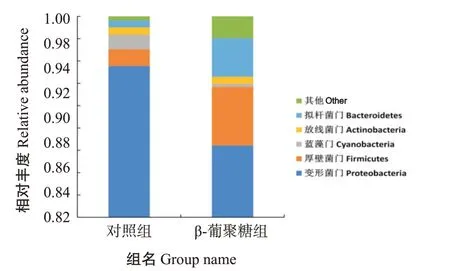
图9 在门分类水平上对照组和β-葡聚糖组珍珠龙胆石斑鱼肠道菌群结构的差异Fig.9 Intestinal bacteria community structural difference of E.fuscoguttatus ♀×E.lanceolatus♂in control and β-glu‐can groups at phylum level

图10 β-葡聚糖对珍珠龙胆石斑鱼肠道优势菌门相对丰度的影响Fig.10 Effects of β-glucan on phylum-level dominant bacteria relative abundance of E.fuscoguttatus ♀×E.lanceolatus♂
在属分类水平上,对照组和β-葡聚糖组珍珠龙胆石斑鱼肠道菌群中共发现295个种属,包括发光杆菌属(Photobacterium)、鞘氨醇单胞菌属(Sphin‐gomonas)、盐单胞菌属(Halomonas)、红游动菌属(Rhodoplanes)及无色杆菌属(Achromobacter)等,选取2个处理组相对丰度排名前5的物种生成相对丰度柱形堆叠图(图11)。不同种属细菌在两处理组间的相对丰度也存在明显差异,β-葡聚糖组中发光杆菌属的相对丰度显著低于对照组(图12-A),盐单胞菌属的相对丰度极显著低于对照组(图12-B),而其余3 个种属的相对丰度在两处理组间无显著差异(图12-C、图12-D和图12-E)。
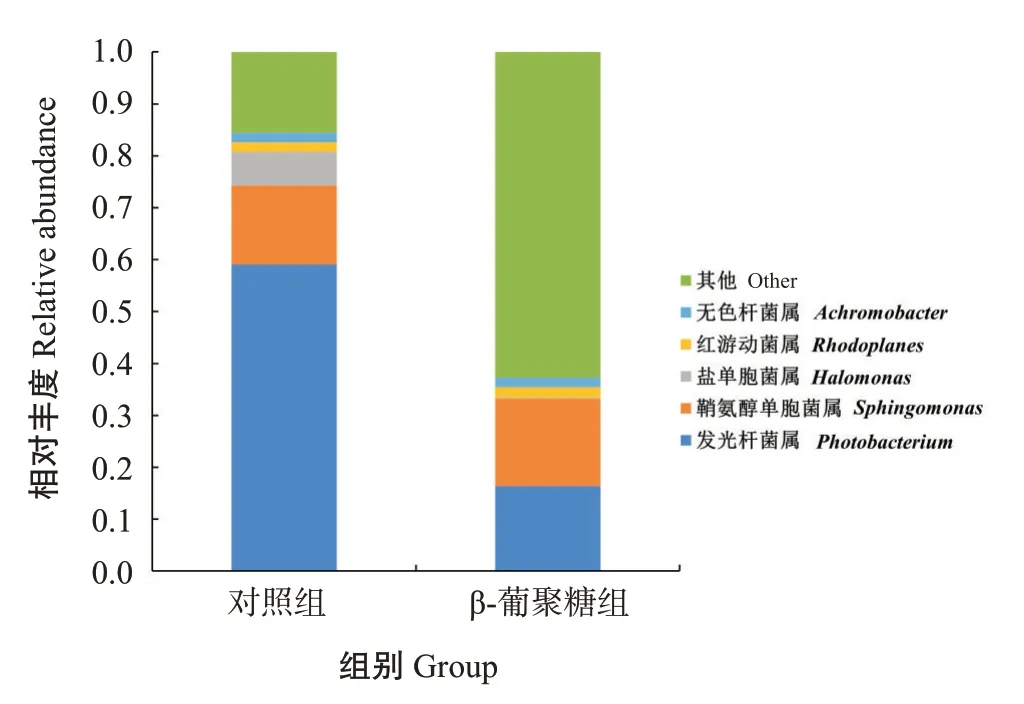
图11 在属分类水平上对照组和β-葡聚糖组珍珠龙胆石斑鱼肠道菌群结构的差异Fig.11 Intestinal bacteria community structural difference of E.fuscoguttatus ♀× E.lanceolatus♂in control and βglucan groups at genus level

图12 β-葡聚糖对珍珠龙胆石斑鱼肠道优势菌属相对丰度的影响Fig.12 Effects of β-glucan on genus-level dominant bacteria relative abundance of E.fuscoguttatus ♀×E.lanceolatus♂
3 讨论
已有大量研究表明,在饲料中添加β-葡聚糖能有效提高鱼类的生长性能。Selvaraj等(2005)研究发现,在饲料中添加酵母β-葡聚糖能提高鲤鱼的存活率、特异性和非特异性生长性能;周艳萍等(2008)研究表明,β-葡聚糖能提高异育银鲫(Carassius auratus gibelio)的存活率,但效果不显著;吴春玉等(2013)对花鲈的研究表明,饲料中添加β-葡聚糖能显著提高其增重率和特定生长率。本研究发现,在饲料中添加β-葡聚糖能显著提高珍珠龙胆石斑鱼的增重率和特定生长率,表明β-葡聚糖对珍珠龙胆石斑起到促生长作用。肝体比和肥满度是反映鱼体形体的重要指标。本研究结果表明,饲料中添加β-葡聚糖可降低珍珠龙胆石的肝体比,提高其肥满度,但效果均不显著,与β-1,3-葡聚糖对花鲈的研究结果(吴春玉等,2013)一致。此外,多种鱼类摄食添加β-葡聚糖的饲料时其饲料系数显著提高。许国焕等(2004)对罗非鱼的研究发现,投喂β-葡聚糖饲料组的饲料系数显著高于基础饲料组,推测是由于胰蛋白酶分解产物中存在抑制生长因子。周艳萍等(2008)研究表明,对异育银鲫投喂210和420 mg/kg的β-葡聚糖时其饲料系数均显著提高。本研究中,β-葡聚糖添加组珍珠龙胆石的饲料系数明显高于对照组,可能与β-葡聚糖对鱼的消化能力产生的影响有关,但具体原因有待进一步探究。
血清生化指标可反映机体物质代谢和某些组织器官的变化,常用于评价鱼体健康及营养状况等。其中,血清总蛋白含量能反映鱼体的营养与代谢状况,也间接反映机体的免疫水平(Bahmani et al.,2000);血清总胆固醇和总甘油三酯的变化情况可反映机体脂质代谢功能。吴春玉等(2013)在花鲈中的研究表明,饲料中添加适量β-葡聚糖在一定程度上能升高花鲈体内血清总蛋白含量,降低总胆固醇和总甘油三酯水平,说明饲料中添加β-葡聚糖能促进机体蛋白合成,进而提高花鲈对蛋白的消化吸收,同时脂类等营养物质通过代谢而促进其生长。本研究结果也表明,在珍珠龙胆石斑鱼饲料中添加β-葡聚糖能显著提高血清总蛋白含量,并显著降低血清总胆固醇和总甘油三酯水平,说明β-葡聚糖在不同鱼类中能发挥相似的功能。谷丙转氨酶和谷草转氨酶是衡量动物机体肝脏是否受损的标志之一,其活性随着肝脏受损伤的程度增加而升高,当肝脏受到损伤或短期内外界环境的刺激,血清中的谷丙转氨酶和谷草转氨酶活性就会升高(Giannini et al.,2003)。本研究结果表明,珍珠龙胆石斑鱼血清中的谷丙转氨酶和谷草转氨酶活性均低于对照组,且β-葡聚糖添加组的谷丙转氨酶活性与对照组间差异显著,说明β-葡聚糖能有效保护珍珠龙胆石斑鱼肝脏不受损。汪成竹和陈昌福(2008)、贺国龙等(2010)研究发现,以β-葡聚糖为主要成分的酵母细胞壁免疫多糖可显著降低草鱼血清中谷丙转氨酶和谷草转氨酶活性,改善草鱼的肝功能。过氧化氢酶能将体内形成的过氧化物氧化成无害物质,对宿主起保护作用;溶菌酶则具有抗菌、消炎、抗病毒等作用;丙二醛是膜脂氧化的重要标志物,能加剧膜氧化,具有细胞毒性(张晨光等,2021)。Engstad等(1992)研究发现给虹鳟中注射β-葡聚糖其血清过氧化氢酶活性显著提
高;王永宏等(2013)研究表明腹腔注射β-葡聚糖可有效提高暗纹东方鱼血清过氧化氢酶和溶菌酶活性;吴春玉等(2013)研究发现在饲料中添加适量β-葡聚糖能一定程度上降低花鲈血清丙二醛含量。在本研究中,β-葡聚糖能显著提高珍珠龙胆石斑鱼血清过氧化氢酶和溶菌酶活性,并显著减低丙二醛含量,进一步证实β-葡聚糖可提高鱼类的抗氧化水平与抗菌能力,降低丙二醛造成的细胞毒性作用,进而提升机体免疫力。
本研究的差异表达基因GO功能注释分析结果表明,分别有470、262和436个差异表达基因注释到生物学过程、细胞组分和分子功能三大类别中;KEGG信号通路富集分析则发现有有648个差异表达基因被富集到175个KEEG信号通路上,其中有16条通路与免疫功能有关,以MAPK信号通路、Toll样受体信号传导通路、Jak-STAT信号通路及细胞凋亡等通路富集到的差异表达基因最多。Jak-STAT信号通路参与机体的多种调节反应,其中,白细胞介素-6(IL-6)与白细胞介素-6受体α(IL-6Rα)结合,通过这种结合IL-6可诱导gp130同型二聚化(Heinrich et al.,1998),而gp130同型二聚化可触发JaK-STAT级联,异常的IL-6信号或导致自身免疫性及炎症等疾病(Neurath and Finotto,2011;Sansone and Bromberg,
2012)。Toll样受体(TLRs)可识别不同的病原体相关分子模式,在先天性免疫应答中扮演重要角色,是机体抵御病原体入侵的第一道防线(Horng et al.,2001;Kagan and Medzhitov,2006)。Toll/白细胞介素-1受体结构域包含接头蛋白(TIRAP),可介导相关Toll样受体下游信号转导。本研究发现,在饲料中添加β-葡聚糖能诱导珍珠龙胆石斑鱼IL-6基因和TI‐RAP基因高表达,提示IL-6和TIRAP介导的JaKSTAT信号通路及Toll样受体信号通路在先天免疫屏障中发挥作用,参与珍珠龙胆石斑鱼抗病免疫反应。
鱼类消化道中的菌群主要是通过环境或食物进入消化道定殖,进而成为鱼类消化道重要的组成成分,与鱼类的健康及免疫密切相关。鱼类一旦接触到周围的水生环境和活饵料,多种细菌即开始在肠道内定殖,而最先定殖的细菌与宿主肠道环境相适应,因此肠道是消化道内细菌数量最多的部位(宋增福和吴天星,2007)。多糖通常被认为是一种肠道功能调节剂,能改善动物肠道菌群结构,促进有益菌生长,并抑制有害菌繁殖。在本研究中,添加β-葡聚糖后珍珠龙胆石斑鱼肠道菌群的OTUs数量、ACE指数和Shannon指数显著高于对照组,表明β-葡聚糖能显著提高肠道菌群物种丰富度和多样性。肠道菌群结构组成分析结果显示,珍珠龙胆石斑鱼肠道菌群以变形菌门占主导地位,其次是厚壁菌门和拟杆菌门。变形菌门、厚壁菌门和拟杆菌门是动物肠道当中最常见的定殖菌,其中变形菌门丰度升高可能是导致肠道菌群不平衡的主要原因(Shin et al.,2015)。拟杆菌门和厚壁菌门所产生的多糖水解酶能有效降解膳食纤维,进而产生单糖和短链脂肪酸,是肠道内壁细胞基本代谢的能量来源之一(Mount‐fort et al.,2002)。杨俊花等(2017)研究表明,在小鼠肠道中,肠道炎症可能会伴随着变形菌门上升及拟杆菌门下降。在本研究中,变形菌门、拟杆菌门和厚壁菌门在β-葡聚糖添加组和对照组珍珠龙胆石斑鱼肠道中均占优势,但β-葡聚糖添加组变形菌门的相对丰度较对照组呈显著下降趋势,表明添加β-葡聚糖可调节鱼肠道有益菌的相对丰度,在属分离水平上也得到证实。美人鱼发光杆菌(P.damselae)又称海弧菌,隶属于发光杆菌属,是海洋鱼类常见的一种致病菌,能致使鱼类死亡(王洪彬等,2018)。因此,发光杆菌属相对丰度的下降能有效抑制美人鱼发光杆菌的产生。何远法等(2017)以添加酵母培养物(葡聚糖≥50%,甘露寡糖≥1%)的饲料喂养凡纳滨对虾,其肠道中发光杆菌属丰度下降;Jung-Schroers等(2015)研究发现在饲料中添加β-葡聚糖对鲤鱼肠道菌群也有一定的影响,尤其是显著降低肠道中的弧菌数目,增加菌群多样性。在本研究中,β-葡聚糖添加组珍珠龙胆石斑鱼肠道中的发光杆菌属相对丰度明显下降,也表明β-葡聚糖可调节鱼类肠道菌群多样性,优化菌群结构组成。
4 结论
β-葡聚糖能有效增强珍珠龙胆石斑鱼的抗氧化能力及提高其肠道菌群物种丰度和多样性以抵御外界有害菌的繁殖,同时提升珍珠龙胆石斑鱼的抗炎症和抗病等免疫能力。即β-葡聚糖在珍珠龙胆石斑鱼上具有良好的生长和免疫增强效果,可作为新型免疫增强剂推广应用。
