温度和pH对中华绒螯蟹幼蟹耗氧率、排氨率和窒息点的影响
2022-08-09冯文荣周立水丁秀芳唐永凯
陈 雪,冯文荣,周立水,丁秀芳,梁 猛,唐永凯,3*
(1上海海洋大学水产与生命学院,上海 201306;2中国水产科学研究院淡水渔业研究中心/农业农村部淡水渔业与种质资源利用重点实验室,江苏无锡 214081;3南京农业大学无锡渔业学院,江苏无锡 214081)
0 引言
【研究意义】呼吸和排泄是动物能量代谢的主要组成部分,其变化能反映动物机体的生理状态及其对环境变化的响应。耗氧率和排氨率是评价水产动物呼吸和排泄的最常见指标,可间接反映呼吸代谢规律和生理状态,对水产动物能量代谢研究及养殖环境调控具有重要指导作用(冯雪等,2012)。温度和pH是影响水生动物生存、生长和生理状态的主要环境因子(叶乐等,2015;徐连伟等,2018;韩庆等,2021)。因此,探究中华绒螯蟹(Eriocheir sinensis)幼蟹在不同环境条件下的呼吸代谢规律,对提高幼蟹养殖存活率具有重要意义。【前人研究进展】环境温度可显著影响水产动物呼吸代谢水平和生理调节机制,过高或过低的温度均会抑制其生长发育,降低存活率(李青和陈永祥,2019)。已有研究表明,温度变化会影响太平洋牡蛎(Crassostrea gigasThun‐berg)(Bougrier et al.,1995)、巴拿马珠母贝(Pincta‐da mazatlanica)(Saucedo et al.,2004)、虾夷扇贝(Datinopecten yessoensis)(徐东等,2010)、三疣梭子蟹(Portunus trituberculatus)(戴超等,2014)、中华原钩虾(Eogammarus sinensis)(曹善茂等,2015)、菲律宾蛤仔(Ruditapes philippinarum)(Nie et al.,2017)及九孔鲍(Haliotis diversicolor supertexta)(王崇懿等,2020)等水产动物的耗氧率和排氨率,在适宜温度范围内,温度越高,水产动物的代谢水平越高,耗氧率和排氨率也随之升高;当超过或低于一定温度后,其生理代谢水平紊乱,机体进入麻痹甚至停止的状态,耗氧率和排氨率随之下降。此外,不同水平的pH可影响水产动物的呼吸代谢和能量供给方式。水产动物对水体pH也有一定的适应范围,当水体pH超过或低于适宜范围时,则影响水产动物的新陈代谢、生长发育及呼吸等一系列生理过程,甚至引起病变或死亡,如pH变化会导致中国龙虾(Panulirus stimpsoni)(梁华芳等,2011)、波纹龙虾(P.homarusLinnaeus)(梁华芳等,2012)、中华原钩虾(曹善茂等,2015)、中华小长臂虾(Palaemonetes sinensis)(姜宏波等,2017)及大竹蛏(Solen grandis)(张雨等,2021)等水产动物的耗氧率和排氨率发生变化。针对中华绒螯蟹的研究,郑曙明和李代金(1989)对其幼蟹耗氧率进行测定,邹恩民等(1995)观察了中华绒螯蟹在不同温度下的呼吸率变化。不适宜的温度同样会抑制中华绒螯蟹的生长、摄食和蜕皮(洪美玲等,2007;Yuan et al.,2017);在过酸或过碱的pH胁迫下,中华绒螯蟹的生长收到显著抑制(黄志鹏,2018),尤其是高pH胁迫易引起中华绒螯蟹氧化应激反应(龚志等,2015)。【本研究切入点】中华绒螯蟹俗称河蟹、大闸蟹等,隶属于节肢动物门(Arthropo‐da)十足目(Decapoda)方蟹科(Grapsidae)弓腿亚科(Varuninae)绒螯蟹属(Eriocheir),是我国重要的淡水养殖品种(张本铭等,2000),其生长发育、能量代谢和生理状态等极易受环境因子(温度、盐度和pH等)的影响。虽然已有研究聚焦于温度和pH对中华绒螯蟹的影响,但关于不同规格中华绒螯蟹在不同温度和pH下的呼吸代谢变化规律尚不清楚。【拟解决的关键问题】探讨温度和pH对中华绒螯蟹幼蟹耗氧率、排氨率及窒息点的影响,明确中华绒螯蟹在不同环境条件下的呼吸代谢规律,为其幼蟹养殖条件的优化和种苗繁育提供参考依据。
1 材料与方法
1.1 试验材料
中华绒螯蟹幼蟹由中国水产科学研究院淡水渔业中心阳澄湖虾蟹绿色养殖基地提供。幼蟹在实验室玻璃缸内暂养1周,使其适应小水体环境。暂养期间不间断充气增氧,溶解氧浓度保持在7.00 mg/L以上,暂养温度为(15±2)℃,与蟹塘温度相近,pH 8.0±0.2。每天上午投喂商品配合饲料,换水量为1/3。正式试验前1 d停止投喂,选择处于蜕皮间期的健康个体,根据体质量分成3组(表1),分别为:大规格组(L)21.68±3.58 g,中规格组(M)11.31±0.29 g,小规格组(S)5.84±0.33 g。

表1 供试中华绒螯蟹幼蟹的生物学指标Table 1 Biological indexes of juvenile E.sinensis tested
1.2 试验方法
(1)温度试验设5个不同温度梯度(10、15、20、25和30 ℃),采用控温棒进行缓慢加温或冰块缓慢降温的方法调节水温,待水温稳定后(±0.5 ℃),使幼蟹在相应温度下适应2 h后(L组4只,M组9只,S组16只)再进行试验。水体pH 8.0±0.2。
(2)pH试验设4个不同pH梯度(pH 6.0、pH 7.0、pH 8.0和pH 9.0),分别以HCl或NaOH调节水体pH,将pH调试至相应梯度(±0.2),使幼蟹放适应2 h后再进行试验。水体温度(15±2)℃。
1.3 耗氧率、排氨率和窒息点测定
1.3.1 耗氧率测定 利用Loligo®Systems水生无脊椎动物呼吸代谢测量系统,配合FireSting O2装置,采用密闭系统进行溶解氧浓度测定。呼吸室为直径10 cm、长20 cm的透明容器,呼吸室连接循环水泵,保证呼吸室内水充分混合。将适应暂养2 h的幼蟹放入呼吸室,呼吸室放入少量人工水草,为幼蟹提供躲藏场所。试验期间将呼吸室密封,通过O2探头每10 min测量并记录溶解氧浓度。
1.3.2 排氨率测定 试验持续30 min。试验前后在呼吸室分别取50 mL水样,采用纳氏试剂分光光度法进行氨氮含量测定。
1.3.3 窒息点测定 使用相同装置,幼蟹置于密闭呼吸室,每10 min测量并记录溶解氧浓度,直至幼蟹出现不再爬动、附肢伸直僵硬、腹部向上等症状,且实时溶解氧浓度30 min内变化微小,此时的溶解氧浓度即为窒息点。
1.4 考察指标及其计算公式
耗氧率R0[mg/(g·h)]=[(DO0-DOt)×V]/(W×T)
排氨率RN[mg/(g·h)]=[(Nt-N0)×V]/(W×T)
氨商AQ=RN/R0
能量代谢率Rm(J/g)=k×R0
式中:DO0为试验开始时呼吸室中的溶解氧浓度(mg/L),DOt为试验结束时呼吸室中的溶解氧浓度(mg/L),V为呼吸室体积(L),W为试验开始前中华绒螯蟹幼蟹的体质量(g);T为试验持续时间(h),N0为试验开始时呼吸室中的氨氮浓度(mg/L),Nt为试验结束时呼吸室中的氨氮浓度(mg/L),k为氧卡系数(13.56 J/mg)。
1.5 统计分析
试验数据采用SPSS 23.0分别进行单因素和双因素方差分析,通过HSD多重比较检验组间差异显著性,并以GraphPad Prism 8制图。
2 结果与分析
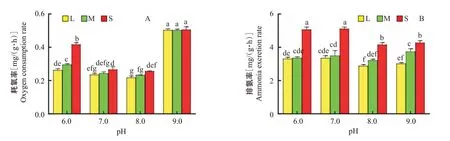
2.1 温度对中华绒螯蟹幼蟹耗氧率和排氨率的影响
2.1.1 温度对中华绒螯蟹幼蟹耗氧率的影响 如图1-A所示,随着温度的升高,L组、M组和S组的幼蟹耗氧率均呈升高趋势,且耗氧率随幼蟹体质量的增加而降低。L组幼蟹的耗氧率从10 ℃到20 ℃呈显著升高趋势(P<0.05,下同),而20 ℃到30 ℃无显著变化(P>0.05,下同);M组幼蟹的耗氧率从10 ℃到20 ℃呈显著升高趋势,20 ℃到25 ℃无显著变化,至30 ℃时又显著升高;S组幼蟹的耗氧率从10 ℃到30 ℃均呈显著升高趋势。在10和15 ℃下,S组幼蟹的耗氧率显著高于L组,M组与S组和L组的差异均不显著;在30 ℃下,幼蟹耗氧率表现为L组 2.1.2 温度对中华绒螯蟹幼蟹排氨率的影响 如图1-B所示,幼蟹排氨率随温度的升高呈不断上升趋势。L组幼蟹的排氨率在10~20 ℃间无显著差异,从25 ℃到30 ℃则呈显著升高趋势;S组和M组幼蟹的排氨率从10 ℃到30 ℃均呈显著升高趋势。在10 ℃下,幼蟹排氨率表现为L组>M组>S组,组间差异显著;在15和20 ℃下,S组幼蟹的排氨率显著高于L组和M组;在25和30 ℃下,幼蟹排氨率则表现为L组 图1 温度对不同规格中华绒螯蟹幼蟹耗氧率和排氨率的影响Fig.1 Effects of temperature on oxygen consumption rate and ammonia excretion rate of juvenile E.sinensis with different sizes 2.1.3 回归分析结果 在10~30 ℃范围内,中华绒螯蟹幼蟹的耗氧率与体质量呈负相关,其回归方程为R0=a1Wb1(a为代谢水平,b为体质量指数)。在10 ℃下,幼蟹的排氨率与体质量呈正相关,在15~30 ℃下,幼蟹的排氨率与体质量呈负相关,其回归方程为RN=a2Wb2。其中,a1取值范围为0.1901~1.3525,b1取值范围为-0.470~-0.091,a2取值范围为0.6517~31.534,b2取值范围为-0.504~0.5232(表2)。 表2 不同温度下体质量对中华绒螯蟹幼蟹耗氧率和排氨率的回归分析结果Table 2 Regression analysis results of body mass on oxygen consumption rate and ammonia excretion rate of juvenile E.si‐nensis under different temperatures 2.2.1 pH对中华绒螯蟹幼蟹耗氧率的影响 如图2-A所示,在pH 6.0~9.0范围内,随着pH的升高,不同规格中华绒螯蟹幼蟹的耗氧率均呈先降低后升高的变化趋势。在pH 7.0和pH 8.0处理下,L组和M组幼蟹的耗氧率无显著差异,但经pH 9.0处理后显著升高。S组幼蟹的耗氧率在pH 7.0和pH 8.0处理下显著低于pH 6.0和pH 9.0处理。此外,在pH 6.0处理下,S组幼蟹的耗氧率显著高于M组和L组;在其他pH处理下,S组和M组间无显著差异。 2.2.2 pH对中华绒螯蟹幼蟹排氨率的影响 如图2-B所示,在pH 6.0~9.0范围内,S组幼蟹的排氨率显著高于L组和M组,且在pH 8.0和pH 9.0处理下的排氨率较在pH 6.0和pH 7.0处理下显著降低。L组和M组幼蟹的排氨率在pH 6.0~9.0范围内变化较小,M组在pH 8.0处理下的排氨率有所下降。在pH 9.0处理下,不同规格中华绒螯蟹幼蟹的排氨率存在显著差异,表现为L组 图2 pH对不同规格中华绒螯蟹幼蟹耗氧率和排氨率的影响Fig.2 Effects of pH on oxygen consumption rate and ammonia excretion rate of juvenile E.sinensis with different sizes 2.2.3 回归分析结果 在pH 6.0~9.0范围内,中华绒螯蟹幼蟹的耗氧率和排氨率与体质量均呈负相关,对应的回归方程分别为R0=a3Wb3和RN=a4Wb4。其中,a3取值范围为0.3125~0.7483,b3取值范围为-0.352~-0.004,a4取值范围为6.6507~8.5568,b4取值范围为-0.324~-0.266(表3)。 表3 不同pH下体质量对中华绒螯蟹幼蟹耗氧率和排氨率的回归分析结果Table 3 Regression results of body mass on oxygen consump‐tion rate and ammonia excretion rate of juvenile E.sinensis un‐der different pH 2.3.1 温度对中华绒螯蟹幼蟹窒息点的影响 如图3-A所示,不同规格中华绒螯蟹幼蟹的窒息点均以10 ℃时最高,且显著高于15~30 ℃下的窒息点。L组幼蟹的窒息点在15 ℃和20 ℃、20 ℃和30 ℃时无显著差异,以25 ℃时的窒息点最低,显著低于其他温度处理;M组幼蟹的窒息点在15 ℃和30 ℃间也无显著差异,也是以25 ℃时的窒息点显著低于其他温度处理;S组幼蟹的窒息点随温度的升高呈逐渐下降趋势,除了在25 ℃和30 ℃间无显著差异外,其他温度处理间均存在显著差异。 2.3.2 pH对中华绒螯蟹幼蟹窒息点的影响 如图3-B所示,不同规格中华绒螯蟹幼蟹的窒息点均随pH的升高呈先降低后升高的变化趋势。在L组和M组中,其幼蟹窒息点在任意2个pH处理间均存在显著差异;S组幼蟹的窒息点在pH 6.0和pH 9.0处理间无显著差异,但二者显著高于其他pH处理。此外,S组幼蟹的窒息点在不同pH处理下均显著高于L组和M组,在pH 9.0处理下表现为L组 图3 温度和pH对不同规格中华绒螯蟹幼蟹窒息点的影响Fig.3 Effects of temperature and pH on asphyxiation point of juvenile E.sinensis with different sizes 2.4.1 温度对中华绒螯蟹幼蟹氨商的影响 如图4-A所示,不同规格中华绒螯蟹幼蟹的氨商在10~30 ℃范围内均呈先降低后升高的变化趋势。L组幼蟹的氨商在15 ℃和25 ℃间无显著差异,在其他温度处理下则存在显著差异;M组幼蟹的氨商在15 ℃和20 ℃、25 ℃和30 ℃间均无显著差异,以20 ℃下的氨商最低;S组幼蟹以在30 ℃下的氨商最高,显著高于其他温度处理,而在其他温度处理下的氨商差异均不显著。此外,在10 ℃下幼蟹的氨商排序为S组 2.4.2 pH对中华绒螯蟹幼蟹氨商的影响 如图4-B所示,随pH的升高,不同规格中华绒螯蟹幼蟹的氨商均呈先升高后降低的变化趋势。L组幼蟹的氨商在pH 6.0~8.0间无显著差异,在pH 9.0下显著低于其他pH处理组。M组和S组幼蟹的氨商在pH 7.0和pH 8.0处理下均呈升高趋势,且二者间无显著差异,在pH 9.0处理下则显著降低。此外,在pH 7.0和pH 8.0处理下S组幼蟹的氨商显著高于M组和L组。 图4 温度和pH对不同规格中华绒螯蟹幼蟹氨商的影响Fig.4 Effects of temperature and pH on ammonia quotient of juvenile E.sinensis with different sizes 2.5.1 温度对中华绒螯蟹幼蟹能量代谢率的影响如图5-A所示,随着温度的升高,不同规格中华绒螯蟹幼蟹的能量代谢率均呈上升趋势。幼蟹在10 ℃下的能量代谢率最低,而30 ℃下的能量代谢率最高。在10、15、20和25 ℃下,M组和L组幼蟹的能量代谢率无显著差异,而S组幼蟹的能量代谢率显著高于M组和L组。在30 ℃下,L组、M组和S组幼蟹的能量代谢率排序为S组>M组>L组,且组间存在显著差异。 图5 温度和pH对不同规格中华绒螯蟹幼蟹能量代谢率的影响Fig.5 Effects of temperature and pH on energy metabolic rate of juvenile E.sinensis with different sizes 2.5.2 pH对中华绒螯蟹幼蟹能量代谢率的影响如图5-B所示,随着pH的升高,不同规格中华绒螯蟹幼蟹的能量代谢率呈先降低后升高的变化趋势,均在pH 9.0处理下达最高值。在pH 6.0处理下,幼蟹的能量代谢率排序为S组>M组>L组,组间差异显著;在pH 8.0和pH 9.0处理下,不同规格中华绒螯蟹幼蟹间的能量代谢率均无显著差异。 温度是影响虾蟹呼吸代谢最重要的环境因子(林小涛等,2000)。在适宜的温度范围内,随着温度的升高,虾蟹体内代谢相关酶的活性增强,代谢速率加快,导致耗氧率和排氨率升高。高于或低于适宜温度时,均会抑制机体代谢相关酶活性,影响机体的生理功能,致使能量代谢率降低,即耗氧率和排氨率降低(罗嘉俊等,2020)。已有研究表明,罗氏沼虾(Mucrobrachium rosenbergii)幼虾的耗氧率和氨氮、尿素氮、有机氮和总氮排泄在17~32 ℃范围内随温度的升高而升高(Chen and Kou,1996);三疣梭子蟹的耗氧率和排氨率随温度的升高而升高,在27 ℃时达最大值(戴超等,2014);中华原钩虾的耗氧率和排氨率随温度的升高整体上呈上升趋势(曹善茂等,2015)。本研究结果表明,随着温度的上升,中华绒螯蟹幼蟹的耗氧率、排氨率和能量代谢率均呈上升趋势,说明温度升高加快其呼吸代谢;此外,耗氧率在20~25 ℃间的升幅与其他温度相比较小,排氨率在15~20 ℃间的升幅较其他温度变化相比较小,而能量代谢率20~25 ℃间的升幅较其他温度相对较小,表明中华绒螯蟹在适宜的温度范围内其呼吸代谢相对稳定。在10 ℃或30 ℃下,中华绒螯蟹幼蟹的耗氧率和排氨率与20 ℃下的存在显著差异,表明10 ℃或30 ℃不适合中华绒螯蟹幼蟹生长发育,与李青和陈永祥(2019)的研究结果一致,即环境温度过高或过低均会影响虾蟹的代谢、生长、蜕壳和存活。综合考虑温度、氨商和能量代谢率对中华绒螯蟹幼蟹耗氧率和排氨率的影响,可确定20~25 ℃更加适宜幼蟹生长,与幼蟹在生产养殖中得到的最适温度吻合。 甲壳类动物对环境pH较敏感。环境pH变化会影响甲壳类动物的存活率、离子平衡、蜕皮频率、性成熟、繁殖及体质量增长等(Allan and Maguire,1992;Chen and Chen,2003)。当环境pH高于或低于某一范围时,会改变甲壳类生物的呼吸活动,影响其从外界吸取氧的能力,进而影响到耗氧率和排氨率(冯雪等,2012)。不同水产动物在不同pH下的呼吸代谢规律各不相同。朱爱意等(2007)研究发现,当pH适合时褐菖鲉耗氧率较低,超出pH适合范围后褐菖鲉通过改变机体代谢状况以适应环境pH,其耗氧率升高;梁华芳等(2012)研究表明,波纹龙虾的耗氧率随着pH的升高而降低;曹善茂等(2015)研究发现中华原钩虾耗氧率和排氨率均随pH的升高呈先升高后下降的变化趋势;姜宏波等(2017)研究证实中华小长臂虾在pH 6.0~9.0处理下的耗氧率和排氨率随pH升高呈先下降后升高的变化趋势。本研究结果表明,中华绒螯蟹幼蟹在pH 8.0处理下的耗氧率、排氨率和能量代谢率均最低,而在pH 6.0和pH 9.0处理下幼蟹的耗氧率、排氨率和能量代谢率明显升高,即不适宜的pH能提高中华绒螯蟹的呼吸代谢。呼吸代谢提高可能是机体的保护性响应机制,有助于机体应对不利环境的刺激,与朱爱意等(2007)、章龙珍等(2009)的研究结果一致,即过高或过低pH均致使幼蟹发生应激反应,影响鳃组织进行离子交换,进而引起呼吸代谢异常。可见,pH 8.0更加适宜中华绒螯蟹幼蟹的生长,与刘金生等(2016)研究发现的中华绒螯蟹幼蟹最适生长pH相符。 甲壳类生物的代谢率受体质量影响显著,代谢率与体质量间的关系可用R=aWb表示。式中,a为代谢水平,b为体质量指数(李俊辉等,2010)。a的大小受生物种类和环境因子的影响,b则与生物所处发育阶段、摄食及温度和盐度等条件有关系(王崇懿等,2020)。本研究结果表明,在不同温度和pH下,除10 ℃时的幼蟹排氨率随体质量的增加而升高外,中华绒螯蟹幼蟹的耗氧率和排氨率均随体质量的增加而降低。代谢率随体质量的增加而降低,与皱肋文蛤(Meretrix lyrata)(栗志民等,2011)、弹涂鱼(Boleophthalmus pectinirostris)(Cao and Wang, 2014)、虎斑乌贼(Sepia pharaonis)幼体(王鹏帅等,2017)及三疣梭子蟹(Portunus trituberculatus)(李朝华等,2017)等水产动物的研究结果相似。这可能与甲壳类生物在生长过程中各组织的比重有关,肝脏和肾脏等组织的代谢率高于肌肉、脂肪等其他组织(邓超准等,2015)。幼蟹在生长过程中会累积肌肉和脂肪含量,导致肝脏等比值相对减少,从而导致耗氧率降低(李朝华等,2017)。 窒息点是水生生物对溶解氧需求和耐低氧能力的重要参数(李育森等,2019)。窒息点与物种、温度、体质量、pH和氧张力等因素有关。通过对比相似条件下不同种类甲壳动物的窒息点(表4),结果发现中华绒螯蟹幼蟹的窒息点与其他甲壳类动物的窒息点范围存在一定差异,说明不同物种具有不同的窒息点。大部分水产生物的窒息点随环境温度的升高而升高,如红鳌鳌虾(Chearx quadricarinatusvon Martens)(陈孝煊等,1996)、中华胭脂鱼(Myxocyp‐rinus asiaticus)(金华等,2016)及罗氏沼虾(陈琴等,2002a)等。但本研究并未发现温度对中华绒螯蟹幼蟹的窒息点产生规律性影响,在25 ℃下其窒息点最低,表明中华绒螯蟹在适宜温度下具有更好的低氧耐受性。 表4 不同种类甲壳类动物的窒息点比较Table 4 Asphyxiation point comparison of different crustaceans 体质量对窒息点的影响有2种类型:一类是窒息点随体质量的增加而增加,呈正相关;另一类是窒息点随着体质量的增加而减小,呈负相关(李朝华等,2017)。本研究中,中华绒螯蟹幼蟹在10~25 ℃下的窒息点均随体质量的增加而减小,与陈琴等(2002c)在对合浦绒螯蟹豆蟹研究中得到的结果相似;而在30 ℃下幼蟹的窒息点随体质量的增加而增大,与陈琴等(2002b)在对南美白对虾仔虾研究中得到的结果相似。水体pH过高或过低均会影响幼蟹摄取氧的能力,王辉等(2011)研究发现尼罗罗非鱼幼鱼在pH 8.06处理下的窒息点最低,增加或降低pH能有效提高幼鱼的窒息点。同样,本研究发现在pH 8.0处理下中华绒螯蟹幼蟹的窒息点最低,增加或降低pH均会提高幼蟹的窒息点。 温度和pH变化对不同规格中华绒螯蟹幼蟹呼吸代谢指标均有显著影响,其适宜生长温度为20~25 ℃,适宜生长pH为8.0,过高或过低均会对中华绒螯蟹幼蟹机体造成应激反应,进而影响其正常生长及存活。

2.2 pH对中华绒螯蟹幼蟹耗氧率和排氨率的影响

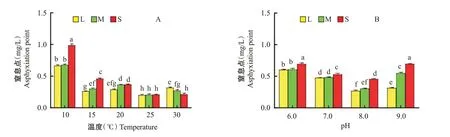
2.3 温度和pH对中华绒螯蟹幼蟹窒息点的影响
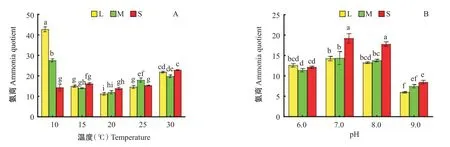
2.4 温度和pH对中华绒螯蟹幼蟹氨商的影响
2.5 温度和pH对中华绒螯蟹幼蟹能量代谢率的影响

3 讨论
3.1 温度对中华绒螯蟹幼蟹呼吸代谢的影响
3.2 pH对中华绒螯蟹幼蟹呼吸代谢的影响
3.3 体质量对中华绒螯蟹幼蟹呼吸代谢的影响
3.4 温度、pH和体质量对中华绒螯蟹幼蟹窒息点的影响
4 结论
