罗氏沼虾野田村病毒和十足目虹彩病毒1二重荧光定量PCR检测方法的建立及应用
2022-08-09黄玉英杨明伟谭红连韦信贤黄光华童桂香
黄玉英,杨明伟,谭红连,梁 正,曾 兰,韦信贤,黄光华*,童桂香*
(1广西水产科学研究院/广西水产遗传育种与健康养殖重点实验室,广西南宁 530021;2广西水产畜牧学校,广西南宁 530021)
0 引言
【研究意义】罗氏沼虾野田村病毒(nodavirus,MrNV)是一种单股正链RNA病毒,隶属于野田村病毒科(Nodaviridae)(黄光华等,2015),主要感染罗氏沼虾苗种,可造成淡化后仔虾的死亡率高达90%,患病虾以肌肉白浊、白斑或白尾等症状为临床特征,因此被称为罗氏沼虾白尾病(White tail disease,WTD)(姜兰等,2002;陈之航等,2015)。WTD是世界动物卫生组织(OIE)规定必须申报的疫病,自报道以来曾在多个国家和地区广泛流行,发病快、死亡率高,给罗氏沼虾养殖业的健康发展造成极大危害,我国已将其列为二类动物疫病(Cheng and Chen,1998;钱冬等,2002;陈之航等,2015)。十足目虹彩病毒1(Decapod iridescent virus 1,DIV1)是近年来虾类养殖中新出现的传染性病原,隶属于虹彩病毒科(Iridoviridae)十足目虹彩病毒属()(Chen et al.,2019),可感染罗氏沼虾、凡纳滨对虾、红螯螯虾、中国对虾及青虾等主要养殖虾品种,并造成大批量死亡(Xu et al.,2016;Li et al.,2017;Qiu et al.,2017),也可感染河虾、河蟹、螺蛳及浮游生物等水生生物成为传染源(王甘翔等,2018)。由于DIV1的多宿主特征,其传播迅速且广泛,DIV1疫情在我国虾类养殖各区域相继暴发,造成巨大经济损失,且疫情有进一步扩大和加剧的趋势,给我国虾类养殖业带来严峻挑战,农业农村部已将DIV1引起的虾虹彩病毒病(Decapod iri‐descent virus 1 disease,DIV1D)定为新发疫病,并暂时参照一类疫病处置(农渔技疫函〔2018〕95号)。WTD和DIV1D是罗氏沼虾养殖中危害最严重的2种病毒性疾病,目前尚无特效药物及治疗方法,切断病毒传播途经仍是最有效的预防措施。因此,亟待建立一种能同时鉴别MrNV和DIV1的检测方法,为虾苗检疫、亲虾筛选及疾病诊断等提供更高效的技术手段。【前人研究进展】目前,针对MrNV的检测方法有胶体金试纸条、ELISA、RT-PCR、荧光定量RT-PCR及RT-LAMP 等(Romestand and Bonami,2003;Sri Widada et al.,2003;Pillai et al.,2006;童桂香等,2012;黄光华等,2015),关于DIV1的检测方法已报道有套式PCR、荧光定量PCR、LAMP和RPA等(Qiu et al.,2017,2018;韦信贤等,2020;邹莹等,2020;Tong et al.,2022)。这些检测方法在实际检测工作中各具优缺点,RT-PCR需进行PCR和电泳分析,且敏感性较低;套氏PCR敏感性高,但需进行两轮PCR及电泳分析,检测耗时长,且多次开盖操作易造成交叉污染;ELISA准确性高,但操作繁琐、耗时长;LAMP灵敏、快速,但易出现假阳性。相对而言,实时荧光定量PCR具有特异性强、灵敏度高、重复性好、定量准确、自动化程度高、检测速度快、全封闭反应等优点,已成为实验室诊断最常用的检测方法(钟江华等,2011;隗黎丽,2012)。多重荧光定量PCR是在荧光定量PCR的基础上,利用几种不同荧光基团的组合,结合仪器对不同通道荧光的检测能力实现对多个靶标的实时定量检测分析,应用于病原检测时可实现对多种病原进行同步检测,具有简便、高效、检测成本低等优势。姜利霞等(2021)建立了可同时检测牛疱疹病毒、牛呼吸道合胞体病毒、牛副流感病毒3型和牛病毒性腹泻病毒单一或混合感染的四重荧光定量PCR;史喜菊等(2021)建立了可用于伪狂犬病病毒、猪细小病毒和猪圆环病毒2等3种病毒混合感染检测和鉴别诊断的三重荧光定量PCR;王然等(2021)建立了可快速检测6种常见下呼吸道感染病原菌的多重荧光定量PCR。【本研究切入点】MrNV和DIV1是罗氏沼虾养殖中危害最严重的传染性病原,但目前主要是采用MrNV和DIV1的单重荧光定量PCR分别进行检测,操作繁琐,耗时费力,因此亟待建立一种能同时检测MrNV和DIV1的二重荧光定量PCR,实现对罗氏沼虾WTD和DIV1D的快速诊断及科学防控。【拟解决的关键问题】采用TaqMan-MGB探针技术建立能同时检测MrNV和DIV1的二重荧光定量PCR,以提高MrNV和DIV1检测的效率,为WTD和DIV1D的临床诊断及疫情监测提供一种更简便和高效的检测方法。
1 材料与方法
1.1 试验材料
MrNV、DIV1、白斑综合征病毒(WSSV)、虾肝肠胞虫(EHP)、传染性皮下和造血器官坏死病毒(IHHNV)阳性材料由广西水生动物疫病监控中心实验室保存提供;无MrNV和DIV1感染的罗氏沼虾由国家级广西南宁罗氏沼虾良种场提供;117份罗氏沼虾样品为2020年采自广西南宁、柳州和百色等地的养殖场。2×F8 Fast Long PCR MasterMix、病毒基因组DNA/RNA核酸快速提取试剂盒、琼脂糖凝胶回收试剂盒、质粒小量提取试剂盒购自北京艾德莱生物技术有限公司;pGM-T载体、氨苄青霉素、大肠杆菌DH5α感受态细胞及琼脂糖购自天根生化科技(北京)有限公司;T7体外转录试剂盒及DNase I购自Fermentas 公司;DL500 DNA Marker、I、EASY Dilution(for Real Time PCR)和OneStep PrimeScriptRT-PCR Kit(Perfect Real Time)购自宝生物工程(大连)有限公司;无水乙醇、氯仿、异丙醇等试剂均为国产分析纯。主要仪器设备为安捷伦公司的Mx3005P荧光定量PCR仪。
1.2 MrNV和DIV1二重荧光定量PCR检测方法的建立
1.2.1 引物与探针设计及合成 MrNV的衣壳蛋白(Capsid protein,CP)基因和DIV1的主衣壳蛋白(Major capsid protein,MCP)基因均为病毒主要功能基因,且其序列含有多个保守区域(Tidona et al.,1998),故选取MrNV的CP基因(MrNV-CP)和DIV1的MCP基因(DIV1-MCP)为检测目标基因。采用Primer Express v3.0分别在MrNV-CP基因(HQ287005)和DIV1-MCP基因(KY681039)的保守区域设计多组特异性引物和TaqMan-MGB探针,委托生工生物工程(上海)股份有限公司合成。其中,MrNV和DIV1探针的5'端分别标记HEX和FAM荧光染料、3'端均标记MGB基团。经预试验测试筛选,各选择一套效果较好的引物及TapMan-MGB探针(表1)用于二重荧光定量PCR检测方法的建立。

1.2.2 病毒核酸提取及标准品制备 取阳性病料组织按1∶2(w/v)的比例加入生理盐水,匀浆,离心收集200.0 μL上清液,按照病毒基因组DNA/RNA快速提取试剂盒说明分别提取MrNV、DIV1、WSSV、IHHNV和EHP的核酸,最后加50.0 μL洗脱缓冲液溶解,病毒DNA置于-20 ℃冰箱保存,病毒RNA置于-70 ℃冰箱保存。参照黄光华等(2015)的方法,制备重组质粒pGM-T-CP和pGM-T-MCP;提取pGM-T-CP质粒DNA,以I单酶切使质粒线性化后采用琼脂糖凝胶试剂盒回收纯化;以线性化pGM-T-CP质粒DNA为模板,T7体外转录试剂盒体外转录获得的RNA为检测MrNV的标准品RNA,pGM-T-MCP质粒DNA则直接作为检测DIV1的标准品DNA。使用核酸蛋白分析仪分别测定MrNV标准品RNA和DIV1标准品DNA的纯度和浓度,并换算成拷贝数:拷贝数(Copies/μL)=6.02×10×(ng/μL×10)÷(RNA长度×340)/(DNA长度×660);采用10倍梯度稀释,将标准品系列稀释成1.0×10~1.0×10Copies/μL,-40 ℃保存备用。
1.2.3 二重荧光定量PCR退火温度优化 参考各引物的退火温度(Tm),以1.0×10、1.0×10和1.0×10Copies/μL等3个浓度的MrNV标准品RNA和DIV1标准品DNA等比混合液为模板,按1 ℃的梯度在58~62 ℃范围内分别进行二重荧光定量PCR扩增,以获得较低值及较高相对荧光强度增加值(ΔRn)时的退火温度最佳。
1.2.4 二重荧光定量PCR检测体系优化 选择1.0×10、1.0×10和1.0×10Copies/μL等3个不同浓度的标准品RNA/DNA为模板,参考黄国秋等(2017)的方法,先进行单个病毒检测体系优化;再以浓度为1.0×10Copies/μL的2种标准品等比混合液为模板,进行二重荧光定量PCR检测体系优化,以确定最佳的引物和探针浓度。
1.2.5 标准曲线建立及敏感性试验 取2.0 μL的10倍梯度系列稀释MrNV标准品RNA和DIV1标准品DNA同梯度等比混合液(1.0×10~1.0×10Copies/μL)为模板,以优化后的二重荧光定量PCR进行扩增,每个梯度设3个平行;参考韦信贤等(2020)的方法建立标准曲线和标准方程,并判断方法的敏感性。
1.2.6 特异性试验 运用优化后的二重荧光定量PCR对MrNV、DIV1、WSSV、IHHNV和EHP的核酸进行检测,观察有无出现扩增曲线及值,评价方法的特异性。
1.2.7 重复性试验 以1.0×10、1.0×10和1.0×10Copies/μL等3个梯度的MrNV标准品RNA和DIV1标准品DNA同梯度等比混合液为模板,分别在第1 d、第7 d和第14 d进行重复试验,每个梯度设3个平行;计算组内及组间值的变异系数(CV),评价标准品和二重荧光定量PCR的稳定性。
1.3 二重荧光定量PCR临床应用
取300 mg临床样品按1.2.2的方法提取病毒核酸,分别用二重荧光定量PCR和套式PCR(DB 45/T 942—2013和SC/T 7237—2020)对117份罗氏沼虾临床样品进行MrNV和DIV1检测,比较2种方法检测结果的吻合度,评价二重荧光定量PCR对临床样品检测的可靠性和实用性。
2 结果与分析
2.1 标准品制备及鉴定结果
分别以MrNV标准品RNA和DIV1标准品DNA为模板进行PCR扩增,均可获得相应的目的片段(图1)。PCR产物经回收纯化后克隆至pGM-T载体上,经PCR筛选、测序鉴定和BLAST同源比对,证实目的片段已正确插入pGM-T载体,表明重组质粒pGM-TCP和pGM-T-MCP构建成功。分别提取阳性克隆质粒,其中以pGM-T-CP质粒线性化DNA为模板体外转录获得的RNA浓度为7.6 ng/μL,换算成拷贝数为4.3×10Copies/μL,OD/OD为1.93,符合标准品的要求;pGM-T-MCP质粒的DNA浓度为113 ng/μL,换算成拷贝数为3.2×10Copies/μL,OD/OD为1.86,也可作为试验标准品。

2.2 二重荧光定量PCR反应条件优化结果
对二重荧光定量PCR的退火温度、引物和探针使用终浓度进行优化,最终确定反应体系20.0 μL:2×One Step RT-PCR Buffer Ⅲ10.0 μL,PrimeScript RT Enzyme Mix II 0.4 μL,ExHS(5 U/μL)0.4 μL,MrNV 上、下游引物MrNV-qF/MrNV-qR(10 μmol/L)各0.8 μL和探针MrNV-qP(5 μmol/L)1.2 μL,DIV1上、下游引物DIV1-qF/DIV1-qR(10 μmol/L)及探针DIV1-qP(5 μmol/L)各0.8 μL,ROX Reference Dye II(50×)0.4 μL,核酸模板2.0 μL,灭菌DEPC水补足至20.0 μL。以健康无MrNV和DIV1感染罗氏沼虾肝胰腺组织提取的核酸为阴性对照,以灭菌DEPC水为空白对照。按照试剂盒说明进行扩增操作,其中,反转录程序:42 ℃5 min,95 ℃10 s;荧光定量PCR扩增程序:95 ℃5 s,60 ℃45 s,进行40个循环。
2.3 二重荧光定量PCR标准曲线
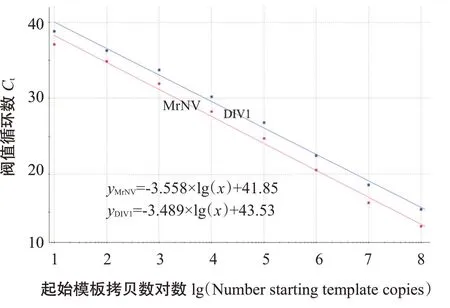
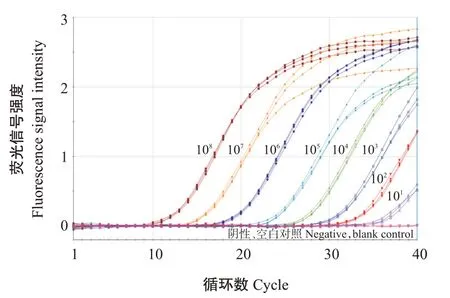
采用优化后的二重荧光定量PCR对10倍系列梯度的MrNV标准品RNA和DIV1标准品DNA同梯度等比混合液(1.0×10~1.0×10Copies/μL)进行扩增,结果(图2)显示,高浓度标准品的扩增曲线呈典型的S形,低浓度标准品的扩增曲线因扩增未达平台期而呈半S形,阴性对照和空白对照均未出现扩增曲线。利用Mx3005P荧光定量PCR仪自带的软件进行分析,横坐标为起始拷贝数()对数、纵坐标为值()绘制相应的标准曲线(图3),其标准曲线方程分别为:=-3.558×lg()+41.85,Eff.(扩增效率)和RSq(相关系数方值)分别为91.0%和0.994;=-3.489×lg()+43.53,Eff.和RSq分别为93.5%和0.994。可见,应用TaqMan-MGB探针建立的二重荧光定量PCR对MrNV标准品RNA和DIV1标准品DNA均具有很高的扩增效率,制定的标准曲线线性关系良好,能实现同时定量分析MrNV和DIV1。

2.4 二重荧光定量PCR的敏感性
二重荧光定量PCR的敏感性试验结果表明,MrNV标准品RNA模板为100和10 Copies/反应时,3 个平行试验的值分别为34.00、34.23、34.35和37.15、37.46、37.69;DIV1标准品DNA模板为100和10 Copies/反应时,3个平行试验的值分别为34.95、34.99、35.36和37.25、38.40、38.87,且均获得明显的扩增曲线(图4和图5),说明二重荧光定量PCR检测MrNV和DIV1的灵敏度均低至10 Copies/反应。但在实际应用中,为保证检测结果的可靠性和准确性,建议以值35.00为界限,当值≤35.00且有扩增曲线,判定为MrNV或DIV1阳性;值>35.00同时有扩增曲线,需重复检测1次,若结果一致判定为MrNV或DIV1阳性,重复结果无扩增曲线则判定为MrNV或DIV1阴性。

2.5 二重荧光定量PCR的特异性
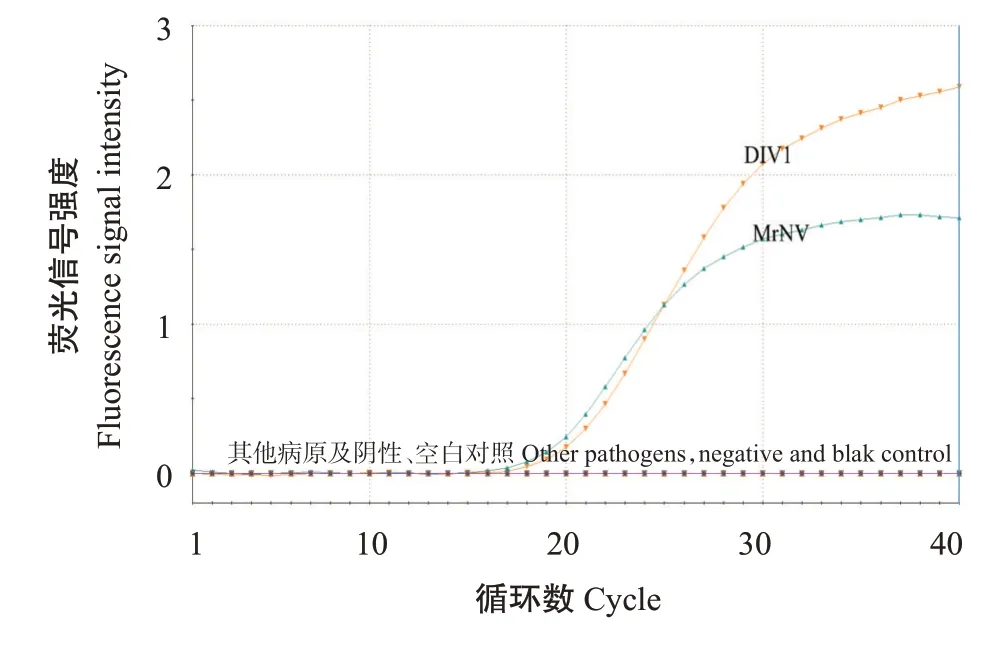
以建立的二重荧光定量PCR对虾类常见主要病原MrNV、DIV1、WSSV、IHHNV和EHP的核酸进行检测,结果(图6)显示只有MrNV和DIV1出现扩增曲线,对应的值分别为20.69和21.60,判为阳性;WSSV、IHHNV、EHP及阴性对照、空白对照均未出现扩增曲线,判为阴性。说明建立的二重荧光定量PCR对MrNV和DIV1具有较强的特异性。
2.6 二重荧光定量PCR的重复性
以3个不同浓度(1.0×10、1.0×10和1.0×10Copies/μL)MrNV标准品RNA和DIV1标准品DNA等比混合液为模板的重复试验结果表明,二重荧光定量PCR检测MrNV的组内试验变异系数为0.31%~0.93%,组间试验变异系数为0.96%~1.33%;二重荧光定量PCR检测DIV1的组内试验变异系数为0.35%~0.81%,组间试验变异系数为0.78%~1.04%。表明以建立的二重荧光定量PCR对MrNV和DIV1进行检测具有较好的重复性,同时证实制备的MrNV标准品RNA和DIV1标准品DNA均具有很好的稳定性,可作为标准品和阳性对照使用。
2.7 二重荧光定量PCR检测临床样品的适用性
应用建立的二重荧光定量PCR和国内现行有效标准的套式PCR分别对117份罗氏沼虾临床样品进行检测,结果如表3和表4所示。在MrNV检测(表3)中,有6份样品用2种方法检测均呈阳性,值为19.37~34.13,根据标准曲线=-3.558×lg()+41.85计算,得知MrNV拷贝数在1.48×10~2.08×10Copies/反应,罗氏沼虾组织中的MrNV含量为3.7×10~5.2×10Copies/mg;有1份样品的二重荧光定量PCR检测呈阳性而套式PCR检测呈阴性,值为36.71,MrNV拷贝数为28 Copies/反应,罗氏沼虾组织中的MrNV含量约7 Copies/mg;有110份样品经2种方法检测均呈阴性,即2种检测方法的符合率为99.15%。

在DIV1检测(表4)中,有11份样品经2种方法检测均呈阳性,值为17.12~34.89,根据标准曲线=-3.489×lg()+43.53计算,得知DIV1拷贝数在2.99×10~3.71×10Copies/反应,罗氏沼虾组织中的DIV1含量为7.5×10~9.3×10Copies/mg;有2份样品的二重荧光定量PCR检测呈阳性而套式PCR检测呈阴性,值分别为36.43和37.16,DIV1拷贝数为108和67 Copies/反应,罗氏沼虾组织中的DIV1含量约27和17 Copies/mg;有103份样品经2种方法检测均呈阴性,即2种检测方法的符合率为97.44%。

3 讨论
罗氏沼虾具有抗逆性强、适应性广及市场价格稳定等特点,是我国淡水养殖的主要虾品种。近年来,由于对虾养殖病害频发、养成率低、风险高,许多对虾养殖户转养罗氏沼虾,加上稻田、藕田及鱼虾混养等养殖模式的推广,罗氏沼虾养殖掀起小高潮,其病害问题也引起广泛关注(罗福广等,2022;罗红等,2022)。近几年对罗氏沼虾病害的监测结果显示,MrNV和DIV1已成为罗氏沼虾养殖中危害最严重的病毒性病原(李清和陈家勇,2020;罗红等,2022);对亲虾和苗种进行严格检疫,切断病毒传入途经,是目前预防病毒病最有效的防控措施。因此,快速、准确检测MrNV和DIV1对有效防控WTD和DIV1D暴发与流行具有重要意义。PCR是病毒核酸检测最理想的方法,分别针对MrNV和DIV1的套式PCR、荧光定量PCR均已有研究报道(童桂香等,2012;黄光华等,2015;Qiu et al.,2018;韦信贤等,2020);但在罗氏沼虾的亲虾筛选、苗种检疫及疫病监测等实际检测工作中采用单重荧光定量PCR对MrNV和DIV1进行检测存在操作繁琐、耗时耗力等局限,因此亟需研发出一种能同时检测MrNV和DIV1的二重荧光定量PCR,以提高MrNV和DIV1的检测效率。

本研究根据MrNV-CP基因和DIV1-MCP基因为病毒主要功能基因且保守性高的特点,以及Taq‐Man-MGB探针的优势(韦信贤等,2010),分别在MrNV-CP基因和DIV1-MCP基因保守区域设计特异性扩增引物及TaqMan-MGB探针;并制备重组质粒pGM-T-CP和pGM-T-MCP,分 别 以pGM-TCP质粒DNA体外转录合成的RNA和pGM-TMCP质粒DNA为标准品,对退火温度及引物和探针使用浓度进行优化,建立能同时检测MrNV和DIV1的二重荧光定量PCR。结果表明,经体外转录合成的MrNV标准RNA及制备的DIV1标准DNA纯度高、稳定性好,可作为标准品和阳性对照;起始模板在1×10~1×10Copies/反应时,核酸模板浓度对数与值具有良好的线性关系,建立的标准曲线能准确反映目的产物的扩增效果;进行40个循环的检测灵敏度可达10 Copies/反应,对罗氏沼虾组织的检测灵敏度约10 Copies/mg;且与其他虾类的常见病原无交叉反应,组内试验和组间试验的变异系数均小于2.00%,具有较好的重复性。此外,扩增过程和产物分析同步完成,整个检测过程能控制在1 h左右。可见,建立的二重荧光定量PCR具有灵敏度高、特异性强、操作简单、快速等优点,可满足临床上同时检测MrNV和DIV1的需求。
应用建立的二重荧光定量PCR和国内现行标准的套式PCR同时对117份罗氏沼虾临床样品进行MrNV和DIV1检测,结果显示,对MrNV检测的符合率为99.15%,对DIV1检测的符合率为97.44%,同为阳性检测结果的样品含目标病毒拷贝数较高(>100 Copies/mg),而检测结果不一致的样品含目标病毒拷贝数较低(<100 Copies/mg);此外,部分目标病毒拷贝数低的样品采用二重荧光定量PCR检测呈阳性,而套式PCR检测呈阴性,说明采用二重荧光定量PCR检测目标病毒拷贝数较低样品时较套式PCR具有更高的灵敏度,可为WTD和DIV1D的临床诊断及病原常规监测提供技术保障。在DIV1检测中,存在套式PCR检测呈阳性而二重荧光定量PCR检测呈阴性的样品,因此在二重荧光定量PCR的实际应用中,对弱阳性样品(值>35.00)的重复试验结果未出现扩增曲线时,可采用套式PCR进行再次验证,以防漏检,确保检测的准确性。罗氏沼虾临床样品检测结果显示,2020年MrNV和DIV1的阳性检出率分别为6.0%和11.0%,即MrNV和DIV1感染在养殖罗氏沼虾中存在零星流行,尤其是病毒在虾体中呈潜伏期感染应引起相关管理部门和从业者的重视和警惕。
4 结论
结合TaqMan-MGB探针技术建立的二重荧光定量PCR能同时检测MrNV和DIV1,且具有灵敏度高、特异性强、重复性好、简便快速的特点,可为WTD和DIV1D的临床诊断及实时监测提供技术保障。
